Хронический миелолейкоз (ХМЛ) – клональное опухолевое заболевание кроветворной ткани, характеризующееся появлением в стволовой кроветворной клетке реципрокной транслокации t(9;22)(q34;q11.2), следствием чего является образование слитного гена BCR-ABL. Указанная хромосомная транслокация приводит к выработке патологического белка р210, являющегося онкопротеином и обладающего тирозинкиназной активностью. Клональность заболевания доказывает факт обнаружения филадельфийской хромосомы как в предшественниках нейтрофилов, так и в предшественниках эозинофилов, базофилов, моноцитов, макрофагов и в эритробластах, мегакариоцитах и даже предшественниках Т-лимфоцитов.
Использование специфических лекарственных препаратов таргетной терапии - специфических ингибиторов BCR-ABL тирозинкиназы, целенаправленно блокирующих повышенную пролиферативную активность лейкозных клеток, позволило достигать максимальную элиминацию опухолевого клона и коренным образом менять прогноз хронического миелолейкоза у большинства больных. Основным ингибитором тирозинкиназ, используемым в лечении больных ХМЛ, у нас в стране является иматиниб.
Различные признаки дисгемопоэза, проявляющиеся в функциональных нарушениях гемопоэтических клеток костного мозга и клеток периферической крови, чаще встречаются у больных ХМЛ в продвинутых стадиях заболевания (фазе акселерации или бластного криза) и могут определять неэффективность проводимой терапии и неблагоприятный прогноз заболевания [14,15]. Тем не менее, нет однозначного мнения – является ли миелодисплазия предфазой развития ХМЛ или признаки дисгемопоэза появляются в кроветворных клетках в процессе опухолевой трансформации под воздействием онкогенных факторов. В литературе встречаются упоминания о появлении неспецифических признаков миелодисплазии (гипосегментацию ядер гранулоцитов по типу аномалии Пельгера – Хюэта или наоборот гиперсегментированность ядер; мегакариоциты с разъединенными ядрами; микромегакариоциты; мегалобластоидные или макроцитарные формы эритроцитов и т.п.) у больных с так называемой «прелейкемией», впоследствие трансформировавшейся в острый или хронический миелолекоз [5]. Также есть немногочисленные данные о развитии вторичной миелодисплазии у больных ХМЛ, получающих в течение длительного времени терапию иматинибом [4, 9, 11]. Некоторые авторы считают, что появление признаков миелодисплазии обусловлено предшествующей противоопухолевой терапией, прежде всего бусульфаном и гидроксимочевиной [9].
Морфологические изменения гемопоэтических клеток характеризуется разнообразием, но не являются специфичными для хронического миелолейкоза и не отражают в полной мере процессы, происходящие в кроветворных клетках. Для оценки обменных процессов, протекающих в кроветворных клетках, а также выявления ранних признаков их дисфункции при ХМЛ более информативным является цитохимическое исследование костного мозга [2].
Цель исследования. В нашей работе проводилось цитохимическое исследование клеток гранулоцитарного и мегакариоцитарного рядов костного мозга больных ХМЛ. Для выявления признаков дисгемопоэза в клетках костного мозга на фоне терапии иматинибом, их связи с развитием цитопений в периферической крови, воспринимающихся как проявление гематологической токсичности препарата, влияние самого иматиниба на процессы созревания, дифференцировки и функционирования клеток гранулоцитарного и мегакариоцитарного ряда.
Материалы и методы. В исследование было включено 36 пациентов, наблюдавшихся в гематологическом отделении клиники Ростовского государственного медицинского университета с марта 2009 по апрель 2012 г. Группу обследуемых составили 17 мужчин и 19 женщин в возрасте от 23 до 85 лет (медиана возраста – 58 лет).
У всех пациентов диагноз ХМЛ был подтвержден цитогенетическим исследованием клеток костного мозга (обнаружение транслокации t(9;22)(q34;q11.2) и/или молекулярно-генетическим методом (обнаружение слитного гена BCR-ABL в клетках костного мозга или крови). Все обследуемые получали иматиниб в дозе от 400 до 800 мг. Медиана продолжительности приема иматиниба составила 18 мес. С целью изучения влияния некоторых фармакокинетических параметров на цитохимические показатели при терапии иматинибом проводили определение концентрации препарата в плазме крови методом высокоэффективной жидкостной хроматографии с детекцией методом тандемной масс-спектрометрии. В работе определяли остаточную концентрацию иматиниба через 24 часа после последнего приема.
В качестве контроля было взято 69 человек в возрасте от 19 до 64 лет, у которых не было выявлено первичных заболеваний кроветворной системы.
При цитохимическом исследовании пользовались полуколичественной оценкой результатов, применяя принцип Астальди, основанный на выявлении различной степени интенсивности специфической окраски. В зависимости от нее исследуемые клетки делили на 4 группы: с отрицательной реакцией (-), слабоположительной (+), положительной (++) и резко положительной (+++). Для количественного выражения результатов подсчитывали 100 клеток определенного вида, дифференцируя их по степени интенсивности окраски, затем число клеток с одинаковой интенсивностью окраски суммировали и вычитали количество клеток без окраски, результат выражали в процентах. [1] Для более объективного суждения о содержании вещества в клетках использовали метод количественной оценки цитохимических реакций, предложенный L.Kaplow в 1955 г. [8] и модифицированный в 1957 г. G. Astaldi и L. Verga. [3] Интенсивность окраски клеток оценивалась на основании определения среднего цитохимического коэффициента L. Kaplow (СЦК). В гранулоцитарных клетках костного мозга изучались: содержание общих липидов по методу H. Shehan, G. Storry c докрашиванием по Лейшману [13], активности пероксидазы по методу Graham-Knoll [6], содержание углеводов (ШИК-реакция с использованием реактива Шиффа йодной кислоты) по методу J. МсМаnus [10], активности щелочной фосфатазы в зрелых гранулоцитах по методу Hayhoe F., Quaglino D. (1958) [7], модифицированного L. Kaplow в 1955 г. [8] Для выявления возможных нарушений созревания клеток гранулоцитарного ряда проводился раздельный подсчет среднего цитохимического коэффициента (СЦК) для незрелых клеток (миелоцитов) и зрелых (сегментоядерных нейтрофилов). В мегакариоцитах изучались: активность альфа-нафтилэстеразы по методу А. Pearse [12] и содержание углеводов (РАS-реакция) по методу J. МcМаnus [10].
Всем обследуемым выполняли исследования общего анализа крови. Фагоцитарная активность лейкоцитов оценивалась по НСТ-тесту: спонтанный и стимулированный фагоцитоз, коэффициент стимуляции.
Cтатистический анализ данных проводился методами описательной статистики и сравнения выборок (с использованием параметрических критериев), корреляционного анализа (коэффициент корреляции Спирмена). Уровень статистической значимости был принят равным 0,05. Все значения в тексте и таблицах представлены в виде среднего значения со стандартным отклонением (М±SD). Полученные данные сравнивались с таковыми в контрольной группе.
Результаты и обсуждение. Цитохимическая характеристика клеток гранулоцитарного ряда больных ХМЛ, получающих терапию иматинибом, представлена в табл. 1.
Таблица 1. Средний цитохимический коэффициент клеток гранулоцитарного ряда у больных ХМЛ, получающих терапию иматинибом
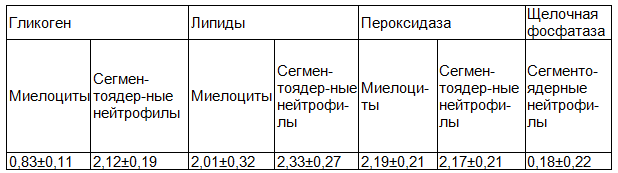
При сопоставлении цитохимических показателей клеток гранулоцитарного ряда у больных ХМЛ с данными контрольной группы было отмечено снижение уровня гликогена и липидов в миелоцитах, снижение активности пероксидазы и щелочной фосфатазы и уровня гликогена в сегментоядерных нейтрофилах. Выявлено повышение содержания липидов в миелоцитах (СЦК 2,01±0,32), при этом в сегментоядерных нейтрофилах этот показатель был снижен (СЦК 2,33±0,27) по сравнению с показателями контрольной группы.
В норме клетки гранулоцитарного ряда дают положительную реакцию, усиливающуюся с увеличением зрелости клетки, поэтому окраску на липиды используют для оценки степени зрелости гранулоцитов. Выявленные нами изменения могут свидетельствовать о нарушении процессов созревания и дифференцировки гранулоцитов костного мозга. В пользу этого свидетельствует также снижение активности пероксидазы в сегментоядерных нейтрофилах (СЦК 2,17±0,21) при нормальных значениях в незрелых клетках (СЦК 2,19±0,21).
Пероксидазы определяют степень зрелости цитоплазмы гранулоцитов и функционирование пластинчатого комплекса Гольджи. Активность пероксидаз выявляется в клетках гранулоцитарного ряда, начиная с миелобласта, постепенно возрастает по мере дифференцировки гранулоцитов, достигая наибольшей интенсивности в сегментоядерных нейтрофилах. Снижение активности этого фермента в зрелых нейтрофилах может быть следствием нарушений, возникающих в ходе пролиферации и дифференцировки клеток-предшественниц гранулоцитарного ряда. При оценке содержания гликогена наблюдалось снижение этого показателя в незрелых клетках гранулоцитарного ряда (0,83±0,11) в сочетании с повышением его содержания в зрелых гранулоцитах (2,12±0,19). В норме по мере созревания гранулоцитов интенсивность окраски на гликоген (РАS-реакция) увеличивается. Поэтому полученные данные противоречат предположению о функциональной незрелости гранулоцитов, так как повышение гранул гликогена в сегментоядерных нейтрофилах свидетельствует о достаточной зрелости этих клеток. С другой стороны, возможно, имеет место дисбаланс между процессами метаболизма в гранулоцитах. Активность щелочной фосфатазы в нейтрофилах костного мозга больных ХМЛ была низкой (СЦК 0,18±0,22). Преобладали нейтрофилы с первой степенью активности.
Результаты сравнения цитохимических показателей клеток гранулоцитарного ряда больных ХМЛ, получающих терапию иматинибом, с данными контрольной группы представлена в табл. 2.
Таблица 2. Цитохимические показатели клеток костного мозга больных ХМЛ, получающих терапию иматинибом
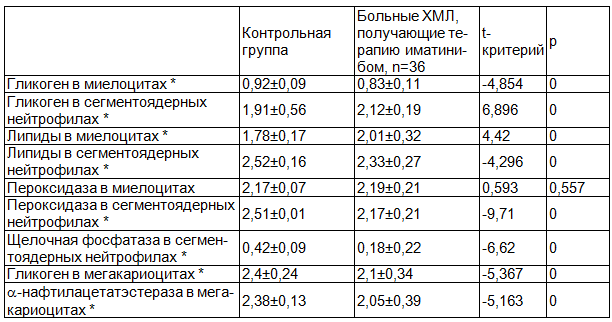
Примечание: * достоверные различия между нормальными значениями и показателями в группе обследуемых больных, р<0,05.
При сопоставлении цитохимических показателей клеток гранулоцитарного ряда костного мозга с их фагоцитарной активностью не выявлено значимой корреляции между содержанием пероксидазы и гликогена в незрелых и зрелых гранулоцитах и функцией фагоцитоза. Хотя, снижение активности пероксидазы, наблюдаемое в зрелых гранулоцитах, предполагает снижение эффективности процессов фагоцитоза. Показатели НСТ-спонтанного теста (106±26,5 у.е.) и показатели НСТ-стимулированного теста (162,8±33 у.е.) были повышены, однако, отмечалось снижение коэффициента стимуляции, Кстим, (1,56±0,19), что может свидетельствовать в пользу снижения адаптационных резервов нейтрофилов и формирования неполноценности фагоцитоза.
Однако, выявлена зависимость между содержанием липидов в сегментоядерных нейтрофилах и показателями спонтанного и стимулированного НСТ-теста. Несмотря на снижение уровня липидов в сегментоядерных нейтрофилах отмечалось повышение показателей спонтанного и стимулированного НСТ-теста (r=-0,47, r=-0,414 соответственно). Наблюдалась прямая корреляционная связь между снижением степени активности ЩФ в сегментоядерных нейтрофилах и уменьшением показателей спонтанного и стимулированного НСТ-теста. (r =+0,375, r =+0,356 соответственно).
Вероятно, повышение активности гликогена и снижение уровня липидов в сегментоядерных нейтрофилах носит компенсаторный характер, т.е. интенсификация обменных процессов компенсирует недостаточную функцию фагоцитоза.
Выявленные признаки дисгранулоцитопоэза у больных ХМЛ не коррелировали со степенью выраженности снижения абсолютного содержания нейтрофилов и уровнем лейкоцитов в периферической крови.
При анализе мегакариоцитарного звена гемопоэза было выявлено достоверное снижение уровня гликогена (СЦК 2,1±0,34) и альфа-нафтилацетатэстразы (СЦК 2,05±0,39) в мегакариоцитах. Учитывая то, что гликоген является одним из основных энергетических субстратов клеток организма, снижение его содержания в мегакариоцитах может говорить о снижении интенсивности обменных процессов. Наблюдаемые изменения свидетельствуют о функциональной неполноценности мегакариоцитарного звена гемопоэза.
При сопоставлении этих данных с уровнем тромбоцитов периферической крови нами выявлена прямая корреляционная связи между активностью гликогена и альфа-нафтилацетатэстразы в мегакариоцитах и уровнем тромбоцитов. (r=+0,79, r =+0,691 соответственно).
Для оценки влияния иматиниба на процессы созревания, дифференцировки и функционирования клеток гранулоцитарного и мегакариоцитарного ряда проведен корреляционный анализ между цитохимическими показателями и концентрацией иматиниба в сыворотке крови. Обнаружена только обратная корреляционная связь между содержанием гликогена в незрелых гранулоцитах и уровнем иматиниба в крови (r=-0,45). Можно предположить, что высокие концентрации иматиниба в сыворотке крови вызывают нарушение созревания клеток гранулоцитарного ряда. Однако, это не подтверждается значимыми корреляциями между показателями пероксидазы и липидов в гранулоцитах и концентрацией иматиниба.
Резюмируя вышеизложенное, можно сделать следующие выводы:
- Цитохимическая оценка процессов метаболизма, протекающих в клетках гранулоцитарного ряда костного мозга больных ХМЛ выявила нарушения функционального созревания клеток, характеризующиеся повышением содержания липидов в незрелых формах и снижением активности пероксидазы - в зрелых. Высокий уровень гликогена и сниженная активность пероксидазы и щелочной фосфатазы в зрелых нейтрофилах свидетельствуют об интенсификации обменных процессов, обеспечивающих фагоцитарную активность этих клеток, компенсирующую нарушение других функций.
- Выявленные признаки дисгранулоцитопоэза у больных ХМЛ не коррелировали со степенью выраженности снижения содержания лейкоцитов, в т.ч. абсолютного числа нейтрофилов, в периферической крови.
- У больных ХМЛ отмечалось достоверное снижение уровня гликогена и АНАЭ в мегакариоцитах костного мозга по сравнению с показателями контрольной группы. Выявленные признаки дисмегакариоцитопоэза коррелировали со степенью выраженности снижения уровня тромбоцитов периферической крови.
- Убедительных данных, свидетельствующих в пользу того, что иматиниб вызывает нарушение созревания и дифференцировки клеток гранулоцитарного и мегакариоцитарного ростков гемопоэза, не получено. Можно предполагать об исходно имеющихся гемопоэтических нарушениях, возможно миелодисплазии, у больных ХМЛ.
