Миеломная болезнь (ММ) – заболевание системы крови, относящееся к парапротеинемическим гемобластозам. Субстратом опухоли являются трансформированные плазматические клетки, продуцирующие патологический белок. Накопление парапротеина приводит к сопутствующим органным поражениям, вызывая, в первую очередь, деструкцию костей, гиперкальциемию, почечную недостаточность, анемию и т.д. Особенности течения гемобластозов зависят от многих факторов, в том числе, и от особенностей иммунного реагирования [7, 8, 12]. Несмотря на все успехи проводимой терапии, выживаемость больных ММ не превышает в среднем 3,8 года [3]. Все это требует поиска новых способов диагностики и лечения заболевания.
Причина возникновения ММ во многом неясна, в силу неизвестных причин ранние пре-В-клетки по мере созревания утрачивают цитоплазматический иммуноглобулин, а поверхностные иммуноглобулины усиленно синтезируются. Превратившись в полностью зрелые плазмоциты, клетки теряют поверхностные иммуноглобулины и способны секретировать в межклеточную среду иммуноглобулины соответствующего подкласса [10]. Учитывая, что в измененных клетках ускоряются клеточные синтетические процессы, клеткам требуется больше энергии, возникает дисбаланс между энергообеспечением и метаболизмом клетки, что не исключает возможность развития окислительного стресса [1]. Антиоксидантная система поддерживает гомеостаз клеток в нормальных условиях [4].
В связи с этим, целью нашей работы было изучить закономерности изменения состояния прооксидантной и антиоксидантной систем в эритроцитах и в плазме крови у больных ММ в зависимости от стадии заболевания.
Материалы и методы исследования. Объектом исследования были 15 больных ММ, в возрасте от 44 до 72 лет (59,6±6,1), 7 мужчин и 8 женщин, поступившие в гематологическое отделение ККБ г. Красноярска в 2012 году. У 11 пациентов диагностировалась 2-я стадия заболевания, у 4 – 3-я. Контрольную группу составили 47 здоровых добровольцев, сопоставимых по полу и возрасту с основной группой. Материалом для исследования была венозная кровь из локтевой вены, которая забиралась утром натощак при поступлении больного в стационар до начала патогенетического лечения.
В качестве маркера прооксидантной системы изучалось содержание малонового диальдегида (МДА), продукта перекисного окисления липидов, в эритроцитах и плазме крови с использованием 2-тиобарбитуровой кислоты спектрофотометрическим методом [9].
Изучались активности антиоксидантных ферментов (супероксиддисмутазы, каталазы) спектрофотометрическим методом. Активность супероксиддисмутазы определялась методом ингибирования реакции аутоокисления адреналина в щелочной среде [6], каталазы - на образовании окрашенного в желтый цвет комплекса не разрушенной в ходе каталазной реакции перекиси водорода с молибдатом аммония.
В работе использованы статистические приемы подсчета медианы, 25 и 75 перцентиля с помощью пакета прикладных программ Statistica 7.0. Достоверность полученных данных оценивали с помощью непараметрического критерия Манна-Уитни с достоверностью р<0,01.
Результаты исследования. Содержание МДА и активность ферментов антиоксидантной системы имеют важное диагностическое значение для оценки уровня активных форм кислорода (АФК) в крови и перекисного окисления липидов. При самых различных заболеваниях наблюдается изменение их содержания.
МДА – соединение крайне реакционноспособное, содержащее две альдегидные группы, тем самым способное вступать в реакцию с различными соединениями, содержащими NН2-группы (белки, липиды и т.д.). МДА может модифицировать белки, в том числе ферменты антиоксидантной системы. Модификация ферментов, как правило, ведет к снижению их активности. Содержание МДА в эритроцитах больных ММ, а также у относительно здоровых людей представлено на рис. 1. Полученные результаты показывают достоверное различие в содержании МДА в эритроцитах здоровых людей и больных ММ 2-й стадией на 208%, между здоровыми людьми и больными ММ 3-й стадией на 254%. Достоверных различий в содержании МДА в эритроцитах между больными 2-й и 3-й стадиями не выявлено.
Повышенное содержание МДА в эритроцитах больных свидетельствует об избыточной продукции АФК эритроцитами, так как процессы перикисного окисления липидов (ПОЛ) запускаются взаимодействием АФК с полиненасыщенными жирными кислотами гидрофобной части мембран.
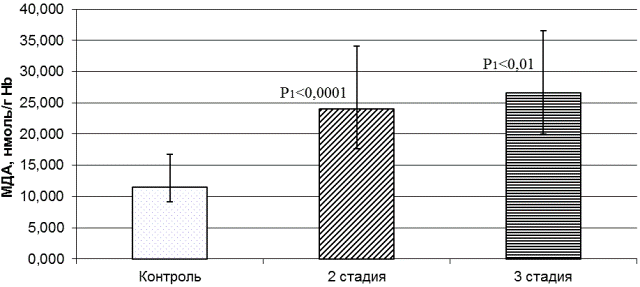
Рис. 1. Содержание малонового диальдегида в эритроцитах здоровых людей и больных миеломной болезнью на 2-й и 3-й стадиях
Для оценки антиоксидантного статуса в эритроцитах здоровых людей и больных ММ определяли активность цитозольной супероксиддисмутазы (СОД) и каталазы, представляющих фактически бифункциональную систему, работающую в тандеме: пероксид водорода, образующийся в реакции, катализируемой СОД, далее эффективно устраняется каталазой. В эритроцитах человека и СОД, и каталаза проявляют высокую каталитическую активность [5].
Активность СОД в эритроцитах у больных ММ 2-й и 3-й стадий достоверно снижена по сравнению с группой здоровых людей (рис. 2). У больных на 2-й стадии заболевания активность СОД снижена в клетках красной крови на 417%, а у больных на 3-й стадии – на 527 %.
СОД участвует в устранении первичной активной формы кислорода – супероксиданион–радикала, являющегося пусковым звеном каскада свободнорадикальных реакций. Исходя из вышесказанного, можно сделать предположение, что в эритроцитах больных высок уровень аутоокисления гемоглобина, основного источника в отличие от других клеток [5].
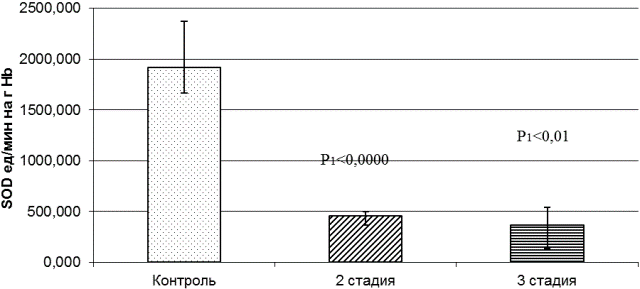
Рис. 2. Активность супероксиддисмутазы в эритроцитах здоровых людей и больных миеломной болезнью на 2-й и 3-й стадиях
В отличие от СОД активность каталазы в эритроцитах у больных ММ достоверно повышена, на 2-й стадии на 239% и на 3-й стадии – на 272%, по сравнению с группой здоровых людей (рис. 3).
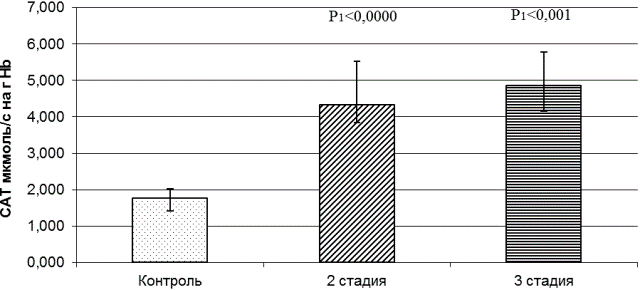
Рис. 3. Активность каталазы в эритроцитах здоровых людей и больных множественной миеломной болезнью на 2-й и 3-й стадиях
Нельзя исключить, что активность каталазы значительно повышена из-за того, что в эритроцитах больных ММ высока внутриклеточная концентрация пероксида водорода, а также возможен компенсаторный механизм за счет синтеза фермента на уровне ядерного предшественника эритроцитов. Избыток пероксида водорода, по-видимому, образуется в реакциях, идущих с участием флавиновых коферментов и оксидаз.
Таким образом, возможности антиоксидантной системы в эритроцитах не достаточны для устранения проявления окислительного стресса. Прооксидантные процессы преобладают в эритроцитах больных ММ над антиоксидантными.
Измерение содержания МДА в плазме крови здоровых людей и у больных ММ на 2-й и 3-й стадиях не выявило достоверных различий между этими тремя группами (рис. 4). Такая небольшая разница в концентрации МДА в плазме крови больных и здоровых людей может быть обусловлена эффективным функционированием неферментативного звена антиоксидантной системы, а именно витаминами А, Е и С.
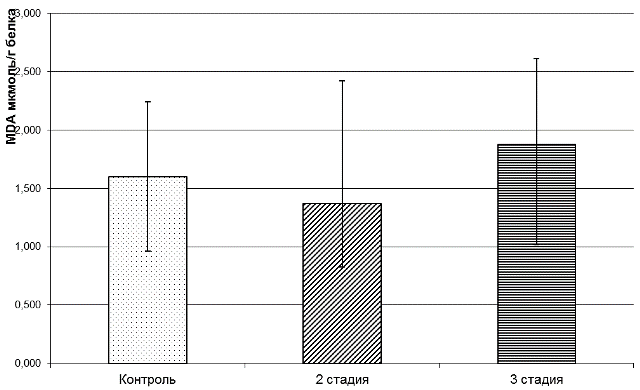
Рис. 4. Содержание МДА в плазме крови здоровых людей и больных ММ на 2-й и 3-й стадиях развития патологического процесса
В плазме крови содержится экстрацеллюлярная супероксиддисмутаза (СОД). Экстрацеллюлярная СОД является единственным энзиматическим антиоксидантом, который специфично нейтрализует супероксид-радикал во внеклеточном пространстве. У больных ММ на 2-й и 3-й стадиях активность СОД в плазме крови снижена по сравнению с аналогичным показателем в плазме крови контрольной группы в 10 раз (рис. 5). Различия в активности СОД между группами здоровых людей и больных ММ достоверны. Возможно, это связанно с высоким уровнем нитроксида, поскольку важнейшей функцией экстрацеллюлярной СОД является защита эндотелиоцитов от супероксиданион-радикала и нитроксида [2].
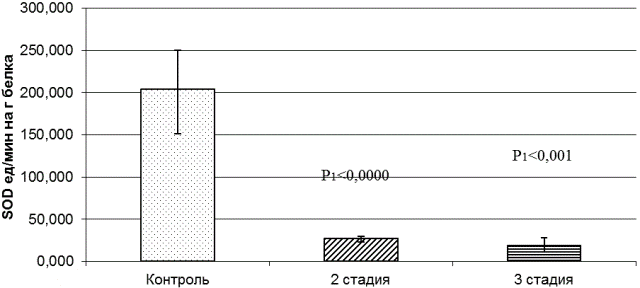
Рис. 5. Активность супероксиддисмутазы в плазме крови здоровых людей и больных ММ (2-я и 3-я стадии)
Активность каталазы в плазме крови различается между контрольной группой и группами больных ММ 2-й и 3-й стадиями достоверно (рис. 6).
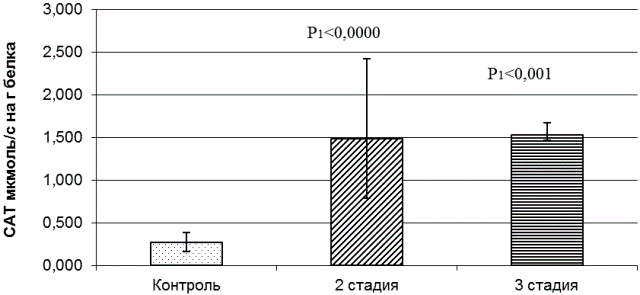
Рис. 6. Активность каталазы в плазме крови здоровых людей и больных ММ на 2-й и 3-й стадиях развития патологического процесса
У больных ММ на 2-й и 3-й стадиях активность фермента в плазме крови выше в 5 раз по сравнению со здоровыми людьми. Высокий уровень активности каталазы позволяет предположить, что и клетки, выстилающие кровеносные сосуды, подвергаются серьезному окислительному стрессу. Так как каталаза не имеет внеклеточной изоформы, в плазму крови она попадает вместе с клеточным содержимым в результате распада клеток и тканей. Для онкогематологических заболеваний характерен усиленный цитолиз.
Несмотря на снижение активности СОД, в плазме крови больных ММ не отмечено увеличение концентрации МДА. Можно предположить, что неферментативная антиоксидантная система эффективно поддерживает стационарный уровень МДА в плазме крови больных ММ. Необходимо отметить, что значительное повышение активности каталазы может свидетельствовать о высокой концентрации пероксида водорода в плазме крови. Этому может способствовать высокий уровень окислительного стресса у эндотелиоцитов, а также высокая функциональная активность нейтрофильных гранулоцитов [11].
Заключение. При ММ отмечается дисбаланс про- и антиоксидантной систем. В эритроцитах наблюдается усиление перекисного окисления липидов, что подтверждалось увеличением содержания МДА. В плазме крови вероятна эффективная работа неферментной антиоксидантной системы. В плазме крови и в эритроцитах снижена активность СОД и повышена активность каталазы. В эритроцитах интенсивность перекисных процессов превышает эффективность работы антиоксидантной системы.
