Введение. В настоящее время к биологическим эффектам монооксида азота (NO) приковано внимание научной общественности, что обусловлено их плейотропностью, а также значительной клинико-физиологической значимостью [1-4]. Интересно, что до сих пор продолжают открываться новые механизмы и мишени действия данного соединения на биологические системы [2-5]. К таковым, в частности, относится связь метаболизма оксида азота и ферментных систем детоксикации [4, 6, 7]. В этом плане важны данные, полученные в последнее десятилетие преимущественно зарубежными исследователями относительно процессов биоактивации и биотрансформации нитроглицерина и других органических нитратов [8-10]. Установлено, что непосредственное участие в высвобождении молекулы монооксида азота из последних принимает альдегиддегидрогеназа (АлДГ), прежде всего – ее 2 (митохондриальная) фракция [8, 11-13]. В то же время остается неизвестным характер влияния самого NO на каталитическую активность указанного фермента, поэтому целью исследования являлось изучение действия оксида азота в свободной и связанной форме на активность АлДГ.
Материал и методы исследования. Изучен характер реакции цельной консервированной крови на воздействие свободного и депонированного азота. Выполняли 2 серии экспериментов: в первой устанавливали характер действия на показатели энергетического обмена крови газообразного оксида азота, во второй – депонированного (в форме динитрозильных комплексов железа - ДНКЖ).
Для проведения эксперимента в первой из указанных серий кровь разделяли на 5 порции (интактную, на которую не оказывали воздействий, и 4 опытных, подвергшихся обработке). В первой серии производили прямой барботаж образцов крови (5 мл) газообразным оксидом азота, генерированным при стандартной мощности аппаратом «Плазон» (концентрация NO – 800 ppm), а также экспериментальным аппаратом (NO-генератор) для синтеза оксида азота, созданным в РФЯЦ (при концентрациях 20, 50 и 100 ppm). Экспозиция после воздействия составляла 3 минуты.
Во второй серии к трем опытным образцам крови добавляли 0,05; 0,1 и 0,2 мл свежеполученного водного раствора ДНКЖ соответственно (концентрация соединения, определенная спектрофотометрически по известным молекулярным экстинкциям при длинах волны 310 и 360 нм - 3 ммоль/л). Синтез ДНКЖ производили по методике А.Ф. Ванина с соавт. (2005) [14]. Экспозиция после введения соединения также составляла 3 минуты.
В донорской крови спектрофотометрически определяли активность альдегиддегидрогеназы (АлДГ) по методу Б.М. Кершенгольца, Е.В. Серкиной. Содержание белка устанавливали по модифицированному методу Лоури. Уровень малонового диальдегида (МДА) в эритроцитах определяли с помощью тест-набора (ЗАО «АГАТ»).
Результаты обрабатывали с использованием программы Statistica 6.0.
Результаты и обсуждение. Проведенные эксперименты позволили установить, что различные варианты обработки крови оказывают неодинаковое влияние на активность эритроцитарной АлДГ (рис. 1). В частности, введение в образцы биологической жидкости оксида азота в свободной газообразной форме приводит к умеренному угнетению каталитических свойств фермента (на 10-15% относительно уровня нативной крови; p<0,05 для всех случаев), причем эта тенденция не зависит от дозы воздействующего агента. Интересно, что данный эффект наблюдается вне зависимости и от особенностей генератора оксида азота.
Он отмечается как в случае использования аппарата «Плазон», создающего высокие концентрации NO в сочетании с активными формами кислорода [15, 16], так и при применении экспериментального генератора, образующего NO-содержащий воздушный поток без примесей с существенно более низкими (на 1-2 порядка) концентрациями изучаемого соединения.
По нашему мнению, это обусловлено неспецифическим ингибированием каталитических свойств энзима при насыщении биологической жидкости продуктом реакции – монооксидом азота. Наличие дозозависимости ответа, не прослеживаемое при оценке общей активности АлДГ, может быть выявлено при анализе кинетических характеристик фермента.
Эффекты, противоположные описанным выше, были обнаружены для депонированных форм оксида азота – динитрозильных комплексов железа, служащих естественными депо последнего (рис. 1). При воздействии на образцы крови человека растворов ДНКЖ при всех использованных концентрациях соединения наблюдали активацию АлДГ, однако степень выраженности этого влияния неодинакова (от 10 до 53% от уровня, характерного для интактного образца биологической жидкости) и нелинейно зависит от количества введенного источника оксида азота. Так, при введении 0,15-0,3 мкмоль ДНКЖ регистрировали дозозависимую стимуляцию каталитических свойств энзима, что, по нашему мнению, связано с необходимостью утилизации экзогенного субстрата. Можно предположить, что этому дополнительно способствует потенциальное сходство органических нитратов как основных субстратов фермента и экзогенных нитрозильных комплексов железа, деструкция которых в организме частично может также обеспечиваться функционированием АлДГ.
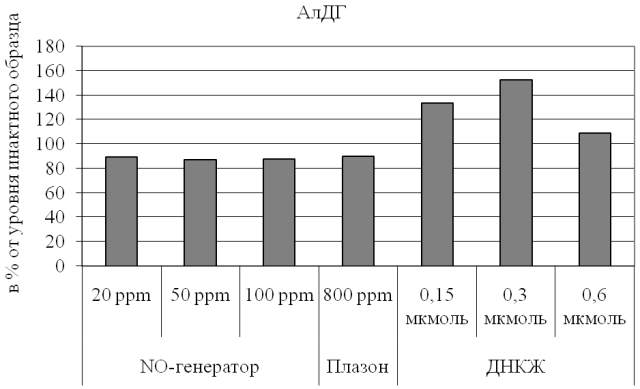
Рис. 1. Активность альдегиддегидрогенезы эритроцитов при действии свободного и депонированного оксида азота.
Особого обсуждения, на наш взгляд, заслуживает снижение активирующего влияния ДНКЖ на каталитическую активность АлДГ при дальнейшем увеличении количества вводимого источника оксида азота. Эта тенденция может объясняться суммацией двух зависимых процессов: выраженной «компенсаторной» стимуляцией функционирования энзима при поступлении значительного количества субстрата и, следовательно, быстрым накоплением продукта реакции (NO), ингибирующего активность АлДГ по механизму обратной связи аналогично сдвигам, наблюдающимся при обработке образцов крови газообразным оксидом азота.
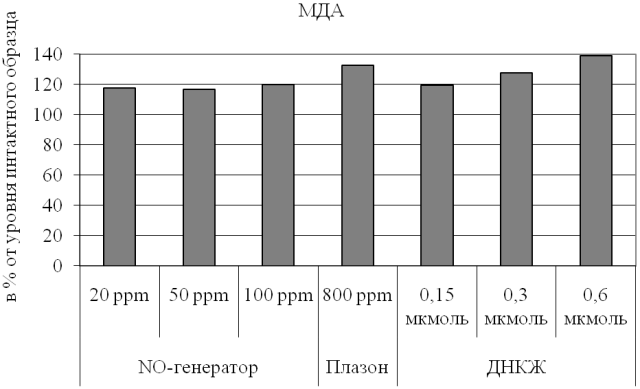
Рис. 2. Уровень малонового диальдегида в эритроцитах при различных вариантах обработки крови оксидом азота.
Также нами была произведена оценка уровня малонового диальдегида в эритроцитах и его динамики при изучаемых воздействиях (рис. 2). С наших позиций, данный метаболит, одновременно маркирующий интенсивность процессов липопероксидации и выраженность эндогенной интоксикации [17], служа одним из субстратов АлДГ, позволяет дополнить представления о метаболических сдвигах, возникающих при обработке крови оксидом азота в свободной и связанной форме. Установлено, что во всех случаях имеет место умеренное нарастание уровня МДА, причем наиболее существенной указанная тенденция оказалась при воздействии NO-содержащего потока из аппарата «Плазон», для которого нами ранее уже были показаны негативные эффекты [6, 7, 15], а также при введении максимальной дозы ДНКЖ (0,6 мкмоль). В этих экспериментах регистрировали повышение уровня МДА на 33 и 39% относительно значений, характерных для контрольного образца соответственно (p<0,05 для обоих случаев).
Использование низких концентраций газообразного оксида азота (20-100 ppm), что соответствует 0,06; 0,16 и 0,33 мкмоль соединения, минимально (до 20% от исходных значений) увеличивает концентрацию МДА в эритроцитах. При этом в рассматриваемом диапазоне дозозависимого эффекта не выявлено. По нашему мнению, это косвенно подтверждает преимущества подобного варианта прямой обработки оксидом азота перед использованием аппарата «Плазон».
Напротив, введение в образцы крови различных количеств ДНКЖ демонстрирует четкую дозозависимость эритроцитарного уровня МДА (рис. 2), причем действие максимальной из примененных дозы соединения (0,6 мкмоль) уже приводит к существенному нарастанию рассматриваемого показателя (до 40% относительно контрольных значений; p<0,01). Подобная динамика указывает на предпочтительность более низких доз ДНКЖ для биологической системы. По нашему мнению, этот негативный эффект может быть обусловлен одномоментным высвобождением большого объема оксида азота, что приводит к образованию пероксинитрита, в свою очередь вызывающего стимуляцию липопероксидации. Следует подчеркнуть, что эти данные полностью подтверждают тенденции, обнаруженные для АлДГ и свидетельствующие об избыточности введения в биологическую жидкость 0,6 мкмоль ДНКЖ.
Заключение. На основании полученных результатов можно заключить, что в условиях in vitro форма поступления оксида азота имеет принципиальное значение для определения характера ответа биологической жидкости (крови человека) на данное воздействие. Так, при действии свободного оксида азота на образцы изолированной крови регистрируется умеренное ингибирование каталитической активности АлДГ, тогда как при введении ДНКЖ – активация фермента вследствие потенциального сходства «традиционных» субстратов (органических нитратов) и нитрозильных комплексов. Наиболее метаболически благоприятный «ответ» крови на обработку оксидом азота регистрировали при использовании низких доз ДНКЖ (0,3 мкммоль и менее), тогда как большие количества соединения способствовали перенасыщению биосистемы NO.
Таким образом, кровь человека чрезвычайно чувствительна к введению NO, что проявляется в возможностях регуляции оксидом азота ее детоксикационных механизмов.
