Введение. Полинейропатия представляет собой множественное поражение периферических нервов. По этиологии выделяются семь основных групп полинейропатий, одной из которых являются полинейропатии при злокачественных новообразованиях или паранеопластические полинейропатии [1,5,7]. Частой причиной паранеопластических полинейропатий являются парапротеинемические гемобластозы (ПГ) [17,18]. Периферические нейропатии (ПН), возникающие при ПГ, в ряде случаев значительно ухудшают течение и прогноз заболевания [3,8,9]. Развитие ПН при ПГ связаны в первую очередь с присутствием в крови высокого уровня патологических иммуноглобулинов (Ig), которые имеют свойства антител и оказывают непосредственное воздействие на нервные клетки [4]. Однако, важно отметить, что ПН у больных с ПГ может выступать не только как сопутствующий и патогенетически обусловленный синдром, но и развиваться в ответ на введение цитостатиков [4,10,14]. В данном случае можно говорить о лекарственной полинейропатии. Среди препаратов, используемых при лечении ПГ основными являются: мелфалан, циклофосфамид, дексаметазон, винкристин, доксорубицин, бортезомиб, талидомид, леналидомид и др.[10] Практически все они потенциально могут вызывать лекарственные нейропатии [4,10,11].
Цель. Изучить клинические особенности ПН у пациентов с ПГ на основании чего сформулировать основные подходы к диагностике, профилактике и лечению ПН у данной категории пациентов.
Материалы и методы. В процессе клинического наблюдения было обследовано 104 пациента с парапротеинемическими гемобластозами в возрасте от 24 до 79 лет, медиана возраста составила 62 года. Обследовано 72 женщины (69,2%) и 32 мужчины (30,8%), при этом наибольшее количество больных составили женщины в возрасте старше 60 лет (39,4%). Распределение пациентов по полу и возрасту представлено на рис. 1.
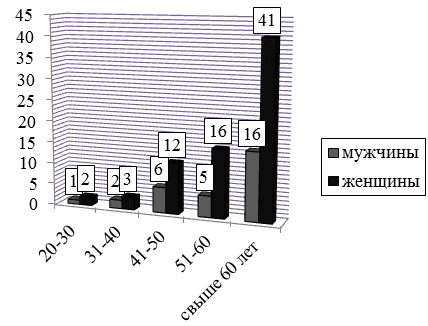
Рис. 1. Распределение пациентов по полу и возрасту.
Из 104-х обследованных наибольшую долю составили пациенты с множественной миеломой (ММ) пациентов 97 (93,3%), 4 (3,8%) с солитарной плазмоцитомой и 3 (2,9%) с макроглобулинемией Вальденстрема. Согласно системе стадирования множественной миеломы, предложенной в 1975 г. B. Durie и S. Salmon 70% больных с ММ были отнесены к IIIА стадии заболевания, 19% к IIIB стадии, 7% ко IIA стадии и 4% к IA стадии (данные представлены на рис. 2 и 3) [17]. Медиана срока от верификации диагноза до включения пациента в наблюдение составила 11 месяцев (от 1 мес. до 43 мес.).
Комплексное обследование пациентов с ПГ включало: неврологический осмотр, исследование вибрационной чувствительности камертоном градуированным (C128 Гц) по Риделю-Сейфферу, электронейромиографию (ЭНМГ), биопсию n.suralis (в 2-х случаях), оценку по шкалам. При оценке выраженности ПН использовались шкала NDS (Neuropathy Disability Score), шкала нейропатического симптоматического счета (ШНСС), шкала симптомов невропатии в нижних конечностях (NIS-LL: Neuropathy impairtment scale – lower limbs), визуальная аналоговая шкала (ВАШ), болевая шкала LANSS (Leeds assessment of neuropathic symptom sandsigns)[12], вопросник Pain Detecт[16]. Нейротоксичность химиотерапии (ХТ) оценивалась согласно критериям Common terminology criteria for adverse events (CTCAE) версия 4.0.
Результаты. Среди всех обследованных с различными вариантами ПГ до начала лечения признаки ПН были выявлены у 16 пациентов (15,3%): у 9 пациентов с ММ, у 4-х пациентов с диагнозом СП, у 3-х с МВ. Таким образом, среди пациентов с ПГ у которых до ХТ была выявлена ПН преобладали пациенты с ММ III B стадии – всего 7 человек (44%), ПН у пациентов с ММ III A стадии была выявлена в 2-х случаях (12%), у пациентов с солитарной плазмоцитомой в 4-х случаях (25%) и с МВ в 3-х случаях (19%).
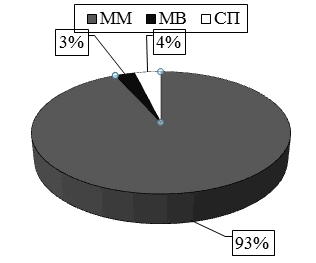
Рис. 2. Распределение пациентов по варианту гемобластоза.
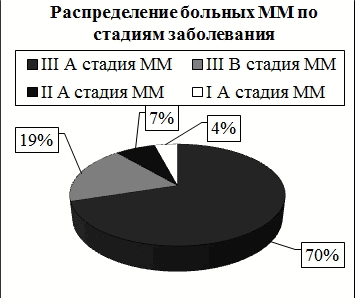
Рис. 3. Распределение пациентов ММ по стадиям (Durie и S.Salmon).
ПН у этих пациентов была расценена как вариант парапротеин-ассоциированной полинейропатии (ПАП), на что указывало выявление повышенных Ig в сыворотке крови, признаки моторно-сенсорной нейропатии при ЭНМГ, выявление в оболочках n. suralis отложения белковых масс, а также отсутствие данных за сопутствующую патологию, способную вызвать ПН и указаний на проведение ранее ХТ. Средний балл у пациентов этой группы по шкале NDS составил 16 баллов. У 6 пациентов были выявлены признаки нейропатической боли, в том числе с проявлениями аллодинии. Средние баллы по ВАШ и ШНСС составили 6,5 и 14 соответственно. При проведении стимуляционных проб фиксировалось снижение скорости проведения по чувствительным нервам на руках и ногах, значительное снижение скорости проведения невральных ответов на ногах. При стимуляции двигательных нервов на ногах фиксировалось снижение скорости проведения, значительное снижение амплитуды М-ответов; на руках скорость проведения в большинстве случаев была в пределах нормы, но амплитуды М-ответов также были снижены. Данные изменения свидетельствовали о диффузном поражении периферических нервов в большей степени на ногах в виде аксонально-демиелинизирующей моторно-сенсорной нейропатии.
Согласно оценке по NIS-LL в 43,5% случаев пациенты имели снижение мышечной силы в нижних конечностях, у 62,5% пациентов было выявлено снижение коленного и ахиллового рефлексов, у 37,5% пациентов выпадение глубоких рефлексов нижних конечностей. Стоит отметить, что в 4-х случаях ПАП (все пациенты с солитарной плазмоцитомой) при дополнительном обследовании было выявлено наличие POEMS-синдрома (англоязычная аббревиатура, обозначающая редкий вариант паранеопластического синдрома, в названии которого звучат первые буквы английских слов, указывающих на основные клинические симптомы: P – полинейропатия, O – органомегалия, E – эндокринопатия, M – моноклональный протеин, S – кожные изменения) [6,8,18]. При этом ПН выступала на ранних стадиях заболевания основным и зачастую первым клиническим проявлением POEMS-синдрома, имея дистальный сенсо-моторный характер с преобладанием и постепенным прогрессированием моторных нарушений. Основными жалобами пациентов на ранних стадиях манифестации симптоматики были онемение, покалывание, жжение, чувство дискомфорта, зябкости в конечностях. Боли носили нейропатический характер, а средний показатель по вопроснику Pain Detect соответствовал 25 баллам (что указывает на вероятность нейропатического компонента боли >90%). Позже развивалась слабость в дистальных отделах конечностей, преимущественно в стопах, при ходьбе появлялся степпаж, отмечалось симметричное ослабление сухожильных рефлексов, нарушение чувствительности, развитие мышечных атрофий. При исследовании вибрационной чувствительности в стандартных точках – лучевая кость, медиальная лодыжка, большой палец стопы у всех пациентов с ПАП было зафиксировано грубое снижение вибрационного чувства от 4 до 0 Ед.
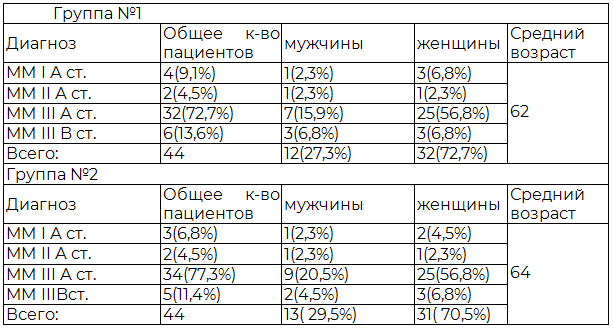
Пациенты, у которых до начала ХТ не было выявлено ПН были разделены на две (см. табл. 1) практически однородные по возрастному и половому составу группы, сопоставимые также по клиническим проявлениям и тяжести основного заболевания.
Таблица 1. Сравнительная характеристика пациентов первой и второй групп
Пациенты первой группы получали ХТ с применением протеосомного ингибитора бортезомиб. Лечение проводилось по схеме “VD” - трехнедельный цикл с в/в введением бортезомиба в 1, 4, 8 и 11 дни цикла в дозе 1,3мг/м2, всего 8 последовательных циклов с перерывом между циклами 10 дней в комбинации с дексаметазоном перорально в дозе 40 мг на 1, 2, 4, 5, 8, 9, 11 и 12-й дни терапии.
Коррекция ХТ проводилась при появлении признаков нейротоксичности соответствующих II-III ст. тяжести ПН, при IV ст. ХТ прерывалась до регресса неврологической симптоматики. При ПН II ст. доза бортезомиба снижалась до 1 мг/м2. При II ст. с болью или III ст. ХТ прерывалась до исчезновения симптомов нейротоксичности, после чего возобновлялась со снижением дозы до 0,7 мг/м2 и/или уменьшением частоты введения до 1 раза в неделю. При I ст. ПН редукция дозы бортезомиба не проводилась, однако пациентам назначалась корректирующая сопроводительная терапия по схеме: мильгамма 2,0 в/м №10, затем в драже 1x2 раза в день до 1 мес.; тиоктовая кислота 600 мг в/в №10, затем per os 600 мг ежедневно 2-3 мес.; при выявлении симптомов нейропатической боли к терапии добавлялся прегабалин в дозе от 75 мг/сут до 600 мг/сут.
В 1-ой группе ПН была выявлена в 26 случаях (59,0%): у 20 (76,9%) I-II ст. и у 6 (23,1%) III ст. Преобладали сенсорные нарушения, реже мышечная слабость и атрофия – в 16 случаях (61,5%), нейропатическая боль – в 11 случаях (42,3%). Средний балл по NDS составил 9 баллов. Вибрационная чувствительность была снижена умеренно, в среднем соответствуя 6-8 Ед с лучевой кости и 2-4 Ед с большого пальца стопы. Максимальной частоты ПН у пациентов 1-ой группы достигала к 5-ому циклу ХТ (54,5%), на фоне коррекции полного регресса явлений ПН удалось достигнуть у 6 пациентов (23,1%).
Во 2-ой группе пациенты получали ХТ по той же схеме. Пациенты с ММ III B стадии были отнесены к группе риска развития бортезомиб-индуцированной нейропатии (БИН) в связи с нарушением функции почек и повышением уровня креатинина в сыворотке >177мкмоль/л на этой стадии заболевания [15]. С целью предупреждения развития ПН пациентам 2-ой группы с ММ III B стадии профилактически назначались витамины группы В (мильгамма) и тиоктовая кислота, а также комплекс лечебной физкультуры (ЛФК): упражнения для верхних и нижних конечностей, эрготерапевтические комплексы, тренировку координации движений на стабилотренажерах систем “КОБС” и “ST-150”. Выбор тренировок на стабилометрических системах с биологической обратной связью был сделан в связи с наличием у пациентов с выявляемой ПН, признаков различной степени выраженности (от легкой до грубой) сенсорной атаксии. Занятия на стабилосистемах проводились в режиме ежедневной тренировки по 30 минут, всего от 15 до 20 процедур. На рис. 5 представлен вариант стабилометрической тренировки на системе “КОБС” пациентки с ММ.
При появлении признаков ПН к терапии в добавлялись перечисленные комплексы лечебной физкультуры, медикаментозная коррекция (тиоктовая кислота, витамины группы В, фолиевая кислота, милдронат, нейромидин), а также водолечение: вихревые ванны для верхних и нижних конечностей по 10 процедур через день. По согласованию с гематологом в 4-х случаях режим введения бортезомиба был изменен с в/в на подкожное с целью уменьшения нейротоксичности [2]. ПН во второй группе была выявлена в 15 случаях (34,09%): у 13 (86,6%) I-II степень и у 2-х (13,4%) III степень. Средний балл по NDS во второй группе составил 13 баллов, что свидетельствовало об умеренной степени полинейропатии.
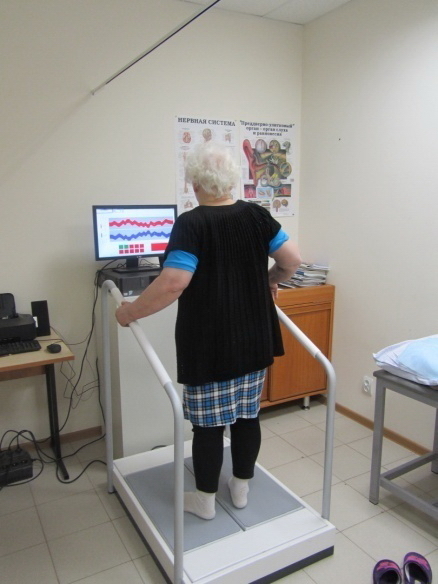
Рис. 4. Тренировка на стабилосистеме “КОБС”.
Вибрационная чувствительность была снижена в данной группе не грубо, в среднем соответствуя при измерении градуированным камертоном 6-8 Ед с лучевой кости и 4-6 Ед с большого пальца стопы.
Преобладали сенсорные нарушения, мышечная слабость и атрофия присутствовали – в 6 случаях (40,0%), нейропатическая боль – в 4 случаях (26,6%). Максимальной частоты ПН во 2-ой группе достигала к 4-ому циклу ХТ (34,09%), на фоне коррекции полного регресса ее явлений удалось достигнуть у 10 пациентов (76,9%).
Выводы. На основании проведенного клинического наблюдения 104-х пациентов с диагнозом ПГ можно выделить две основные группы ПН, осложняющие течение основного заболевания у данной категории пациентов, а именно – ПАП, связанные непосредственно с опухолевым процессом и парапротеинемией, и лекарственные, обусловленные побочным нейротоксическим эффектом противоопухолевых препаратов. Частота ПАП составила 15,4%. ПАП развивается по аксонально-демиелинизирующему типу, носит дистальный симметричный сенсо-моторный характер с преобладанием на ранних стадиях развития сенсорного, а на поздних моторного компонента, сопровождается грубыми изменениями глубокой чувствительности, частой нейропатической болью (37,5%) и стойкостью своих проявлений. Как правило, ПАП возникает в дебюте заболевания и/или выступает в качестве ведущего клинического проявления, полностью отражая тяжесть системных проявлений заболевания. Общая частота развития БИН в данном клиническом наблюдении среди 88 пациентов составила 46,6%. БИН развивалась по аксонально-демиелинизирующему типу, носила дистальный симметричный сенсо-моторный характер, с очевидным преобладанием сенсорного компонента нейропатии, сопровождалась умеренным снижением глубокой чувствительности, гораздо реже проявляясь нейропатическим болевым синдромом (21,6%). БИН была дозозависимой (кумулятивная доза бортезомиба составила 35,6 мг/м2), зависела также от продолжительности ХТ, способа введения препарата, а своей максимальной частоты достигала к 5-6 курсам ХТ. БИН была обратима (полный регресс ПН зафиксирован в 39,0% случаев). Комплексный подход в диагностике позволяет максимально объективно, своевременно и достоверно судить о проявлениях и тяжести ПН. К обязательным методам диагностики ПН у пациентов с ПГ стоит отнести: неврологический осмотр, ЭНМГ, исследование вибрационной чувствительности, оценку по шкалам и опросникам, которые следует проводить на этапе верификации основного диагноза, до проведения ХТ и после каждого ее курса. Высокой информативностью при выявлении и оценке нейропатической боли обладает вопросник Pain Detect. В сомнительных и сложных для клинической интерпретации и определения этиопатогенеза ПН случаях следует выполнять биопсию икроножного нерва. Информативность и объективность клинических данных повышается за счет проведения пациентам динамического стабилометрического тестирования, позволяющего судить, прежде всего, о выраженности сенситивной атаксии и степени нарушений повседневной жизненной активности. Профилактическое назначение пациентам с нарушением функции почек витаминотерапии, метаболической терапии, комплексов ЛФК позволяет снизить частоту развития БИН (в нашем наблюдении в 2,26 раза). Использование в качестве сопроводительной терапии комплексов ЛФК, эрготерапии, стабилометрической тренировки с использованием биологической обратной связи, водолечения в виде вихревых ванн для верхних и нижних конечностей, лекарственной терапии (витамины группы B, тиоктовая кислота, фолиевая кислота, милдронат, нейромидин, прегабалин) демонстрирует высокую эффективность при коррекции явлений БИН у пациентов с ПГ. Среди пациентов, получавших профилактическое лечение и полный комплекс немедикаментозных методов коррекции ПН, общая частота развития БИН составила 34%, т.е. БИН развивалась в 1,7 раз реже по сравнению с группой, где профилактическое лечение не использовалось и частота БИН составила 54,0%.
Таким образом, профилактика и лечение БИН требуют комплексного мультидисциплинарного подхода: совместного динамического наблюдения пациента гематологом и неврологом, расширенной ранней диагностики, своевременной в соответствии с рекомендациями коррекции дозы (а в некоторых случаях и способа введения) бортезомиба, профилактического и прямого лечебного назначения лекарственной терапии (нейропротективной, метаболической, антиоксидантной, витаминотерапии), а также применения методов немедикаментозной коррекции (ЛФК, в том числе с использованием современных компьютерных технологий и БОС, эрготерапия, упражнения на развитие мелкой моторики, активная, пассивная, активно-пассивная лечебная гимнастика, вихревые ванны для верхних и нижних конечностей) не имеющих каких-либо специфических противопоказаний в отношении онкогематологических заболеваний.
