Введение. В настоящее время убедительно показано, что монооксид азота (NO) – один из основных мессенджеров межклеточной сигнализации – способен оказывать многочисленные биологические эффекты [1-4]. Однако до сих пор существует определенный «разрыв» между данными о клинической значимости изменений уровня рассматриваемого метаболита в биосредах и результатами модельных экспериментов по оценке его физико-химических свойств. Это связано с малочисленностью исследований, посвященных действию NO на организм здоровых и имеющих различную патологию животных [5-8], а также биосистемы, в том числе культуры клеток, изолированные биологические жидкости и др. [9-11].
С учетом того, что влияние оксида азота на биообъекты носит ярко выраженный дозозависимый характер [5, 11, 12], а также определяется формой доставки соединения в биосистему (в свободном или депонированном виде [11, 13]), роль данных факторов должны быть уточнена при изучении его биологических эффектов.
В предшествующих работах нами продемонстрировано, что высокие дозы оксида азота оказывают существенное специфическое влияние на такой интегральный физико-химический параметр сыворотки крови, как ее кристаллогенные свойства [14]. В то же время действие других доз и форм NO на последние не изучено. Но основании ранее полученных результатов можно предположить, что формирование особой «полосы» в краевой зоне микропрепарата высушенной биологической жидкости, образование которой потенциально обусловлено нитрозилированными белками плазмы крови, не будет происходить в случае применения более низких доз оксида азота или введения NO в депонированном виде, в частности, в форме динитрозильных комплексов железеа (ДНКЖ). В связи с этим целью данной работы явился сравнительный анализ влияния различных форм NO на характер дегидратационной структуризации образцов сыворотки крови человека.
Материал и методы исследования. Изучен характер реакции цельной консервированной крови на воздействие свободного и депонированного азота. Для проведения эксперимента кровь разделяли на 6 порций (интактную, на которую не оказывали воздействий, и 5 опытных, подвергшихся обработке). Производили прямой барботаж четырех опытных образцов крови (5 мл) газообразным оксидом азота, генерированным при стандартной мощности аппаратом «Плазон» (концентрация NO – 800 ppm) и десятикратно разведенным потоком от данного прибора (80 ppm), а также экспериментальным аппаратом (NO-генератор) для синтеза оксида азота, созданным в РФЯЦ (при концентрациях 20 и 75 ppm). Время барботирования - 3 мин., экспозиция после воздействия – 5 мин. В пятый образец крови добавляли 0,1 мл. свежеполученного водного раствора ДНКЖ (концентрация соединения, определенная спектрофотометрически по известным экстинкциям при длинах волны 310 и 360 нм, - 3 ммоль/л). Синтез ДНКЖ производили по методике А.Ф. Ванина с соавт. (2005) [11]. Экспозиция после введения соединения также составляла 5 мин.
По завершении экспозиции производили центрифугирование всех образцов при 1500 об/мин в течение 15 мин.
Полученную сыворотку крови в объеме 100 мкл. наносили на предметное стекло в соответствии с методом тезиокристаллоскопии [14, 15]. В качестве базисного вещества использовали 0,9% раствор хлорида натрия. Высушенные микропрепараты оценивали морфологически и визуаметрически с применением собственной системы параметров [14].
Результаты обрабатывали с использованием программы Statistica 6.0.
Результаты и обсуждение. Морфологическое описание особенностей структуризации сыворотки крови позволило установить, что обработка крови высокими дозами NO (800 ppm) приводит к образованию в краевой зоне микропрепарата рельефной полосы, отчетливо выступающей над поверхностью образца. Данная полоса обнаруживается как при собственной кристаллизации биожидкости, так и при сокристаллизации последней с изотоническим базисным веществом – 0,9% раствором хлорида натрия. Происхождение данной полосы рассматривается нами на основании общих представлений о физико-химической природе процессов, происходящих в высыхающей капле [16, 17]. Согласно сформировавшемуся в литературе мнению краевая зона является местом сосредоточения белковых макромолекул, входящих в состав дегидратируемой биосреды [18, 19]. В условиях обработки цельной крови NO в газовой фазе, учитывая его концентрацию (800 мкг/л), может происходить нитроксилирование белков [14].
При проведении сравнительного анализа кристаллогенных свойств сыворотки крови при действии различных форм оксида азота был установлен дозозависимый характер их модификации (рис. 1, 2).
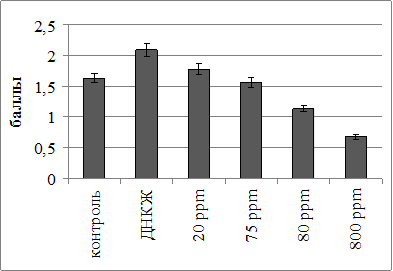
Рис. 1. Уровень кристаллизуемости образцов сыворотки крови при обработке различными формами оксида азота.
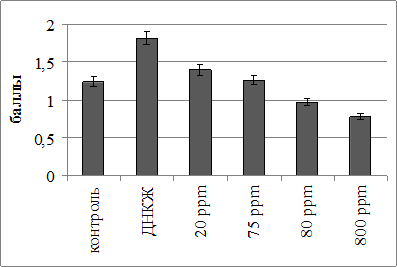
Рис. 2. Индекс структурности кристаллоскопических фаций сыворотки крови при обработке различными формами оксида азота.
Так, при обработке образцов биологической жидкости газовым потоком от аппарата «Плазон» имеет место отчетливое ингибирование собственной кристаллизации биосреды, что проявляется в значимом снижении как кристаллизуемости, так индекса структурности кристаллограмм (p<0,05 для обоих случаев; рис. 1, 2). Это косвенно подтверждает ранее показанные нами негативные эффекты данного газового потока [9, 10]. Десятикратное разведение последнего воздухом снижает выраженность указанного эффекта, однако оба показателя не достигают уровня контрольного образца (p<0,05). Напротив, что при воздействии газового потока от другого генератора, содержащего аналогичное количество оксида азота (75 против 80 ppm) без примеси активных форм кислорода, прежде всего – озона, результат кристаллизации практически не отличается от фаций интактной биологической жидкости. Это позволяет предположить, что ингибирование структуризации, наблюдаемое при обработке крови потоком от «Плазона», определяется не только концентрацией NO, но и образованием пероксинитрита, оказывающего негативное влияние на конформацию и структуру макромолекул плазмы крови.
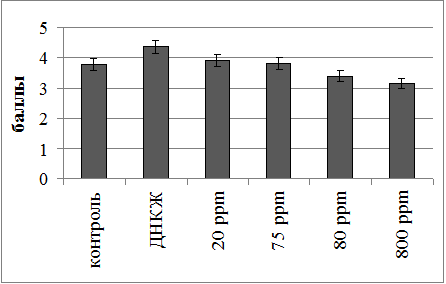
Рис. 3. Тезиграфический индекс дегидратированных образцов сыворотки крови при обработке различными формами оксида азота (базисное вещество – 0,9% раствор хлорида натрия).
С учетом приведенных выше данных интересным представляется стимулирующее действие низких концентраций оксида азота (20 ppm) без примесей активных форм кислорода на кристаллизацию сыворотки крови, что четко просматривается как морфологически, так на основании оценки трических параметров, в частности – кристаллизуемости и индекса структурности (рис. 1, 2). В большей степени усиливает кристаллогенную активность биосреды введение водного раствора ДНКЖ. По-видимому, подобный эффект обусловлен присутствием в составе комплекса атомов железа, высвобождаемых при частичном его разрушении, имеющем место при попадании в образцы крови [5, 11]. Этот тезис косвенно подтверждается тем, что сульфат железа (II) применяется многими исследователями в качестве базисного соединения для выполнения тезиграфического теста именно вследствие его способности к комплексообразованию [17, 20].
Тенденции, аналогичные выявленным в отношении кристаллоскопического исследования, обнаружены и для тезиграфии (рис. 3). Так, инициаторный потенциал сыворотки крови наиболее низок при ее обработке исходным потоком от аппарата «Плазон», демонстрируя в этом случае лишь минимальный активирующий эффект, существенно меньший, чем для контрольного образца биожидкости. Использование разведенного газового потока умеренно повышает инициаторный потенциал биосреды, но он не достигает контрольных значений. При этом обработка крови потоком от экспериментального генератора с аналогичной концентрацией NO сохраняет оцениваемый параметр на уровне интактного образца, а применение минимальной дозы оксида азота повышает инициирующие свойства сыворотки крови (p<0,05 по сравнению с контрольной фацией). В то же время введение в биологическую жидкость ДНКЖ, как и в отношении собственной кристаллизации способствует приросту инициаторного потенциала биосреды, в том числе – по тезиграфическому индексу.
Вывод. Таким образом, результаты проведенных экспериментов позволили установить, что результат влияния монооксида азота на кристаллогенные и инициирующие свойства сыворотки крови непосредственно определяется концентрацией NO и его формой (свободной или депонированной), а также наличием примесей активных форм кислорода.
