Введение. В настоящее время существует множество препаратов для замещения костных дефектов челюстей. В большинстве своем они представляют лиофилизированный бычий коллаген с гидроксиапатитом. Эти препараты показывают высокую пластическую функцию, значительно ускоряют регенерацию костной ткани, обладают свойствами остеоиндукции. Могут применяться для комплексного восстановления костно-хрящевых дефектов с сохранением гистотопографии [1].
Но, несмотря на то, что он проходит очистку и стерилизацию, иногда наблюдается риск развития аллергических реакций. Поэтому, оптимальным вариантом, не вызывающим аллергических реакций со стороны организма, является использование аутотрансплантата – препарата, полученного из тканей самого пациента. Таким препаратом может являться участок кости из донорской области, костная стружка, полученная при формировании ложа имплантата или препараты плазмы крови. Среди данных препаратов можно выделить следующие типы:
- FRP (fibrin-rich plasma) - это фракция плазмы крови человека, которая может быть получена после проведения центрифугирования и характеризуется высоким содержанием фибрина, желеобразной консистенцией, светло-желтого цвета.
- PRP (platelet-rich plasma) – это фракция плазмы крови человека, которая может быть получена после проведения центрифугирования и характеризуется высоким содержанием тромбоцитов, вязкой жидкой консистенцией, тёмно-вишнёвого цвета [3].
Полученные фракции собственной крови человека, из-за отличия в физико-механических и гистологических свойствах, будут применяться для разных целей. Так, богатая фибрином плазма (FRP) наиболее удобна при формировании мембраны для закрытия костного окна. Ввиду наличия в ней большего количества фибрина и, следовательно, большей эластичности, богатая фибрином плазма также может быть использована для моделирования гребня альвеолярного отростка. В отличие от богатой фибрином плазмы (FRP), которая обладает хорошими структурно-пластическими свойствами, богатая тромбоцитами плазма (PRP) имеет регенеративные свойства ввиду наличия в ней следующих факторов роста [3]:
- инсулиноподобный фактор роста 1 IGF1,
- тромбоцитный фактор роста PDGF,
- трансформирующий фактор роста бета TGF-b.
Этим обеспечивается высокая остеоиндуктивность фракции плазмы богатой тромбоцитами. Помимо этого, в сравнении с заполнением дефекта нецентрифугированной собственной кровью пациента, PRP ускоряет регенерацию в 2-3 раза с помощью собственных резервов организма [2].
Материал и методы исследования. Нами исследовалось применение богатой фибрином плазмы при операции открытого синус-лифтинга, а также замещения дефекта костной ткани после проведения цистоэктомии (с резекцией верхушки корня и без) на 30 пациентах с адентией верхней челюсти. При проведении операции открытого синус-лифтинга применялась как комбинированная методика – заполнение дефекта лиофилизированным коллагеном с гидроксиапатитом и формирование боковой стенки верхнечелюстного синуса при помощи FRP, так и заполнение дефекта полностью материалами плазмы крови пациента. Стандартно, операция синус-лифтинга проводилась следующим образом: после произведения разреза и отслаивания слизисто-надкостничного лоскута на передней стенке верхнечелюстного синуса борами и полусферическими фрезами формируется костное окно, отслаивается слизистая оболочка, выстилающая верхнечелюстной синус в области предполагаемой установки дентальных имплантатов. Далее закладывается костный материал, лоскут укладывается на место и фиксируется узловатыми швами. Мы получали богатую тромбоцитами и фибрином плазму при помощи центрифугирования собственной венозной крови пациента. Это гарантирует полную биосовместимость, а также снижает риск осложнений. Помимо этого, область применения FRP шире, чем синтетических остеопластических материалов – отжатый на тампоне сгусток FRP может быть использован как мембрана, а фракция PRP – как филлер для дефекта.
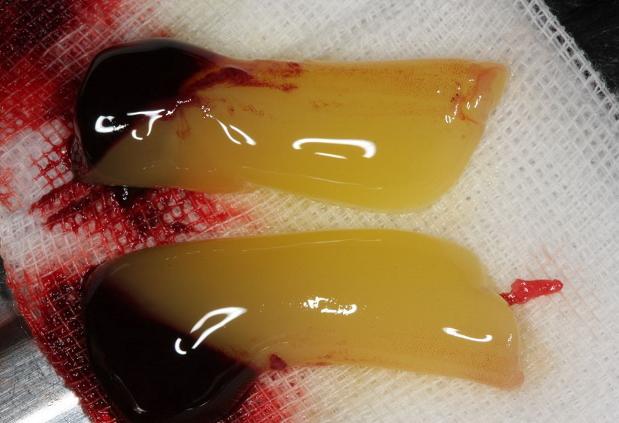
Рис. 1. Полученный препарат плазмы крови человека.
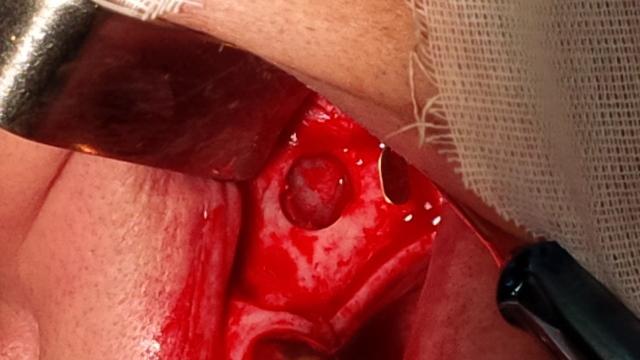
Рис. 2. Сформированное костное окно, 1 этап операции синус-лифтинг.
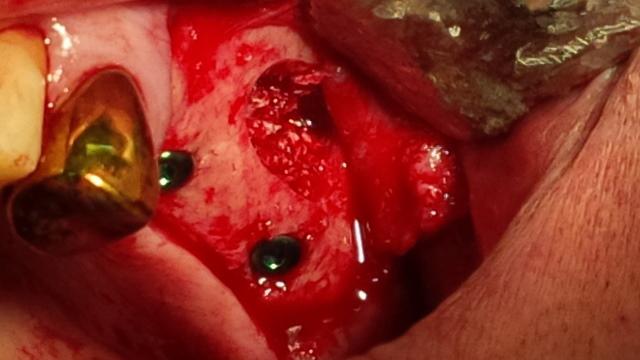
Рис. 3. Упакованный остеопластический материал под мембраной Шнайдера.
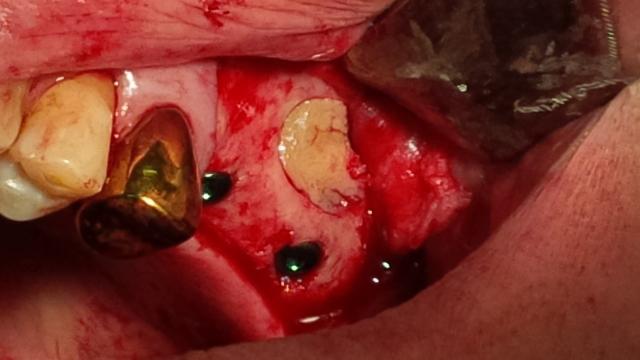
Рис. 4. Обтурация костного окна с помощью богатой фибрином плазмы.
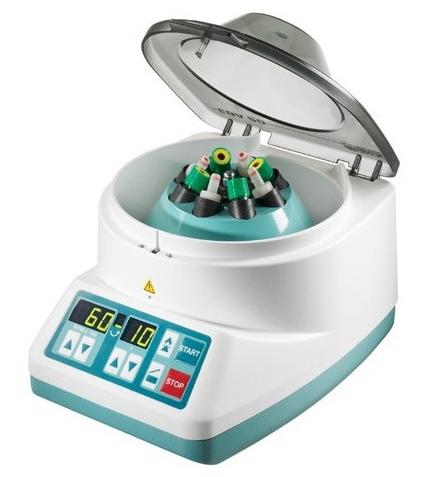
Рис. 5. Центрифуга ЕВА-20, используемая для получения богатой фибрином и тромбоцитами плазмы.
Таблица 1. Количество пациентов в зависимости от применяемого препарата и возраста
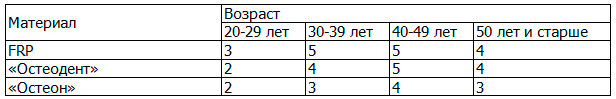
Исследования проводились в трех группах пациентов. Первая и вторая - контрольные, где применялись препарат «Остеон» и «Остеодент» соответственно. Третья – основная, где применялась методика с использованием FRP. А также во всех трех группах применялась богатая тромбоцитами плазма (PRP), которая смешивалась с основным материалом, так как она не может являться пластическим материалом ввиду физико-механических свойств, имея более жидкую консистенцию, но может служить матриксом для образования костной ткани.
Таблица 2. Концентрации тромбоцитов в сгустке FRP и в БоТП (PRP)
![]()
Исходя из данных табл. 2, количество тромбоцитов в богатой тромбоцитами плазме (PRP) значительно больше, чем в богатой фибрином (FRP). Это определяет более высокую регенеративную активность PRP и способность стимулировать рост костной ткани.
Плотность костной ткани в области дефекта и симметричного участка измеряли на первом, третьем и шестом месяце послеоперационного периода. Для этого применяли денситометрию [4].
Результаты исследований. В третьей группе у восьми из десяти пациентов наблюдалась плотность (по Хаунсфилду) более 1500 спустя пол года после операциии, в то время как в первой группе и второй количество таких пациентов составляло 1 и 3 соответственно. В то же время, на начальных этапах формирования костной ткани, пациенты 1 и 2 групп имели большую плотность (1300 и более), за счет физико-механических свойств остеопластического материала. Такая динамика в изменении плотности костной ткани по Хаунсфилду в области замещаемого дефекта говорит о том, что аллопластические материалы подвергаются резорбции после 2-3 мес. (табл. 3, 4, 5).
Таблица 3. Зависимость плотности образованной вновь костной ткани в области дефекта от времени, прошедшего после операции в первой группе («Остеон»)
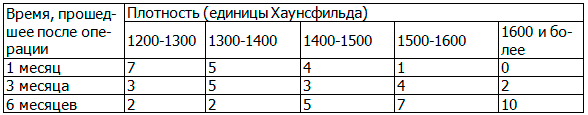
Табл. 3 наглядно иллюстрирует то, что плотные гранулы препарата «Остеон» подвергаются резорбции в течение длительного срока, а затем замещаются вновь образованной аутокостью.
Таблица 4. Зависимость плотности образованной вновь костной ткани в области дефекта от времени, прошедшего после операции во второй группе («Остеодент»)
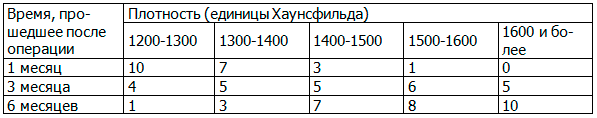
При применении препарата «Остеодента» резорбция происходит раньше, но зачастую собственные регенеративные механизмы (в частности у пациентов старше 45 лет) задействуются позже. В ходе данного исследования на окончательный результат плотности костной ткани это не повлияло.
Таблица 5. Зависимость плотности образованной вновь костной ткани в области дефекта от времени, прошедшего после операции в третьей группе (плазма крови)
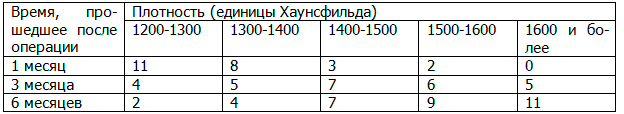
Табл. 5 иллюстрирует динамику замещения фибриновой фракции собственной крови человека аутогенной костной тканью. В зависимости от возраста и общего иммунного статуса пациента эти сроки будут разниться.
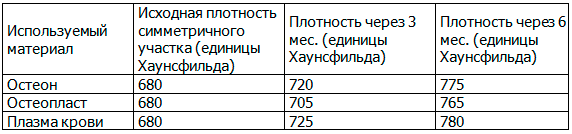
Таблица 6. Сравнительная характеристика плотности костной ткани в области дефекта и в симметричной зоне
Заключение. Результаты, полученные при проведении замещения дефектов костной ткани с использованием аутоматериала, полученного из плазмы крови человека, показывают, что применение 100% биологически совместимого материала предупреждает риски развития реакций гиперчувствительности, при этом, не уступая в регенеративной способности в сравнении с коллаген-гидроксиапатитовыми препаратами. Более того, обладая большей пластичностью, FRP позволяет замещать дефекты различной конфигурации, использовать в качестве мембраны, а также комбинировать с другими препаратами. Результаты исследования также говорят о сниженных сроках восстановления костной ткани в области дефекта. Несмотря на незначительные различия в плотности костной ткани в исследуемой области через 6 месяцев, можно утверждать, что использование собственной плазмы крови человека более приоритетно в виду остальных параметров, таких как биосовместимость, а также большая экономическая выгодность и доступность, по сравнению со стандартными препаратами. На основании проведенного исследования можно заключить, что применение плазмы крови человека является наиболее перспективным, но во многих клинических случаях должно дополняться препаратами, чья морфологическая структура (в форме гранул, порошка и т.д.) позволяет произвести адекватное заполнение конкретного дефекта для более быстрого достижения полной регенерации костной ткани в необходимой области.
