Введение. Макрофаги, наряду с NK-клетками (Natural killer, естественными киллерными клетками), являются наиболее многочисленной популяцией иммунокомпетентных клеток в маточно-плацентарной области [8]. Цитокины, вырабатываемые местными макрофагами, выступают посредниками в развитии воспалительных и иммунных реакций в системе мать-плацента-плод с нарушением морфологических и функциональных свойств клеточных мембран, энергетического обмена, истощением защитного резерва клеток [3].
Однако при наступлении беременности макрофаги, находящиеся в базальной децидуальной оболочке, приобретают специфический фенотип, который участвует в различных аспектах местного гомеостаза, развитии плаценты и в толерантности материнского организма к полуаллогенному трофобласту [12, 15]. Изменения количественного содержания или функционирования децидуальных макрофагов может нарушать функции инвазивного цитотрофобласта и плацентарное развитие, приводя к различным нарушениям беременности, вплоть до ее прерывания [13, 14]. Согласно данным разных исследователей, содержание макрофагов в базальной децидуальной оболочке достаточно велико (около 20 %) и остается таковым на протяжении всей беременности [13, 14]. При наличии инфекции, в условиях сниженной общей иммунореактивности беременной, децидуальные макрофаги участвуют в клеточном иммунном ответе, реализуют иммунные реакции, располагаясь в непосредственной близости к «объекту реакции» [2, 4, 7].
Второй популяцией макрофагов, локализующихся на границе мать-плод, являются макрофаги ворсин хориона или клетки Кащенко-Гофбауэра, имеющие плодное происхождение [8]. Их содержание в 4-20 недель гестации может составлять до 40 % всех нетрофобластных клеток [10]. В ранние сроки беременности клетки Кащенко-Гофбауэра являются единственной значимой популяцией иммунокомпетентных клеток в строме ворсин, способной стимулировать пролиферацию материнских лимфоцитов in vitro и, следовательно, участвовать в неспецифических защитных реакциях в плаценте при проникновении патогена [11].
В связи с этим целью настоящего исследования явилась оценка изменений численной плотности материнских и плодных макрофагов в ранние сроки беременности при инфицировании Chlamydia trachomatis.
Материал и методы. Методом сплошной выборки были обследованы 102 беременные женщины, направленные для искусственного прерывания беременности по немедицинским показаниям в гестационном сроке 6-8 недель. Средний возраст пациенток, включенных в исследование, статистически значимо не различался в исследованных группах и составил в среднем 28±5,3 лет.
До оперативного вмешательства все женщины были клинически обследованы. Оценку вагинально-цервикального биоценоза проводили на основании анализа уретральных, влагалищных и цервикальных мазков с окраской по Граму. Идентификацию урогенитальных хламидий осуществляли методом полимеразной цепной реакции. Критерием диагностики персистентной формы хламидийной инфекции являлось обнаружение антител класса G в сыворотке крови к рекомбинантному белку теплового шока hsp60 Chlamydia trachomatis; активной формы – совместное обнаружение антител класса G в сыворотке крови иммуноферментным методом к рекомбинантным белкам МОМР (главный белок наружной мембраны) и pgp3 (плазмидийный гликопротеин) Chlamydia trachomatis.
По результатам исследования были выделены следующие группы:
1-я – 24 пациентки с инфицированием Chlamydia trachomatis в активной форме;
2-я – 12 пациенток с инфицированием Chlamydia trachomatis в персистентной форме;
3-я (контрольная) – 66 пациенток без хламидийного инфицирования.
Критериями исключения из исследования являлись: наличие неразвивающейся беременности, анэмбриония, аутоиммунные заболевания, декомпенсированная экстрагенитальная патология и инфекции, передаваемые половым путем (гонорея, трихомониаз, уреа- и микоплазмоз). Женщины, лечившиеся по поводу хламидийной инфекции до наступления настоящей беременности, также исключались из исследования. Критериями включения в настоящее исследование были случаи нормально прогрессирующей беременности у женщин с хламидийной инфекцией.
Материал, полученный при выскабливании полости матки во время артифициального аборта, забирали для гистологического исследования. Объекты фиксировали в 10%-м растворе нейтрального формалина и по общепринятой методике заливали в парафин. После приготовления срезов толщиной 4-6 мкм, проводили иммуногистохимическое окрашивание при помощи моноклональных антител СD68 (Cluster of Differentiation 68) (DakoCytomation, Дания), визуализацию экспрессии осуществляли с использованием набора EnVision (DakoCytomation, Дания). Ядра докрашивали гематоксилином Майера.
Для подсчета численной плотности клеток в 1 мм2 среза базальной децидуальной оболочки и ворсинчатого хориона использовали окулярную вставку с известной площадью, при ок. 10 и об. 90. Просмотр и фотографирование микропрепаратов осуществляли на микроскопе «Axiostar plus» (Carl Zeiss, Германия). Cтатистическую обработку результатов проводили при помощи лицензионного пакета программ Statistica 6,0 for Windows. Анализ полученных данных осуществляли методами описательной статистики с вычислением медианы Ме и интерквартильного интервала Q1-Q3. Для оценки различий использовали непараметрический критерий Манна-Уитни. Значимость различий между показателями разных групп принимали при р<0,05.
Все проводимые исследования были одобрены локальным этическим комитетом Сибирского государственного медицинского университета (рег. № 1278 от 01.03.2010 г.) и выполнялись с письменного согласия пациенток.
Результаты и обсуждение. При гистологическом исследовании во всех изученных группах CD68-позитивные клетки в базальной децидуальной оболочке характеризовались чаще всего вытянутой, отростчатой формой, крупным гиперхромным ядром. Локализовались преимущественно вокруг спиральных артерий, вблизи просветов эндометриальных желез, а также диффузно в строме (рис. 1).
Клетки Кащенко-Гофбауэра имели преимущественно округлую или овальную форму, эксцентрично расположенное ядро и вакуолизированную цитоплазму, что соответствовало строению плацентарных макрофагов при физиологически протекающей беременности [8]. Располагались свободно в просвете стромальных каналов мезенхимальных ворсин (рис. 2).
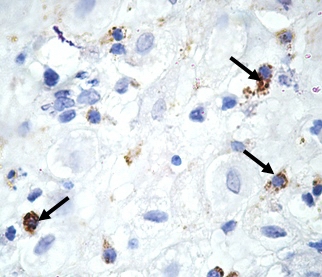
Рис. 1. CD68-позитивные клетки (указаны стрелками) в базальной децидуальной оболочке при инфицировании Chlamydia trachomatis в персистентной форме. Беременность 6-8 недель. Иммуногистохимическое окрашивание, гематоксилин. Увел. 900
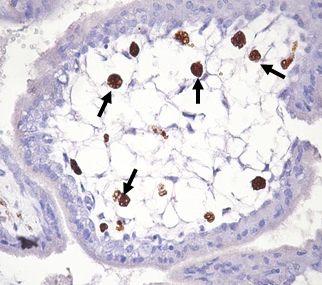
Рис. 2. CD68-позитивные клетки (указаны стрелками) в строме ворсины хориона. Инфицирование половых путей Chlamydia trachomatis в персистентной форме. Беременность 6-8 недель. Иммуногистохимическое окрашивание, гематоксилин. Увел. 400
При подсчете численной плотности CD68-позитивных клеток в базальной децидуальной оболочке и ворсинчатом хорионе отличий между сравниваемыми группами не наблюдалось (табл. 1).
При этом ранее нами была установлена выраженная экспрессия рецепторов (TLR2 – Toll-like receptors), распознающих бактериальные продукты на поверхности всех CD68-позитивных клеток, что свидетельствовало об активации макрофагов базальной децидуальной оболочки при активной и персистентной форме хламидиоза [6].
Поскольку в норме децидуальные макрофаги обладают выраженным иммуносупрессивным действием на цитотоксическую активность лимфоцитов базальной децидуальной оболочки, при активации TLR2 в клетках активируется выработка цитокинов, запускающих пролиферацию естественных киллерных клеток [1, 16]. Таким образом, цитотоксическая активность лимфоцитов увеличивается, что способствует замедлению гестационной трансформации стромы децидуальной оболочки, недостаточному питанию развивающегося трофобласта и, как следствие, отставанию в развитии ворсинчатого хориона [5, 9].
Таблица 1. Численная плотность CD68+ клеток в базальной децидуальной оболочке и ворсинчатом хорионе в 6-8 недель беременности при инфицировании Chlamydia trachomatis (Ме (Q1-Q3)), клеток/мм2
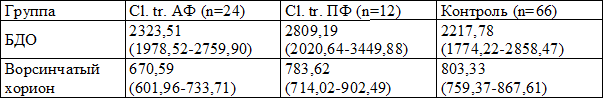
Примечание: статистически значимые отличия от соответствующей группы при р<0,05. Критерий Манна-Уитни для двух независимых групп. БДО – базальная децидуальная оболочка, Cl. tr. АФ – активная форма, Cl. tr. ПФ – персистентная форма хламидийного инфицирования
Нами также было определено соотношение между численной плотностью макрофагов базальной децидуальной оболочки и численной плотностью макрофагов ворсин плаценты, которое при активной форме хламидиоза составило 3,46, при персистентной – 3,58, а в контрольной группе – 2,76. Увеличение данного коэффициента при хламидийном инфицировании наглядно демонстрирует мéньшее количество иммунокомпетентных клеток плодового происхождения, по сравнению с таковым при физиологически протекающей беременности. При этом, учитывая активное участие плацентарных макрофагов в ангиогенезе и развитии плаценты, можно с высокой долей вероятности высказываться об отставании плацентарного роста от гестационной нормы и о явных предпосылках к развитию плацентарной недостаточности [9].
Заключение. Таким образом, при хламидийном инфицировании в ранние сроки беременности, наряду с высоким инфекционным риском существует риск развития плацентарной недостаточности, связанный с изменениями соотношения численной плотности децидуальных макрофагов и макрофагов ворсин плаценты.
