Воспалительные заболевания органов мочеполовой системы женщин, обусловленные патогенными и условно-патогенными микроорганизмами, занимают 1-е место в структуре гинекологической патологии и являются сложной медико-социальной проблемой, так как связаны с осложнениями в репродуктивной сфере. Роль в развитии воспалительных урогенитальных заболеваний микроорганизмов, относящихся к представителям семейства Mycoplasmataceae (в частности, Ureaplasma urealyticum), до настоящего времени остаётся предметом дискуссий. Однако, по данным литературы, до 40% воспалительных урогенитальных заболеваний обусловлено генитальными микоплазмами, широкое распространение которых среди клинически здоровых женщин разного возраста позволило большинству исследователей рассматривать их как условно-патогенные микроорганизмы, способные при определённых условиях инициировать развитие патологических процессов [2].
Уреаплазмы колонизируют половые органы 20-80% практически здоровых лиц. В то же время получены достаточно убедительные доказательства того, что уреаплазмы могут быть причиной хориоамнионита, спонтанного аборта, послеродовой лихорадки, низкой массы тела ребёнка. В настоящее время показана ассоциация уреаплазм с простатитом, эпидидимитом, пиелонефритом, бактериальным вагинозом, бесплодием, хотя этиологическая роль микроорганизма в развитии этих заболеваний окончательно не установлена [7].
Ureaplasma urealyticum рассматривается как возможный этиологический агент, но только при исключении всех других причин воспалительного процесса. Для развития инфекционно-воспалительного процесса особое значение имеет не столько сам факт наличия микоплазм, сколько широта и массивность их распространения, вирулентность конкретного штамма, особенности компенсаторно-приспособительных реакций и иммунного статуса макроорганизма [1].
В отношении микоплазменной инфекции не существует единой точки зрения в тактике ведения беременности, и среди специалистов можно встретить сторонников как скринингового обследования и лечения инфицированных лиц, так и полного игнорирования роли микоплазм в перинатологии [11]. Доказано, что применение антибиотиков по поводу контаминации влагалища U. urealyticum не снижает риск преждевременных родов и рождения ребёнка с низкой массой тела [13].
Антибиотики являются одними из наиболее часто назначаемых беременным женщинам рецептурных препаратов. При назначении лечения во время беременности всегда существует риск неблагоприятного (тератогенного или токсического) воздействия лекарственных средств на плод, находящийся на разных стадиях развития, а также на организм новорожденного. Практически все антимикробные препараты проникают через плаценту и потенциально способны вызвать нежелательные реакции у плода [8].
Взаимная связь поражений последа и внутриутробных инфекций несомненна, учитывая роль плаценты, как органа барьерного типа [10].
В децидуальной ткани плаценты главным клеточным компонентом служат децидуальные стромальные клетки. Децидуальные клетки являются основным «рабочим элементом» в плаценте, которые осуществляют трофическую, защитную, иммунорегулирующую и гемопоэтическую функции [5].
В прошедшие десятилетия работами ряда исследователей было доказано, что средние размеры клеток и их ядер могут служить критерием их прижизненной функциональной активности [3, 9]. Путём определения размеров ядер клеток можно обнаружить изменения деятельности органов при воздействии хроническими и физическими факторами, определить на какие именно клетки действует тот или иной агент, установить продолжительность и степень действия этого агента [6].
Материалы и методы исследования. Объектом исследования служили плаценты, полученные от родильниц, беременность которых была осложнена уреаплазменной инфекцией, пролеченной во время беременности антибиотиками по стандартным алгоритмам. Все данные были получены из следующих документов: обменная карта, история родов, история развития новорожденного. Нами было исследовано 3000 децидуальных клеток из трех зон плаценты: центральной (около пуповины), краевой (ближе к краю плаценты) и парацентральной (между ними) зон. Далее материал подвергался стандартным гистологическим методикам с окраской гематоксилин-эозином. Основное рабочее увеличение - × 400. С помощью окуляра – микрометра, определялся меньший и больший диаметры децидуальных клеток и ядер базальной пластинки (БП) и септ, количество децидуальных клеток на мм2 площади базальной пластинки и септ. Используя полученные величины, вычислялись объемы децидуальных клеток, их цитоплазмы и ядер, ядерно-цитоплазматическое отношение (ЯЦО) для них. В каждом препарате методом случайной выборки проводилось измерение каждого из исследуемых параметров 100 раз. На основании вычисленных диаметров стромальные децидуальные клетки базальной пластинки и септ были распределены по клеточным популяциям на К-клетки, малые децидуальные клетки (МДК) и большие децидуальные клетки (БДК) [5]. Кроме того, были составлены вариационные кривые объёма ядер децидуальных клеток базальной пластинки и септ с шагом в 50 мкм3 с соотношением к ядерно-цитоплазматическому отношению для каждого ранга. Полученные результаты подвергались статистической обработке и сравнению.
Результаты и их обсуждение. В результате исследования было выявлено, что количество децидуальных клеток базальной пластинки в 1 мм3 достоверно увеличивалось относительно центральной зоны плаценты к парацентральной и краевой зонам, между которыми достоверных отличий не наблюдалось. В септах, этот параметр был значимо снижен в парацентральной зоне относительно центральной и краевой зон плаценты, где значения оставались на одном уровне и достоверно не отличались друг от друга. В свою очередь, сравнивая количество децидуальных клеток базальной пластинки и септ в 1мм3, были замечены достоверные отличия в центральной и краевой зонах плаценты, в то время как в парацентральной зоне, и в базальной пластинке и в септах, значения данного параметра были очень близкими. Таким образом, преимущественно клетки располагаются в центральной и краевой зонах септ плаценты, а в базальной пластинке – в парацентральной зоне (рис. 1).
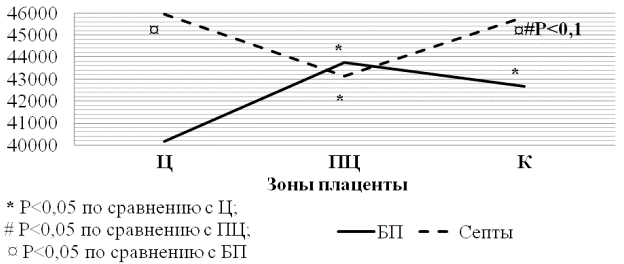
Рис. 1. Количество децидуальных клеток базальной пластинки и септ в 1 мм3 объёма плаценты
Количественное содержание клеток было отражено и в их общем объёме в 1мм3 каждой из зон плаценты. Для базальной пластинки, показатели общих объёмов децидуальных клеток и их цитоплазмы имели аналогичную тенденцию с их количеством, в то время как, в септах наблюдалась обратная зависимость. В септах, показатели общих объёмов децидуальных клеток и их цитоплазмы были достоверно выше таковых в базальной пластинке. Однако, в септах и базальной пластинке центральной зоны плаценты, эти значения были значимо ниже, чем в парацентральной и краевой зонах, где эти показатели достоверно не отличались друг от друга. Общие объёмы ядер базальной пластинки достоверно увеличивались к парацентральной зоне плаценты относительно центральной, и статистически значимо снижались к краевой зоне, относительно центральной и парацентральной зон. В септах этот показатель равномерно снижался от центральной к краевой зоне плаценты и имел между ними статистические различия. В центральной и краевой зонах септ общие объёмы ядер децидуальных клеток были достоверно выше таковых в базальной пластинке (рис. 2).
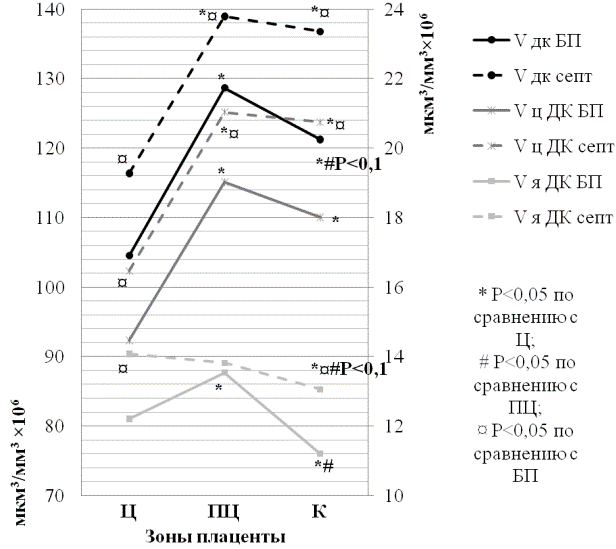
Рис. 2. Общие объёмы децидуальных клеток, цитоплазмы и их ядер в базальной пластинке и септах в 1 мм3 объёма плаценты
Оценивая распределение по клеточным популяциям стромальных децидуальных клеток, можно сделать вывод, что большинство таковых относится к классу малых децидуальных клеток (рис. 3). В свою очередь, в септах, наблюдалось незначительное увеличение К-клеток и снижение малых децидуальных клеток от центральной к краевой зоне плаценты. Такая же ситуация была характерна и для базальной пластинки, за исключением краевой зоны плаценты, где наблюдалась тенденция к появлению больших децидуальных клеток и было выявлено самое большое относительное количество малых децидуальных клеток на фоне самого минимального количества К-клеток, доля которых составила примерно 1/5 от количества всех клеток в этой зоне. Стоит отметить, что в центральной зоне, как базальной пластинки, так и септ, процент распределения децидуальных клеток был абсолютно идентичен.
Исходя из этого, можно отметить, что в базальной пластинке краевой зоны плаценты выделяется большое количество межклеточного вещества и идёт тенденция к увеличению количества секретирующих клеток, продуцирующих плацентарные белки, при этом, иммунорегулирующая функция децидуальных клеток в этой зоне заметно снижается. Тогда как, в септах, от центра к периферии плаценты, увеличивается выработка протеогликанов, выполняющих строительную и трофическую функции. Учитывая, что К-клетки располагаются преимущественно во внеплацентарных оболочках, можно сделать предположение о том, что со стороны плода начинает устанавливаться иммунорегулирующая функция.
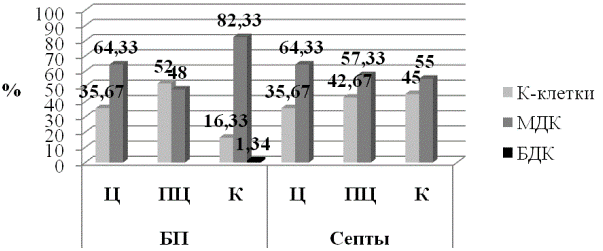
Рис. 3. Распределение по клеточным популяциям стромальных децидуальных клеток
При распределении объёма ядер децидуальных клеток по частоте исходных несистематизированных данных на 14 классов с интервалом в 50 мкм3, было выявлено, что во всех зонах плаценты, как в базальной пластинке, так и в септах, значительное число ядер имеет значения в пределах от 51 до 100 мкм3, далее, с увеличением объема ядер происходит значительное снижение их количества, в то время как в диапазоне 201-250 мкм3 вновь наблюдаются некоторые незначительные увеличения количества ядер, однако, амплитуда этих «пиков» значительно снижается относительно увеличения объёма ядра. Таким образом, для каждой зоны плаценты имеется 2 моды, относящихся к одним и тем же классам объёма ядер.
В центральной зоне по достижении первой моды (К1) количество ядер септ было несколько выше такового в базальной пластинке. Однако, по достижении второй вершины (К2), ситуация изменилась на противоположную. С увеличением объёма ядра, равномерно возрастает и ядерно-цитоплазматическое отношение, о чём свидетельствует коэффициент аппроксимации линии тренда (рис. 4).
В парацентральной зоне плаценты ситуация по отношению к количеству ядер между базальной пластинкой и септами явилась достаточно нестабильной в каждом из последующих классов ранжирования объёма ядер (рис. 5). В первой моде (К1), процент ядер в базальной пластинке был значительно выше, чем в септах. В зоне второго пика (К2), ситуация изменилась в обратную сторону. ЯЦО в септах имело тенденцию к увеличению с последовательным возрастанием объёма ядра, в то время как в базальной пластинке, оно увеличивалось по достижении К2, затем резко, почти в 2 раза падало и не менее резко увеличивалось к ядрам с объёмом 401-450 мкм3.
В парацентральной зоне плаценты количество ядер БП, соответствующих первому пику, увеличивается примерно на 7% относительно центральной, в то время как количество ядер септ снижается на одну треть, при этом, ЯЦО клеток обоих объектов первой моды остаётся на одном уровне. В зоне К2, количество ядер базальной пластинки сохраняет свои значения, в то время как в септах, этот показатель увеличивается почти в 3 раза при сравнении парацентральной зоны с центральной. Так же, значительно увеличиваются значения ядерно-цитоплазматического отношения до 0,18 в септах и 0,19 в базальной пластинке, относительно центральной зоны, где этот показатель был зафиксирован на отметке 0,16 и 0,15 соответственно.
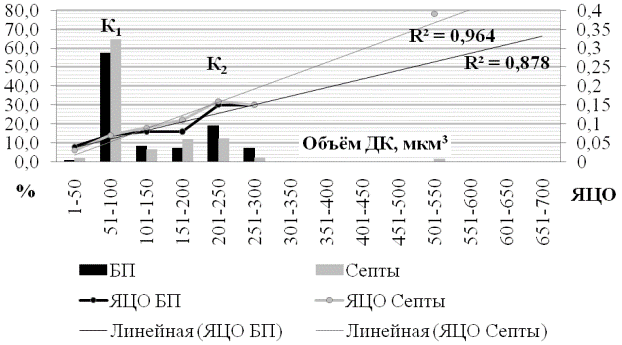
Рис. 4. Вариационная кривая объёма ядер децидуальных клеток и их ядерно-цитоплазматического отношения в центральной зоне плаценты
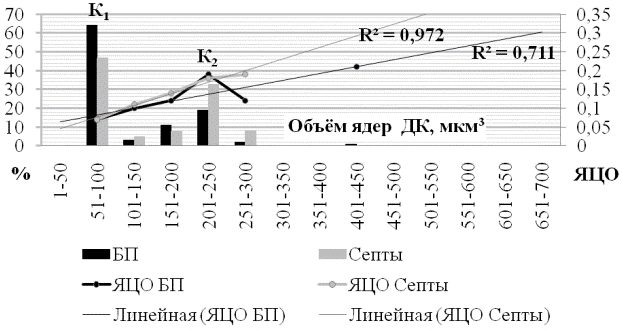
Рис. 5. Вариационная кривая объёма ядер децидуальных клеток и их ядерно-цитоплазматического отношения в парацентральной зоне плаценты
В краевой зоне в области первого пика (51-100 мкм3) процент ядер септ был значительно выше такового в базальной пластинке (рис. 6). По достижении второй вершины (К2) превалировало количество ядер базальной пластинки над ядрами септ. ЯЦО как базальной пластинки, так и септ последовательно линейно увеличивалось с увеличением объёма ядра. Однако, значения ядерно-цитоплазматического отношения базальной пластинки в каждом из последующих классов были значительно ниже, чем в септах, за исключением первой моды. Для первого и второго пика краевой зоны направленность в изменениях количества ядер сходна с таковой в центральной зоне, в то время как по количеству ядер в базальной пластинке первая мода краевой зоны плаценты имеет наиболее низкие значения, а вторая - наиболее высокие, относительно других зон.
Проанализировав ядерно-цитоплазматические отношения, характерные для каждой из мод, было выявлено, что на пике К1, на всём протяжении плаценты ЯЦО БП и септ совпадают. На пике К2 наблюдается увеличение величины ЯЦО базальной пластинки и септ от центральной к парацентральной зоне, в краевой же зоне плаценты это отношение снижается, причём в БП значительно. В зоне первой моды на всём протяжении плаценты наблюдалось максимальное количество ядер, как в базальной пластинке, так и в септах. В то время как в парацентральной зоне, на пике К2, было зафиксировано самое большое количество ядер в септах.
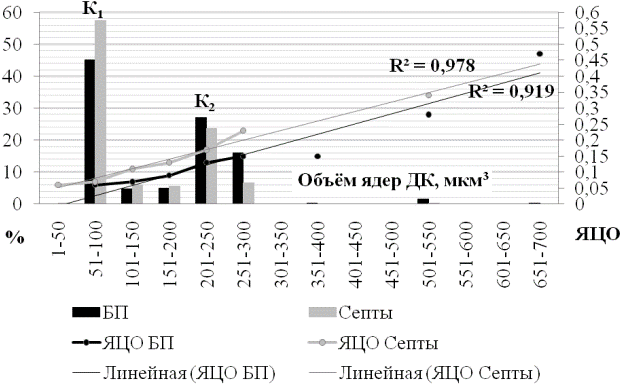
Рис. 6. Вариационная кривая объёма ядер децидуальных клеток и их ядерно-цитоплазматического отношения в краевой зоне плаценты
Заключение. В целом выявлено, что наиболее активны децидуальные клетки в парацентральной зоне плаценты, и она же поддерживает функциональное равновесие между работой базальной и хориальной пластинок. Центральная и краевая зоны скорее относятся к наиболее мобильным пунктам реагирования.
В итоге, можно говорить, что после лечения возрастает функция иммунорегуляции и активируется выработка межклеточного вещества децидуальными клетками краевой зоны.
В процессе исследования было выявлено, что при применении антибиотиков во время беременности, осложнённой Ureaplasma urealyticum, многообразие морфологических проявлений в плаценте, по-видимому, связано с достаточно быстрым уменьшением ядерно-цитоплазматического отношения. В то же время общий объём децидуальных клеток увеличивается к краевой зоне плаценты. Основное количество децидуальных клеток в плаценте представлено малыми децидуальными клетками (в среднем, от 48 до 82%), и К-клетками (в среднем, от 16 до 52 %) с наибольшей выраженностью объёмов ядер 50-100 мкм3 (К1 пик).
Исходя из полученных сведений, мы можем констатировать, что при уреаплазмозе, после его лечения во время беременности, в достаточном количестве децидуальных клеток во всех зонах плаценты отмечались явления полиплоидии (до 30%) с удвоенным объёмом ядер, и очень редко встречались ядра с четырёхкратным увеличением, по преимуществу в септах центральной и краевой зон, а также базальной пластинки краевой зоны плаценты. Для остальных ядер, предположительно, было характерно функциональное набухание.
Таким образом, пролиферативные процессы децидуальных клеток активизируются, но эти процессы идут равномерно без характерных всплесков, что подтверждается и ЯЦО. Первичные полиплоидные ядра встречаются в 2-3 раза реже обычных. Наблюдается активная функциональная деятельность клеточного компонента плаценты с интенсивной выработкой межклеточного вещества, небольшого количества клеток с функциональным набуханием ядер и полиплоидией.
Различные зоны плаценты обладают разной степенью активности, количества и размеров клеток.
Клетки базальной пластинки, до встречи с ворсинами, находились в более спокойном функциональном состоянии. По мере приближения хориальных ворсин к базальной пластинке в краевой зоне плаценты, происходит резкое возбуждение децидуальных клеток с функциональным набуханием ядер и увеличением их количества с полиплоидией.
Полиплоидные клетки являются обязательным элементом плацентарных тканей человека, обеспечивая протекание отдельных этапов их дифференцировки. Предполагается, что увеличенная плоидность генома может являться ненаследственной модификационной адаптацией в результате изменения внешних условий, вследствие чего, организм может изменяться в пределах нормы реакции, заданной генотипом. Полиплоиды обычно устойчивы к неблагоприятным воздействиям, которые могут способствовать их возникновению. Предполагается, что увеличенная плоидность генома может являться защитой от генотоксических воздействий. С другой стороны, показано, что рост количества аномальных клеток имеет место при стрессе и старении [4].
С точки зрения мутационной изменчивости, появление полиплоидных форм может приводить к снижению жизнеспособности и репродукции клеток. Также, в рамках воздействия инфекционных агентов, могут иметь место и комбинативные мутации, приводящие к соматическим изменениям в генетическом составе клеток потомков. Таким образом, полиплоидия играет свою роль как эволюционный фактор и развивается как результат клеточного стресса или заболевания [12], что может иметь место при воздействии инфекционных агентов, в частности Ureaplasma urealyticum, а также антибиотиков.
Полиплоидные децидуальные клетки являются наиболее функциональными клетками плаценты. Возможные изменения в геномах полиплоидных клеток могут приводить к мутациям в сопряжённых клетках и тканях. Поэтому увеличение их количества до определённого порога при неблагоприятных воздействиях на организм матери можно отнести к факторам риска и сделать предположение о том, что явление полиплоидии в тканях плаценты, в частности децидуальных клетках, при воздействии внутриутробных инфекций, может играть роль в развитии онкологических заболеваний органов женской репродуктивной системы. С этой точки зрения, возможно, рассматривать эти клетки даже как предикторы канцерогенеза. Это предположение является предметом наших дальнейших исследований.
