Введение. Клиницисту любой специальности хорошо известно, что в период беременности женщины с ожирением являются группой высокого риска по развитию не только акушерско-гинекологических осложнений, но и патологии общесоматического профиля. Однако в последнее время, на фоне исходно негативного преморбидного фона, все чаще появляются публикации, свидетельствующие о том, что и женщины с нормальной, а тем более недостаточной массой тела, также представляют собой группу, угрожаемую, в частности, по самопроизвольному прерыванию беременности на раннем сроке [1, 2]. Особенно остро эта проблема стоит в рамках программы по экстракорпоральному оплодотворению [3]. Кроме того, как российскими, так и зарубежными учёными было продемонстрировано, что избыточная прибавка массы тела за период беременности, даже у женщин с нормальным весом, ассоциирована с развитием ожирения, а также формированием сахарного диабета, проатерогенной дислипидемии в отдалённом периоде после родов [4-6]. В сложившейся ситуации представляется актуальной разработка комплекса мер, которые бы позволили профилактировать формирование или прогрессирование ожирения в период беременности без вреда для матери и плода.
Цель исследования. На основании анализа взаимовлияния между динамикой жировой ткани, уровнем гликемии и состоянием вегетативного статуса у матери и плода разработать комплекс мер, направленных на профилактику развития или прогрессирования ожирения у беременных с различной массой тела.
Материал и методы исследования. В период с 2010 по 2013 г. на кафедрах госпитальной терапии, акушерства и гинекологии Военно-медицинской академии им. С.М. Кирова проведено обследование 92 беременных с абдоминальной формой ожирения (средний возраст – 34,0±3,5 лет, средний срок гестации – 14,8±2,2 недели): 49 человек с ожирением I степени (средний индекс массы тела (ИМТ) 31,6±1,4 кг/см2, окружность талии 95,2±5,1 см) и 43 человека с ожирением II степени (средний ИМТ 37,9±3,4 кг/м2, окружность талии 105,1±6,6 см). Группа контроля состояла из 24 практически здоровых беременных с нормальными ИМТ и окружностью талии, сопоставимых по возрасту и сроку беременности с исследуемыми основной группы.
ИМТ рассчитывали по формуле А. Кетле [масса тела (см)/рост2 (м)]; с целью исключения погрешности, обусловленной наличием фето-плацентарного комплекса, брались величины роста и веса женщины, имевшиеся до начала гестации. Показатели ИМТ интерпретировались в соответствии с рекомендациями Всемирной организации здравоохранения.
Обследование женщин за период беременности выполнялось дважды: на начальных сроках (максимально до 15 недели) и на 28 гестационной неделе. При повторном обследовании количество женщин в группах уменьшилось, что было обусловлено самопроизвольным прерыванием беременности на раннем сроке или отказом женщин от дальнейшего участия в исследовании по личным причинам. Так, к 28 гестационной неделе группа женщин с изолированным ожирением состояла из 82 человек: 45 с ожирением I степени и 37 с ожирением II степени.
Комплекс обследования включал в себя выполнение антропометрических замеров женщины (рост, вес, окружность талии, определение толщины кожно-жировой складки в области груди, передней подмышечной линии, VII ребра, ягодиц, верхней трети передней и задней поверхностей плеча, предплечья, бедра, голени, в подлопаточной области и над гребнем подвздошной кости с последующим расчётом общей массы жировой ткани (ОМЖТ)); регистрацию ритмокардиограммы матери, плода; сбор анамнеза по режиму и рациону питания, осложнениям, развившимся в период беременности.
ОМЖТ рассчитывали по формуле, разработанной J. Matiegka [7]:
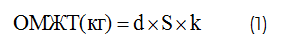
где d – средняя толщина кожно-жирового слоя вместе с кожей (мм), S – площадь поверхности тела (м2), k=1,3 – константа, полученная экспериментально на анатомическом материале.
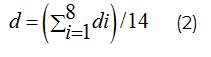
где d, …d8 – толщина кожно-жировых складок на плече (спереди и сзади), предплечье, спине, животе, бедре, голени и груди.
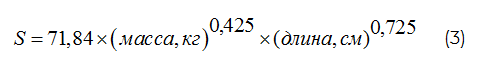
Функциональное состояние вегетативной нервной системы матери и плода оценивали на основании данных спектрального анализа вариационной пульсограммы, а также расчёта индекса напряжения (ИН), разработанного Р.М. Баевским. Регистрация ритмокардиограммы осуществлялась на сертифицированном аппарате «Монитор фетальный/материнский модели Corometrics series 120» производства фирмы «GE Medical System Information Technologies Inc.» (США). Вариационная пульсограмма регистрировалась в положении женщины лёжа на боку, в I стандартном отведении; на 28 гестационной неделе параллельно с регистрацией ритмокардиограммы матери регистрировали ритмокардиограмму плода.
Для получения нестационарного кардиосигнала, позволяющего извлечь большее количество информации о функциональном состоянии вегетативной нервной системы матери и плода [8, 9], в качестве «функциональной пробы» был применен пероральный глюкозотолерантный тест с 75 г глюкозы, который интерпретировался как «проба с гипергликемией». Регистрация кардиоинтервалограммы матери и плода осуществлялась трижды: исходно (в состоянии относительного покоя), после приёма глюкозы – «период гипергликемии» и через 2 часа от начала пробы – «период восстановления». Длительность каждой записи составляла 30 минут.
При первом визите с каждой обследуемой из основной группы проведена беседа о правилах пищевого поведения в период беременности.
Результаты исследования и обсуждение. Ориентируясь на персональные антропометрические данные, полученные исходно (в I триместре), установлено, что за период беременности наибольшее увеличение подкожного жира у женщин происходило в области живота и верхней половины тела (табл. 1).
Причём физиологическим для женщин с ожирением можно считать утолщение кожно-жировой складки в области VII ребра и над гребнем подвздошной кости, а также увеличение ОМЖТ в 1,1-1,2 раза, для женщин с нормальной массой тела в 1,3-1,4 раза относительно исходных данных, так как превышение этих показателей ассоциировалось с увеличением частоты развития нарушений углеводного и/или липидного обменов, осложнений беременности и формирования макросомии плода.
Таблица 1. Динамика некоторых антропометрических показателей у женщин с нормальной и избыточной массой тела в I, II триместрах беременности
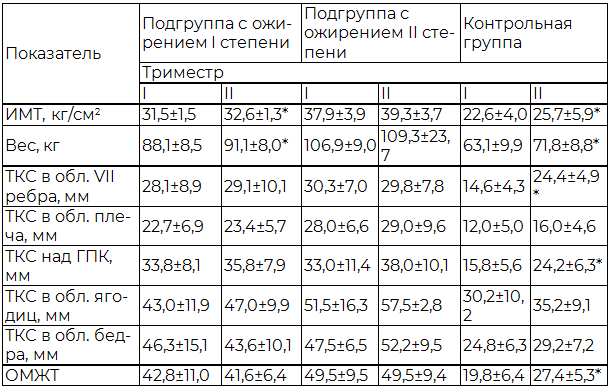
Примечание: ГПК – гребень подвздошной кости, ТКС – толщина кожной складки; * - различие с результатами предыдущего визита, р<0,05.
Женщины с нормальной массой тела также оказались группой высокого риска по развитию ожирения в период беременности. Так, к 28 неделе, максимальная прибавка массы тела женщин была именно в контрольной группе – в среднем 8,7 кг, при том, что в группах с ожирением I и II степени масса тела женщин увеличилась существенно меньше – 3,0 и 2,4 кг соответственно. Сопоставимо с прибавкой массы тела увеличивалась и толщина кожно-жирового слоя. При этом у всех женщин, у которых утолщение кожно-жирового слоя в области VII ребра и над гребнем подвздошной кости превышало 1,5 раза относительно исходных данных (15% от общего числа исследуемых группы контроля), во II триместре беременности развился гестационный сахарный диабет, а через 6 месяцев после родоразрешения было диагностировано экзогенное ожирение.
Представляется, что избыточное увеличение жировой ткани в группе контроля в частности обусловлено особенностями пищевого поведения: на первом визите с каждой женщиной, страдающей ожирением, проводилась беседа о правилах питания в период беременности, в тоже время с женщинами из контрольной группы данная беседа не проводилась. В итоге, если в период первого визита нарушение режима и калоража употребляемой пищи было выявлено у 50% женщин с ожирением I и II степени из обеих исследуемых групп (против 12,5% женщин контрольной группы), то при втором визите эта цифра соответствовала 12,5 и 7,2% для женщин с ожирением I и II степени против 62,5% группы сравнения.
Однако возможна и другая причина усиления чувства голода в период беременности у женщин с нормальной массой тела, так как таким образом организм пытается создать жировой буфер на случай недостаточного энергообеспечения плода. Основываясь на результатах исследования ИН во II триместре беременности было установлено, что у женщин с нормальным ИМТ транзиторное снижение уровня гликемии (обусловленное пребыванием женщины натощак) вызывало активацию центральных механизмов вегетативной регуляции (ИН = 139,09±93,77 у.е.), отражая состояние стресса. После приёма глюкозы активность центрального контура вегетативной регуляции заметно снижалась (ИН = 81,80±47,99 у.е.), но через 2 часа, после утилизации принятой глюкозы, вновь возрастала (ИБ = 117,18±78,50 у.е.). При этом у женщин с ожирением I и II степени активность надсегментарных структур вегетативной регуляции в состоянии «натощак» и через 2 часа после приёма глюкозы была меньше (рис. 1). Все полученные данные носили исключительно характер тенденций, что, вероятнее всего, обусловлено большим вариационным размахом данного показателя.
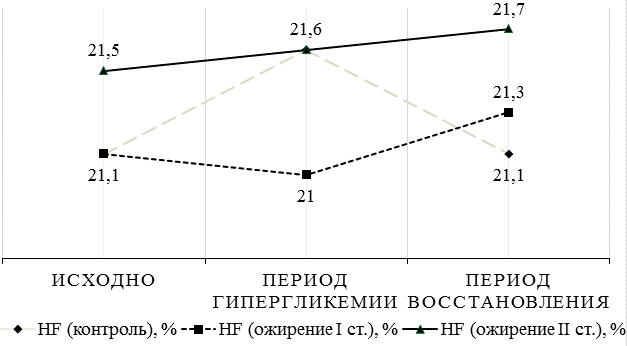
Рис. 1. Динамика индекса напряжения при проведении перорального глюкозотолерантного теста с 75 г глюкозы у беременных с нормальной массой тела и ожирением I, II степени в первом триместре беременности.
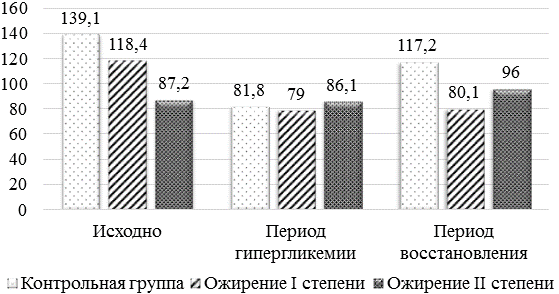
Рис. 2. Реакция симпатического отделов вегетативной нервной системы плода на изменение гликемического профиля матери в зависимости от её массы тела.
Реакция вегетативной нервной системы плода на колебания гликемии у матери (рис. 2, 3) хотя и носила крайне ригидный характер, но тем не менее демонстрировала признаки усиления симпатической активности в виде увеличения мощности LF-диапазона при состоянии женщины натощак (78,9%), причём чем меньше была масса тела женщины, тем выше симпатическая активность плода (r=-0,83, p<0,05). Приём пищи, в данном случае глюкозы, приводил к активации парасимпатического отдела вегетативной нервной системы плода (HF=21,6%) с реципрокным снижением симпатической активности (78,5%).
В связи с полученными результатами, для анализа реакции вегетативной нервной системы плода на изменение уровня гликемии у матери на фоне введения инсулина (преимущественного средней продолжительности и длительного действия), дополнительно была набрана группа женщин с сахарным диабетом, потребовавшим назначения инсулинотерапии (12 человек). Через 1-2 часа после подкожного введения инсулина (по факту достижения эугликемии у матери) у плода отмечалось усиление симпатической активности (повышение LF-спектра с 78,8% (при состоянии матери натощак) до 79% в группе беременных с ожирением I степени и с 78,6% до 78,8% в группе беременных с ожирением II степени), при уменьшении парасимпатического влияния (снижение HF-спектра с 21,2% до 21% в группе беременных с ожирением I степени и с 21,4% до 21,2% в группе беременных с ожирением II степени).
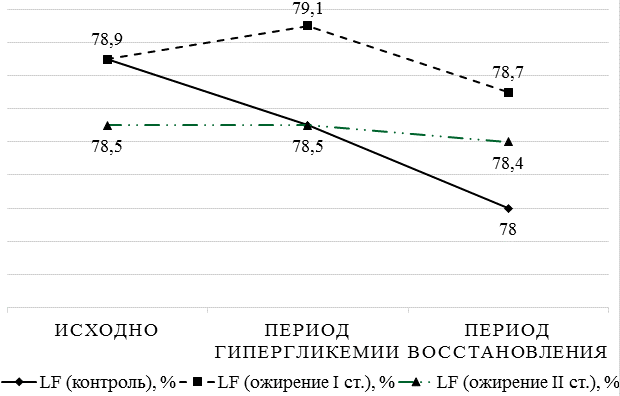
Рис. 3. Реакция парасимпатического отделов вегетативной нервной системы плода на изменение гликемического профиля матери в зависимости от её массы тела.
Заключение. Согласно полученным данным для женщин в период беременности более характерно формирование андроидной формы ожирения. Чем ниже ИМТ женщины до зачатия, тем выше вероятность развития ожирения в период беременности. Такая закономерность может быть обусловлена как экзогенными, так и эндогенными факторами.
Основным экзогенным фактором развития ожирения в период беременности является избыточный, чаще всего лишённый режима приём высококалорийной пищи. Причём если женщины с ранее уже имевшимся избытком массы тела более привержены к систематическому самоконтролю за правильностью питания, то большинство женщин с нормальной массой тела не уделяют этому вопросу должного внимания. В связи с этим необходимо подчеркнуть важность профилактических бесед о диетотерапии, которые должны проводиться специалистами не только с женщинами уже имеющими ожирение, но и с женщинами с нормальной массой тела.
Увеличение жировой массы должно происходить, главным образом, в I, начале II триместров беременности (ориентиром является утолщение кожно-жировой складки в области VII ребра, над гребнем подвздошной кости, а также ОМЖТ у женщин с ожирением в 1,1-1,2 раза, у женщин с нормальной массой тела в 1,3-1,4 раза относительно исходных данных (показателей калиперометрии, проведённой при постановке беременной на учёт в женской консультации). Далее предпочтительно чтобы прибавка массы тела происходила преимущественно за счёт фето-плацентарного комплекса. Основываясь на собственном опыте можно утверждать, что такая тактика позволяет снизить риск развития угрозы прерывания беременности на раннем сроке, а также вероятность формирования или прогрессирования ожирения, нарушений углеводного, липидного обменов.
Правила питания, рекомендуемые беременным, мало отличаются от диеты для пациентов с ожирением. Пищевой рацион должен включать в себя ограниченное количество легко усвояемых углеводов (сахар, пирожные, торты, изделия из сдобного теста, макаронные изделия, картофель). Основная часть углеводной нагрузки должна приходиться на завтрак и обед; обязательны перекусы в виде ланча и полдника. Чтобы исключить эпизоды ночной гипогликемии дополнительно необходимо рекомендовать женщинам поздний ужин, включающий в себя небольшое количество постного мяса, творога менее 5% жирности, сыра менее 30% жирности и тому подобное. Важно подчеркнуть, что легкоусвояемые углеводы, животные жиры должны быть только ограничены, но ни в коем случае не исключены.
Одним из эндогенных факторов формирования или прогрессирования ожирения в период беременности, кроме изменений гормонального статуса, является состояние относительного энергодефицита. Согласно собственным научным результатам, как сами женщины с нормальной массой тела, так и их плод, ввиду недостаточного количества жировой клетчатки, являющейся энергетическим буфером, гораздо хуже, чем женщины с ожирением I, II степени, переносят длительные перерывы между приёмами пищи. Это проявлялось усилением активности надсегментарных структур вегетативной регуляции у матери и симпатической нервной системы у плода, отражая состояние стресса. После приёма 75 г глюкозы в рамках перорального глюкозотолерантного теста активность данных показателей снижалась. Причём, если у женщины с ожирением II степени через 2 часа после приёма пищи (в данном случае глюкозы) доминировала парасимпатическая активность, у женщин с ожирением I степени наблюдалась тенденция к снижению активности парасимпатических влияний, то у женщин с нормальной массой тела наблюдалось усиление активности надсегментарных структур вегетативной регуляции. Что демонстрирует необходимость женщинам с нормальным ИМТ осуществлять небольшие перекусы в среднем через 2-3 часа.
В связи с выявлением негативного влияния энергодефицита матери, обусловленного голодом, на состояние плода была набрана дополнительная группа женщин с сахарным диабетом, потребовавшим назначение инсулина. Исследование вегетативного статуса у данного контингента женщин продемонстрировало, что введение инсулина среднедтительного и длительного действия, особенно женщинам с нормальным ИМТ до беременности, по факту достижения эугликемии приводит к нарастанию симпатической активности у плода. Это доказывает необходимость крайне осторожного подхода к назначению инсулина, оценивая необходимость в данной терапии у каждой женщины персонально. Особенно это актуально стало сейчас, после пересмотра нормативов нормогликемии для беременных, основанного на результатах исследования HAPO [10].
