Актуальность. Преэклампсия (ПЭ) – мультисистемное патологическое состояние, возникающее во второй половине беременности (после 20 недель), характеризующееся артериальной гипертензией в сочетании с протеинурией, нередко отеками и проявлениями полиорганной недостаточности.
В Российской Федерации умеренная ПЭ регистрируется у 3-8% беременных, тяжелая - 1-2%. ПЭ является одной из ведущих причин материнской и перинатальной заболеваемости и смертности [4,12,30], снижает качество последующей жизни женщины и нарушает психосоматическое развитие детей от матерей с ПЭ [17]. Таким образом, ПЭ является значимой медико-социальной проблемой. До настоящего времени единственным методом лечения ПЭ остается своевременное родоразрешение [12,30], поэтому наиболее актуальным направлением в современном акушерстве является поиск ранних эффективных предикторов развития ПЭ и ее профилактика.
На сегодняшний день причина развития ПЭ не установлена. Патогенез данного осложнения связывают с нарушением процесса ремоделирования спиральных артерий с формированием эндотелиальной дисфункции и синдрома системного воспалительного ответа (ССВО) [8,12]. В результате нарушения функции эндотелиальных клеток блокируется синтез вазодилататоров (простациклин, брадикинин, эндотелиальный релаксирующий фактор, оксид азота), что приводит к генерализованному спазму сосудов; снижается антитромбический потенциал эндотелия (нарушение синтеза тромбодулина, тканевого активатора плазминогена, повышение агрегации тромбоцитов) с развитием ДВС-синдрома; повышается проницаемость сосудов, итогом чего является гиповолемия, задержка большого количества жидкости в интерстиции.
В настоящее время установлено, что компоненты системы гемостаза одновременно являются маркерами и медиаторами дисфункции эндотелия и воспаления [8,14]. Актуальность проблемы нарушений системы гемостаза связана еще и с их высокой распространенностью: согласно популяционным исследованиям распространенность генетических форм тромбофилии и антифосфолипидного синдрома в мире составляет от 7 до 15% [14].
Доказана ведущая роль материнской тромбофилии в патогенезе целого ряда акушерских осложнений, включая тяжелые формы ПЭ. Появление все большего количества данных о значении генетических форм тромбофилии в патогенезе акушерских осложнений [2,6,9,14,15,23,25], позволяет предположить, что последние являются лишь внешним проявлением, следствием ранее существующих дефектов системы гемостаза [14].
Таким образом, изучение генетических особенностей системы гемостаза, несомненно, актуально, так как эти показатели могут быть использованы в качестве предикторов ПЭ.
Целью нашего исследования является изучение полиморфизмов генов системы гемостаза у беременных женщин с умеренной и тяжелой преэклампсией.
Материалы и методы исследования. Нами проведено исследование «случай-контроль» 44 беременных женщин, которые получали стационарное лечение в родильном доме Клиники ГБОУ ВПО ЮУГМУ Минздрава России. Критерием включения беременных в исследование явилось информированное согласие женщины на участие в исследовании. Критерии исключения: онкологические заболевания, ВИЧ-инфекция, туберкулез, тяжелая соматическая патология, психические заболевания, хронический алкоголизм, наркомания. План исследования соответствует законодательству РФ, международным этическим нормам и нормативным документам исследовательских организаций, а также одобрен этическим комитетом ГБОУ ВПО ЮУГМУ Минздрава России. Изучены особенности течения беременности и исходы родов. Клинико-лабораторное исследование беременных проводилось в третьем триместре беременности.
В зависимости от наличия/отсутствия гестационного осложнения ПЭ и степени ее тяжести [4] выделены: 1 группа (контрольная) – 14 женщин, течение беременности которых не осложнилось развитием ПЭ; 2 группа – 16 беременных с умеренной ПЭ; 3 группа – 14 пациенток с тяжелой ПЭ. Средний возраст женщин 1-й группы составил 27,00±1,67 лет, 2-й - 27,63±1,05, 3-й - 30,36±1,64.
С целью изучения мутаций генов FV G1691А, FII G20210A, MTHFR С677T, PAI-1 675 4G/5G, FGB G455A у беременных, которые участвовали в исследовании, проведено ПЦР с использованием комплекта реагентов для амплификации «SNP-экспресс» фирмы НПО «Литех» (г. Москва) на аппарате «Терцик» («ДНК-технология», Россия).
Все статистические расчеты были выполнены с помощью пакетов программ: SPSS 12.1, Statistica for Windows 6.0, STADIA 6.3 prof. Для определения средних тенденций использовали методы описательной статистики с получением оценок математических ожиданий, дисперсий и мод всех переменных во всех обследуемых группах. Для оценки различий между группами обследуемых применен аппарат проверки статистических гипотез с использованием критериев Манна-Уитни, χ2 Пирсона, отношение правдоподобия, линейно-линейная связь, коэффициент сопряженности, Лямбда, Тау Гудмена и Краскала, коэффициент неопределенности при уровне значимости критерия 0,05. Для изучения степени корреляционной зависимости между показателями использовался непараметрический корреляционный анализ с расчетом коэффициента непараметрической корреляции Спирмена.
Результаты исследования и их обсуждение. Результаты изучения полиморфизмов FV G1691А, FII G20210A, MTHFR С677T, FGB G455A, PAI-I 675 4G/5G у беременных с ПЭ разной степени тяжести представлены в табл. 1.
Таблица 1. Структура полиморфизмов FV G1691А, FII G20210A, MTHFR С677T, FGB G455A, PAI-I 675 4G/5G беременных контрольной и клинических групп
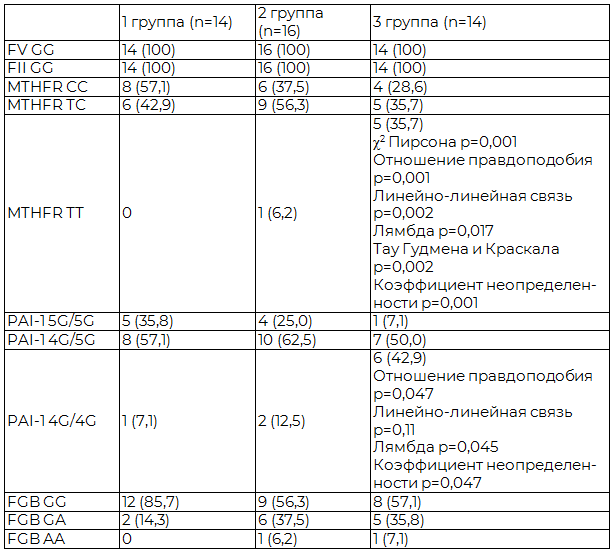
Сведения о распространенности и клинической значимости генетических тромбофилических дефектов нередко противоречивы. Согласно данным литературы, наличие FV G1691А и/или FII G20210A повышает вероятность развития осложнений беременности: невынашивания беременности на ранних сроках (риск повышается в 3 раза), задержки развития плода, ПЭ, плацентарной недостаточности [14]. По данным Макацария А.Д. (2008 г.) FV Leiden встречается у 13% женщин с ПЭ, FII G20210A - 2% [7]. По данным Вереиной Н.К. (2012 г.) установлено, что в популяции женщин Уральского региона с экстрагенитальными и акушерскими факторами тромботического риска частота FV G1691А составила 9,1% (гомозиготы - 2,0%), FII G20210A – 21,4% (гомозигота - 2,6%), в популяции здоровых женщин, не имеющих в анамнезе тромбозов, отягощенной наследственности по тромбозам и акушерской патологии 3,3% (0) и 0 соответственно [2]. Lykke J.A. et al. (2012 г.) установили, что мутация FV Leiden в популяции скандинавских женщин ассоциирована с рядом акушерских осложнений, в том числе тяжелой ПЭ (ОR 1,6; 95% ДИ 1,1-2,4) [25]. Jarvenpaa J. et al. (2006 г.) выявили высокую частоту FV G1691А (9,5%) у пациенток с тяжелой ПЭ в сравнении с контрольной группой (1,8%), наблюдаемое различие распространенности составило 7,7 % (95% ДИ 2,0-13,4), статистически значимых отличий не выявлено для FII G20210A [23]. Аналогичные данные приводят Driul L. et al. (2005 г.) [21]. Hammerova L. et al. (2014 г.) [22], Vavrinková B. et al. (2012 г.) [29], Rodger M.A. et al. (2010 г.) [27], Dalmáz C.A. et al. (2006 г.) [19] не выявили корреляций FV G1691А или FII G20210A с развитием тяжелой ПЭ. В результате нашего исследования (таблица 1) не выявлено ни одного случая мутаций FV G1691А и FII G20210A у обследованных нами женщин, что, вероятно, связано с небольшим объемом выборки.
По данным разных авторов частота мутации MTHFR C677T в России составляет от 10–20% [1] до 55% [3]. Частота гомозиготности MTHFR C677T составляет от 10 до 15% [1,2], а гетерозиготности около - 40% у европейской расы [3]. Существуют значительные межрасовые и этнические различия, но независимо от региона наличие аллеля 667Т связано с повышением уровня гомоцистеина плазмы, повышение более выражено при гомозитности, чем гетерозиготности [3]. Нами установлено, что в контрольной группе 42,9% беременных имели гетерозиготную мутацию MTHFR гена C677T, гомозиготных мутаций не выявлено. Согласно данным современной литературы, дефекты MTHFR C677T занимают ведущее место в структуре тромбофилии у пациенток с акушерскими осложнениями. По данным Медянниковой И.В. и соавторов (2012 г.) носительство точечной мутации 677Т MTHFR в 2 раза увеличивает риск неблагоприятных исходов гестационного процесса [9]. По данным Lykke J.A. et al. (2012 г.) мутация MTHFR в популяции скандинавских женщин ассоциирована с тяжелой ПЭ (OR 1,3; 95% ДИ 1,1-1,6) [25]. Чулков В.С. и соавторы (2013 г.) показали ассоциацию мутации MTHFR 677Т с ПЭ, синдромом задержки развития плода и преждевременными родами [16]. Макаров О.В. и соавторы (2008 г.) приводят данные о наличии связи между гомозиготной мутацией MTHFR 677Т, повышением уровня гомоцистеина и развитием ПЭ [6]. Однако Jääskeläinen E. et al. (2006 г.) для финской популяции женщин не выявили ассоциаций полиморфизма MTHFR C677T с развитием плацентарной недостаточности и ПЭ [24]. Jarvenpaa J. et al. (2006 г.) [23], Camilleri R.S. et al. (2006 г.) [18] так же не установили статистически значимых отличий для MTHFR C677T в группах женщин с ПЭ и нормальным течением беременности. Нами выявлено, что при умеренной ПЭ у 62,5% женщин имеются изменения MTHFR C677T, причем в 1 случае была гомозиготная форма мутации. В когорте беременных с тяжелой ПЭ частота мутаций MTHFR гена C677T составила 71,4%, половина из них гомозиготные формы, что оказалось достоверно больше, чем в других группах.
Результаты изучения частоты встречаемости PAI-1 675 4G/5G в популяции Российской Федерации неоднозначны - от 20% до 68% [5,14], тем более для Уральского региона, расположенного на границе Европы и Азии. При физиологическом течении беременности по данным Бицадзе В.О. и соавторов (2003 г.) [7] частота мутации PAI-I 4G/5G составляет 16% (гомозиготы - 4%), Пшеничниковой Е.Б. и соавторов (2006 г.) [10] - 23,3% (гетерозиготы - 100%), Вереиной Н.К. (2012 г.) [2] - 56,7% (гомозиготы - 6,7%). В нашем исследовании (таблица 1) обращает на себя внимание достаточно высокий процент (64,2%) полиморфизма PAI-1 675 4G/5G (1 случай гомозиготной формы) у женщин контрольной группы. Такие результаты, возможно, связаны с тем, что критерием формирования группы контроля в настоящем исследовании было не физиологическое течение беременности, а отсутствие ПЭ. Однако установлено, что частотная характеристика полиморфизмов фибринолитического звена гемостаза имеет тенденцию к нарастанию по мере приближения к Азиатской части России, в том числе, в Уральском регионе [5]. Согласно данным литературы [14], у беременных с мутацией PAI-1 675 4G/5G в результате гипофибринолиза нарушается дифференцировка и из-за снижения протеазной активности инвазия трофобласта с формированием «эндотелиального» феномена плацентарной недостаточности и ПЭ. Действительно, в результате нашего исследования (таблица 1), у 92,9% пациенток с тяжелыми формами ПЭ выявлены мутации PAI-1 675 4G/5G, гомозиготные варианты зарегистрированы в 57,1% случаев, что оказалось достоверно больше в сравнении с 1 и 2 группами. Однако по данным Бицадзе В.О. и соавторов (2003 г.) при беременности, осложненной ПЭ, эти варианты мутации встречаются в 49,1% случаев (гомозиготы 29,1% и гетерозиготы 20%) [7]. В работе Вереиной Н.К. (2012 г.) указано, что в популяции женщин Уральского региона с экстрагенитальными и акушерскими факторами тромботического риска частота PAI-1 675 4G/5G составила 70,8% (гомозиготы - 22,1%) [2]. Интересные данные получили Пшеничникова Е.Б. и соавторы (2006 г.): 92,2% женщин с метаболическим синдромом имели полиморфизм PAI-1 675 4G/5G (84,5% - гомозигота), их акушерский анамнез в 75,3% случаев был отягощен тяжелой ПЭ [10,14].
По данным Бицадзе В.О. и соавторов (2003 г.) при ПЭ гомозиготные формы мутаций FGB G455A встречаются у 3,6% беременных, гетерозиготные - 9,1% (при физиологическом течении беременности в 4% случаев зарегистрированы гетерозиготы) [7]. В нашем исследовании (таблица 1) частота полиморфизмов FGB G455A у беременных с умеренной (31,2%) и тяжелой ПЭ (42,9%) оказалась выше в сравнении с контрольной группой (14,3%), но достоверных отличий мы не выявили. Косвенно подтверждают результаты нашего исследования Пшеничникова Е.Б. и соавторы (2006 г.) которые установили, что женщины с метаболическим синдромом имеют в 62,3% случаях полиморфизм FGB G455A, а в анамнезе у них в 75,3% случаев была тяжелая ПЭ [10,14]. Вереиной Н.К. (2012 г.) зарегистрировано, что в популяции женщин Уральского региона с экстрагенитальными и акушерскими факторами тромботического риска частота FGB G455A составила 29,2% (гомозиготы 5,8%), у здоровых женщин без тромботического анамнеза - 16,7% (гетерозиготы 100%). В настоящее время выявлено повышение потенциала свертывания крови по мере увеличения тяжести ПЭ, в том числе нарастает уровень гиперфибриногенемии. Действительно, Вереина Н.К. (2012 год) указывает, что одной из лабораторных детерминант, значимо связанных с осложненным течением беременности, является уровень фибриногена [2]. При ССВО замыкается порочный круг процессов воспаления и коагуляции, которые, действуя в совокупности и взаимно активируя друг друга, формируют тяжелейшую клиническую картину вплоть до развития полиорганной недостаточности [14]. Camilleri R.S. et al. (2006) не выявили связи полиморфизма гена FGB G455A с частотой и тяжестью ПЭ [18].
Согласно данным современной литературы, риск акушерских осложнений нарастает при увеличении количества выявленных полиморфизмов. Стрижаков А.Н. и соавторы (2009 г.) установили, что степень тяжести плацентарной недостаточности коррелирует с числом мутаций у беременной [13]. Dalmáz C.A. et al. (2006) отмечают, что только сочетание полиморфизмов генов FV G1691А, FII G20210A, MTHFR С677T, PAI-I 675 4G/5G в бразильской популяции беременных ассоциировано с развитием тяжелой ПЭ [19]. Мы проанализировали данные по количеству и варианту выявленных у беременных полиморфизмов. Установлено, что общее число мутаций в группе пациенток с тяжелой ПЭ (2,07±0,18) оказалось достоверно (критерий Манна-Уитни р1-3=0,025) больше, чем в контрольной группе (1,21±0,20). По количеству гетерозиготных форм статистически значимых отличий в группах мы не обнаружили (1 группа - 1,14±0,16; 2-ая - 1,44±0,26; 3-я - 1,21±0,18), однако гомозиготные варианты мутаций достоверно чаще (р1-3=0,008; р2-3=0,01) регистрировались у женщин с тяжелой ПЭ (0,86±0,11).
На сегодняшний день установлено, что при сочетании полиморфизмов с экстрагенитальной патологией повышается частота тромбоэмболических осложнений. Так, по данным Dawson S. (1991 г.) [20], Mansfield M.W. (1997 г.) [26], Tassies D. (2000 г.) [28] наличие мутации PAI-I 4G/5G и ожирения в несколько раз увеличивает риск тромбозов. Пшеничникова Т.Б., Макацария А.Д. (2006 г.) установили, что у женщин с большим ИМТ в 92% случаев выявляется мутация PAI-1 (гомозиготная форма достоверно чаще), 60% - MTHFR C677T и 66% - FGB G455A [11,14]. Пшеничникова Е.Б. и соавторы (2006 г.) установили, что акушерский анамнез женщин с метаболическим синдромом отягощен в 84,4% невынашиванием, 71,4% - плацентарной недостаточностью, 75,3% - тяжелой ПЭ. Каждая из этих женщин имела мультигенную тромбофилию [10,14]. Безусловно, ожирение, артериальная гипертензия, дислипидемия, инсулинорезистентность, генетически обусловленная тромбофилия – фактора риска развития гестационной патологии. Поэтому мы решили изучить наличие и степень корреляции полиморфизмов MTHFR С677T, PAI-I 4G/5G, FGB G455A, компонентов метаболического синдрома (хроническая артериальная гипертензия, ожирение) с частотой и тяжестью ПЭ у пациенток, которые участвовали в нашем исследовании.
Тяжесть ПЭ положительно коррелировала с наличием у беременных женщин хронической артериальной гипертензии (r=0,456, р=0,002), повышенной массы тела, ожирения (r=0,307, р=0,042), полиморфизмов MTHFR ТT (r=0,415, р=0,005), PAI-I 4G/4G (r=0,353, р=0,019), числом полиморфизмов генов системы гемостаза (r=0,466, р=0,001), количеством гомозиготных патологических мутаций (r=0,597, р<0,001).
Кроме того нами выявлены положительные корреляционные связи тяжелой ПЭ с наличием мутации MTHFR C677T в сочетании с повышенной массой тела, ожирением (r=0,317, р=0,036) и хронической артериальной гипертензией (r=0,367, р=0,014), полиморфизма PAI-1 675 4G/5G в сочетании с ожирением (r=0,301, р=0,047) и артериальной гипертензией (r=0,474, р=0,001).
Таким образом, дальнейшее изучение патогенетических механизмов реализации врожденных факторов риска развития ПЭ позволит прогнозировать данное осложнение на прегравидарном этапе и ранних сроках гестации с целью своевременной профилактики.
Выводы
1. При тяжелой преэклампсии повышена частота гомозиготных форм мутаций MTHFR ТT (35,7%) и PAI-1 675 4G/4G (42,9%).
2. Количество полиморфизмов генов (2,07±0,18) системы гемостаза (особенно патологических гомозиготных вариантов 0,86±0,11) увеличивается при тяжелой преэклампсии.
3. Наличие положительных корреляционных связей мутаций MTHFR ТТ, PAI-I 4G/4G, количества полиморфизмов генов системы гемостаза и гомозиготных вариантов патологических мутаций, случаев хронической артериальной гипертензии, повышенной массы тела, ожирения, а так же сочетания данной соматической патологии и полиморфизмов MTHFR C677T, PAI-1 675 4G/5G с частотой и тяжестью преэклампсии свидетельствует о возможности использования этих маркеров в качестве предикторов развития преэклампсии.
