Введение. В связи с современными успехами репродуктивной и перинатальной медицины, расширением показаний к оперативному завершению беременности в интересах матери и плода, сегодня можно без преувеличения считать, что кесарево сечение – это одна из наиболее часто выполняемых полостных хирургических операций. Хотя по данным Всемирной Организации Здравоохранения частота оперативных родов в мире в целом составляет около 16%, в ряде стран этот показатель достигает 30% и более [16]. По данным Министерства здравоохранения, в Российской Федерации в 2013 г. выполнено 476767 кесаревых сечений, что составило 25,7 % от общего количества произошедших родов [5]. С учетом того, что родильница должна ухаживать за новорожденным и осуществлять полноценное грудное вскармливание, проблеме оптимального восстановления после кесарева сечения уделяется всё большее внимание. Одним из необходимых условий ранней активной послеоперационной реабилитации является надежный контроль болевого синдрома, обязательным компонентом которого считаются методы местной регионарной анальгезии [1]. Однако, как показывает ряд исследователей, проблему послеоперационного обезболивания в акушерстве всё ещё нельзя считать полностью решенной. Так, например, пациентки считают боль наименее желанным следствием оперативных родов [8] и отмечают, что болевой синдром после кесарева сечения был больше, чем радость от рождения ребенка [11]. Мультицентровое исследование, проведенное в 105 хирургических клиниках Германии и Нидерландов и включающее более 70 тысяч оперированных пациентов, показало, что уровень послеоперационной боли в акушерстве выше, чем в других отраслях хирургии. Само кесарево сечение по выраженности болевого синдрома в первые сутки оказалось на 9 месте из 179 различных операций, выше таких более травматичных вмешательств, как панкреатэктомия, протезирование крупных суставов и кардиохирургическая стернотомия [10].
Характеристика болевого синдрома после кесарева сечения имеет по крайней мере два компонента. Звено висцеральной ноцицепции представлено афферентами матки. Соматической – нервными структурами передней брюшной стенки. Как было показано, при доношенной беременности тело матки денервировано и вследствие этого не может служить источником интенсивных болевых ощущений после кесарева сечения [14]. Иннервация зоны разреза передней брюшной стенки осуществляется ветвями торакоабдоминальных нервов Th10-L1 (нижнесрединная лапаротомия) или практически только ветвями корешка L1 (надлобковая лапаротомия). Соматические нервы передней брюшной стенки лежат в межфасциальном клетчаточном пространстве между внутренней косой и поперечной мышцами живота, где и могут быть блокированы действием местного анестетика [13].
Наиболее изученным на сегодняшний день методом периферической регионарной анальгезии передней брюшной стенки является так называемый Transversus abdominis plane (ТАР) block, чаще всего звучащий в русскоязычной литературе как «блокада поперечного пространства живота» (БППЖ) [2,7]. Альтернативным методом воздействия на афференты зоны надлобковой лапаротомии после кесарева сечения является блокада подвздошно-пахового и подвздошно-подчревного нервов – подвздошно-паховая/подвздошно-подчревная блокада (ППППБ) [15]. Задачами настоящей работы явились изучение послеоперационного болевого синдрома при оперативном родоразрешении, а также оценка влияния на качество обезболивания блокад передней брюшной стенки.
Материал и методы. После одобрения этического комитета Северного государственного медицинского университета (г. Архангельск), на базе Государственного учреждения здравоохранения «Липецкий областной перинатальный центр» с июня 2011 г. по сентябрь 2014 г. проведено проспективное рандомизированное исследование. Изучали некоторые субъективные и объективные характеристики болевого синдрома после кесарева сечения, выполненного в плановом порядке при доношенной беременности надлобковым разрезом под спинальной анестезией. Показаниями к кесареву сечению являлись: рубец на матке, миопия высоких степеней, тазовое предлежание плода, возраст первородящей, крупный плод или их сочетания. Спинальная анестезия проводилась по общепринятой схеме. Интратекально, на уровне L2-L3 вводился гипербарический 0,5% раствор бупивакаина без адьювантов в объеме 1,8-2,2 мл (9-11 мг) в зависимости от роста женщины.
Перед операцией, после получения добровольного информированного согласия, проводилась рандомизация. Методом конвертов пациенток распределяли на три группы в соответствии со схемой последующего обезболивания. В первой, контрольной группе проводили традиционную системную анальгезию: кеторолак 30 мг в/в каждые 8 часов, парацетамол 1 г перорально каждые 6 часов с момента окончания операции, трамадол 100 мг в/м по требованию пациентки в режиме «персонал-контролируемой» анальгезии. Во второй группе дополнительно в течение первого послеоперационного часа под контролем ультразвука с двух сторон выполняли блокаду поперечного пространства живота, в третьей – подвздошно-паховую/подвздошно-подчревную блокаду. Ультразвуковая локация мышечно-фасциальных и нервных структур передней брюшной стенки проводилась по общепринятой методике [17]. При выполнении БППЖ в пространство между внутренней косой и поперечной мышцами живота вводили по 20 мл 0,25% раствора ропивакаина. Для ППППБ вблизи сосудисто-нервного пучка вводили по 10 мл 0,5% раствора ропивакаина с каждой стороны. Прием простой жидкости разрешался через 2 часа после операции, изокалорической смеси – через 4 часа, легкой пищи – через 8, в соответствии с физиологической потребностью пациентки. Родильницы психологически настраивались на раннюю мобилизацию и самостоятельный уход за новорожденным.
Во всех группах оценивали выраженность болевого синдрома по 100 мм визуально-аналоговой шкале (ВАШ) в покое и при движении через 3, 6, 9, 12 и 24 часа после операции. Учитывали потребность в трамадоле, время первого его требования, жалобы на тошноту, слабость/сонливость. В качестве оценки возможности полноценной активизации измеряли пиковую объемную скорость выдоха перед операцией, через 6, 12 и 24 часа после нее.
Статистическая обработка осуществлялось с помощью программы SPSS Statistics 17.0 для Windows. Статистическая значимость различий признавалась при значении критерия р<0,05. Непрерывные переменные анализировались параметрическими методами: для сравнения данных двух групп использовался t-тест Стьюдента, а для внутригрупповых сравнений – дисперсионный анализ (ANOVA) для повторных измерений. Порядковые переменные обрабатывались непараметрически методами при помощи таблиц сопряженности и критерия χ2. В связи с небольшим количеством случаев, данные времени требования опиоида также обрабатывались непараметрически с применением критерия Манна-Уиттни.
Результаты. После соблюдения всех критериев включения, данные 164 пациенток подвергнуты дальнейшему анализу. Распределение в группах было однородным, различий по возрасту, индексу массы тела (ИМТ) и паритету кесарева сечения (операция по счету) не было.
Известно, что послеоперационную анальгезию можно признать удовлетворительной при уровне интенсивности боли по ВАШ не выше 40 мм [4].
При оценке эффективности традиционной системной схемы анальгезии, представленной в контрольной группе исследования, было показано, что количество пациенток, отмечающих интенсивность боли в покое 40 мм и выше составляет через 3 часа после операции 60%, через 6 часов – более 40%, через 9 и 12 – 25%, и только через сутки – не более 15% обследуемых респондентов.
При выполнении периферических регионарных блокад количество пациенток в соответствующей группе исследования, испытывающих боль интенсивностью 40 мм и выше снижается до 15-17% в , при этом, статистическую значимость снижения удалось показать по каждой методике регионарной анальгезии через 3 часа (в 5 раз – до 12%, р-χ2<0,0002) и 6 часов (в два раза – не более 15%, р-χ2<0,01) после операции. В последующем, с нарастанием мощности анальгезии количество родильниц, отмечающих высокий уровень боли в покое снижалось в контрольной группе, приближаясь к группам блокад (рис. 1).
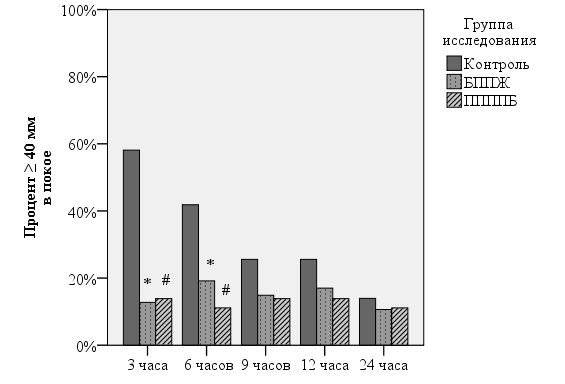
Рис. 1. Процент родильниц, испытывающих послеоперационную боль в покое интенсивностью 40 мм по ВАШ и выше. Здесь и на рис. 2 по оси ординат – процент от общей численности группы, абсцисс – этап исследования. * - р<0,05 группы «Контроль» и «БППЖ», # - р<0,05 группы «Контроль» и «ППППБ» (критерий χ2).
При оценке эффективности обезболивания при движении выявлено большое количество родильниц с неудовлетворительным контролем боли на фоне системной анальгезии. Так, уровень выше 40 мм в течение всех первых суток отмечали от 60 до 85% родильниц в зависимости от этапа исследования. Выполнение блокад передней брюшной стенки позволяет уверенно снизить количество родильниц с неудовлетворительным обезболиванием при движении на всех этапах исследования, причем эффективность этого снижения зависит от метода регионарной анальгезии (рис. 2).
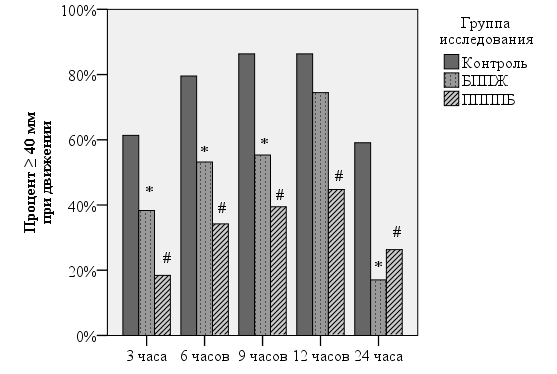
Рис. 2. Процент родильниц, испытывающих послеоперационную боль при движении интенсивностью 40 мм по ВАШ и выше.
Так, при выполнении БППЖ статистическая значимость показана вплоть до 9 послеоперационного часа, а при выполнении ППППБ – на протяжении всех 24 часов. Кроме того, величина, на которую снижается общее количество родильниц с неудовлетворительной анальгезией в группе «ППППБ» больше, чем в группе «БППЖ». Блокада поперечного пространства живота снижает количество пациенток с интенсивным болевым синдромом при движении примерно в полтора раза на протяжении первых 9 часов после операции со значением критерия р-χ2 от 0,01 до 0,04. Подвздошно-паховая/подвздошно-подчревная блокада позволяет сократить количество неудовлетворительно обезболенных при движении пациенток еще больше – в 2-3 раза в течение всех первых суток по сравнению с системной анальгезией (р-χ2 от 0,002 до 0,00000002). Через 24 часа после операции обе блокады показали сопоставимое снижение доли пациенток неудовлетворительным контролем болевого синдрома.
При анализе средних значений интенсивности боли была показана определенная анальгетическая эффективность изучаемых регионарных методик. Интенсивность боли в покое была ниже в группах блокад в течение всех первых суток (рис. 3).
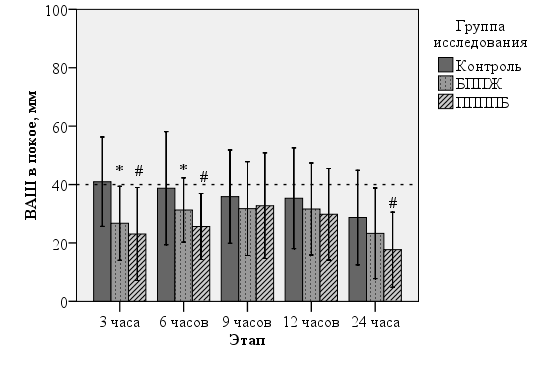
Рис. 3. Интенсивность боли в покое. Здесь и на рис. 4 по оси ординат – среднее значение в мм, абсцисс – этапы исследования. Столбики ошибок – стандартное отклонение. * - р<0,05 группы «Контроль» и «БППЖ», # - р<0,05 группы «Контроль» и «ППППБ» (t-критерий Стьюдента).
Статистическую значимость снижения интнсивности удалось показать на первом и втором этапах в обоих группах блокад, а также в группе ППППБ к концу первых послеоперационных суток. Через 3 часа после операции интенсивность боли в покое составила в контрольной группе 41±16 мм, выполнение блокад позволило снизить выраженность болевого синдрома на 40%: в группе БППЖ до 26±13 мм, в группе ППППБ – 25±17 мм. Через 6 часов соответственно, контроль – 39±19, в группах блокад снижение на четверть: БППЖ – 30±12, ППППБ – 28±13 мм (р=0,001). Через 24 часа пациентки контрольной группы отмечали в среднем 29±16 мм по ВАШ, при выполнении блокад, интенсивность боли была ниже, со статистической значимостью в группе ППППБ – на треть – 20±14 мм. Разница на этапах 9 и 12 часов была статистически не значимой при данном дизайне исследования. Средние значения в группах контроль/БППЖ/ППППБ в данных контрольных точках соответственно (36±16)/(32±18)/(34±18) и (35±17)/(33±17)/(32±17) мм.
При изучении интенсивности боли в движении (рис. 4) было выявлено, что в контрольной группе удовлетворительного качества обезболивания движения на протяжении всех первых суток достичь так, и не удалось: средняя интенсивность составила через 3 часа 51±20 мм, через 6 часов 59±20 мм, через 9 – 56±18, 12 – 57±15 мм и через 24 – 43±18 мм.
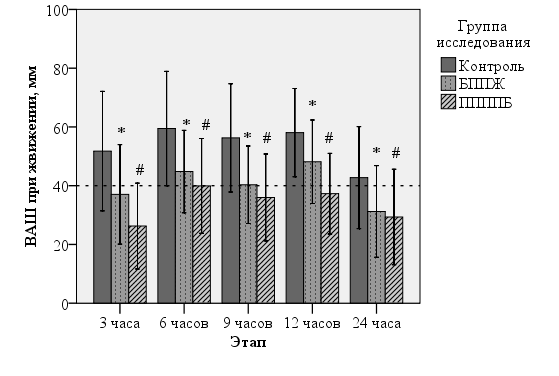
Рис. 4. Интенсивность боли при движении.
Выполнение блокад передней брюшной стенки позволяет со статистической значимостью снизить интенсивности боли в движении на протяжении всех первых суток.
Снижение потребности в наркотических анальгетиках при адекватном уровне обезболивания позволяет снизить такие их нежелательные эффекты как тошноту/рвоту и слабость/сонливость, которые часто становятся препятствием на пути активизации пациентки (табл. 1).
Таблица 1. Потребность в Трамадоле и некоторые возможные нежелательные его эффекты
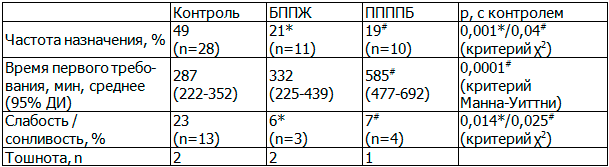
В контрольной группе введение трамадола потребовалось почти половине родильниц. Выполнение периферических блокад передней брюшной стенки позволяет со статистической значимостью снизить потребность в трамадоле более чем в два раза. При анализе времени требования опиоида, была выявлена тенденция к его увеличению в группе блокад. Статистический анализ не показал значимости увеличения времени требования трамадола в группе БППЖ. При выполнении же ППППБ, напротив, значимость двукратного увеличения времени требования трамадола подтверждена статистически. Избыточную седацию, проявляющуюся в виде жалоб на слабость/сонливость, принято считать неблагоприятными побочными эффектами опиоидов в послеоперационном периоде. В контрольной группе данные жалобы предъявляли в три раза больше родильниц, чем в группах блокад. При помощи таблиц сопряженности удалось показать статистическую значимость снижения частоты слабости/сонливости при выполнении регионарной анальгезии брюшной стенки после кесарева сечения. Тошноту отмечали в единичных случаях, в некоторых из них трамадол не назначался, поэтому оценить данную жалобу как проявление побочного действия опиоида, назначаемого внутримышечно, не представляется возможным.
Изучение функции внешнего дыхания как косвенного индикатора блокады боли при движении (табл. 2) выявило статистически значимую разницу между группами блокад и контролем в величине пиковой скорости выдоха через 6 часов после операции. Те пациентки, которым выполнялись регионарные блокады, показали более выраженную способность к формированию форсированного выдоха по отношению к группе с системной анальгезией.
При изучении внутригрупповой дисперсии данных пиковой объемной скорости выдоха показано статистически значимое двукратное снижение способности к формированию форсированного выдоха в контрольной группе.
Таблица 2. Значение пиковой объемной скорости выдоха (среднее±стандартное отклонение), л/мин
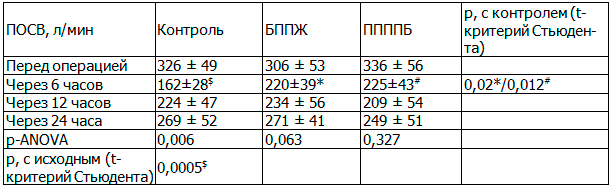
С развитием мощности системного обезболивания, к концу первых суток, данная способность восстанавливается практически до исходных значений. В группах блокад этапные различия значимыми не были.
Обсуждение. Проблема послеоперационного контроля боли в акушерстве, как показали результаты нашего исследования, по-прежнему, актуальна. Дополнительное применение методов местной анестезии может позволить обеспечить эффективный контроль послеоперационной боли при значительном снижении потребности в опиоидах. В свете концепции ранней ускоренной реабилитации, послеоперационная регионарная анальгезия не должна сопровождаться моторным блоком конечностей и гемодинамическими эффектами, способными повлиять на активизацию пациента. В этом отношении применение продленной эпидуральной анальгезии после кесарева сечения не всегда гарантирует такие условия [12]. Воздействие на соматическую ноцицепцию методами периферической регионарной анальгезии передней брюшной стенки, с одной стороны должно внести существенный вклад в снижение интенсивности болевого синдрома после кесарева сечения, а с другой – не оказать существенного влияния на возможность мобилизации родильницы. Результаты, полученные при изучении анальгетической эффективности блокад передней брюшной стенки после оперативного родоразрешения, действительно, свидетельствуют о наличии определенного вклада каждой из двух представленных методик в достижение успешного контроля болевого синдрома. Для борьбы с «фоновой» болью в покое этот вклад не столь очевиден. Напротив, в движении методики регионарной анальгезии эффективно справляются с усилением боли при активизации, удерживая уровень ее интенсивности в умеренных значениях.
Улучшение качества обезболивания по субъективному мнению пациенток, осуществлялось на фоне объективного снижения потребности в опиоидах и увеличения времени их первого требования. Закономерно в группах блокад снижается и частота предъявления жалоб на слабость/сонливость. С одной стороны – это следствие сокращения потребности в опиоиде, с другой, вероятно, следствие меньшего «утомления» существующей болью. По крайней мере, чувство слабости отмечали некоторые пациентки и не получавшие трамадол.
Исследование функции внешнего дыхания в последнее время все чаще используется при оценке послеоперационного болевого синдрома [3, 6]. При доношенной беременности функционирование респираторной системы изменяется по сравнению с «небеременным» уровнем. Эти изменения в основном касаются «объемных» показателей (дыхательный объем, функциональная остаточная емкость легких, минутная вентиляция и т.д.) и не затрагивают «скоростные» (объем форсированного выдоха за первую секунду, форсированная жизненная емкость легких и т.д.) [9]. Сравнение последних до и после родоразрешения можно считать корректным, а их изменения – в большей степени связанными с течением послеоперационного периода. Анализ полученных данных пиковой скорости выдоха показал, что в контрольной группе этот показатель снижался вдвое по сравнению с исходным через 6 часов после операции, что соответствует времени максимальной интенсивности боли при движении в этой группе пациенток. В группах, где выполнялись блокады, на фоне удовлетворительной степени контроля боли при движении, была показана относительная стабильность способности к формированию форсированного выдоха на протяжении всех первых суток после операции.
Заключение. Добиться удовлетворительного обезболивания после оперативного родоразрешения при помощи системной анальгезии «нестероидное противовоспалительное средство (НПВС) + парацетамол ± опиоид» не удается. Регионарная анальгезия передней брюшной стенки, выполненная в дополнение, позволяет уверенно контролировать болевой синдром при движении пациентки. Кроме того, снижается потребность в опиоидах и частота их вероятных нежелательных эффектов. Таким образом, можно сказать, что периферическая регионарная анальгезия передней брюшной стенки создает условия для комфортной ранней активизации родильницы после кесарева сечения, что в свою очередь способствует тесному раннему контакту с новорожденным и более физиологичному течению послеродового периода, как для матери, так и для ребенка.
