Заболевания роговицы в структуре глазной патологии составляют около 35% [2] и являются серьезной социальной проблемой, так как в основном поражают трудоспособное население, приводят к значительному временному или стойкому снижению остроты зрения вплоть до полной утраты зрительных функций и, следовательно, к затруднению социальной адаптации и резкому снижению качества жизни пациентов.
Среди воспалительных заболеваний переднего отрезка глаза особого внимания заслуживает язва роговицы, которая, не смотря на успехи современной офтальмологии, трудно поддается лечению и почти всегда приводит к значительному снижению остроты зрения. Распространенность гнойной язвы роговицы составляет 27,6% как первичная инфекция и 30,2% как вторичная [5].
Лечение гнойных язв роговицы остается одной из актуальных проблем современной офтальмологии, что объясняется сохранением высокой частоты данной патологии и особой тяжестью течения заболевания, приводящего к значительному снижению зрения, а нередко и к гибели глаза. [1, 3, 4, 6].
На первом этапе лечения язвы роговицы основным моментом является адекватная санация язвенного дефекта. В настоящее время офтальмологи располагают большим выбором средств борьбы с патогенной микрофлорой (бактериальной, грибковой, протозойной). Однако этиологический полиморфизм заболевания, развитие резистентности к применяемым медикаментозным препаратам вынуждают разрабатывать новые лекарственные средства, комбинировать их применение, разрабатывать новые пути введения препаратов. Одним из возможных способов санации язвенного дефекта роговицы является воздействие при помощи энергии различных физических факторов, например, лазеркоагуляции, криоапликации или диатермокоагуляции. В литературе имеется достаточно данные об эффективности коагуляции язв роговицы излучением лазеров среднего инфракрасного (ИК) диапазона. Барьер из лазерных коагулятов препятствовал прогрессированию края язвенного дефекта, при этом отмечалась хорошая дозируемость и безопасность лазерного излучения.
В репаративной фазе воспалительного процесса роговицы необходима стимуляция механизмов заживления и восстановления прозрачности. Несмотря на разнообразие консервативных методов лечения, проблема грубого рубцевания роговицы также остается актуальной и требует дальнейшей разработки эффективных методов лечения, влияющих на процессы заживления, способствующих формированию нежного рубца и высоких функциональных результатов. К таким методам принадлежат технологии, использующие низкоинтенсивное лазерное излучение, обладающее высокой биологической активностью.
На сегодняшний день, несомненно, офтальмология добилась определенных успехов в лечении язвы роговицы, имеется большой выбор лекарственных средств и методов консервативного лечения. Лазерная терапия используется на всех этапах воспалительного процесса, выпускаются новые лазерные аппараты, которые вносят свой вклад в оптимизацию лечения язвенных кератитов.
Учитывая все вышеизложенное, было решено изучить воздействие экспериментального лазерного коагулятора с длиной волны 1,44 мкм при различных энергетических параметрах прибора на роговицу, выбрать оптимальные соотношения мощности излучения и длительности импульса с учетом безопасности применения и апробировать использование лазера в лечении язвы роговицы для коагуляции язвенного дефекта и последующей стимуляции заживления в эксперименте и клинической практике.
Конкретной целью описываемого в данной статье этапа исследования было определить характер воздействия лазерного излучения длиной волны 1,44 мкм при различных энергетических параметрах на интактную роговицу лабораторного животного (кролика).
В исследовании используется экспериментальная модель лазерного коагулятора на основе полупроводникового лазера с волоконным выводом излучения с длинной волны 1,44 мкм, разработанная в Институте общей физики им. А.М.Прохорова АН РФ (рис. 1).

Рис. 1. Экспериментальный лазерный коагулятор с длинной волны 1,44 мкм.
Эксперимент проводили на 6 глазах кроликов породы Schinschilla массой 1,5-2,0 кг. После трехкратной инстилляции раствора Инокаина проводили однократное облучение центральной зоны роговицы в импульсном режиме с заданными значениями мощности и длительности излучения на расстоянии 1 мм от поверхности роговицы (рис.2).
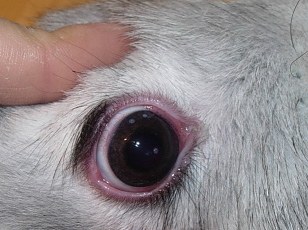
Рис. 2. Лазерные коагуляты на поверхности роговицы кролика.
Для стандартизации расстояния применяли специальный силиконовый ограничитель, надеваемый на наконечник волокна (рис. 3).
Использовали два режима энергетических параметров: мощность лазерного излучения 150 мВт с длительностью импульса 1.3 сек и мощность 270 мВт с длительностью импульса 0.95 сек. Соответственно, доза облучения в эксперименте варьировалась 195 или 256,5 мДж. Выбор энергетических параметров лазерного излучения производился на основании результатов предыдущего исследования in vitro на роговице изолированного бычьего глаза. Соответственно с используемыми энергетическими параметрами сформировали 2 группы наблюдения. Животных первой группы выводили из опыта на 1, 7 и 16 день после лазерной коагуляции роговицы, второй группы - на 1, 5, 9 сутки. Проводили морфологическое исследование роговицы, фоторегистрацию и морфометрический анализ изображений. Оценивали глубину поглощения, характер и степень повреждения роговицы в очаге воздействия и пограничных участках. Также исследовали соматическое состояние животных и офтальмологический статус. Облучение роговицы кроликов обеих групп не приводило к каким-либо изменениям в их поведении. Динамика частоты дыхания и сердечных сокращений до и после облучения менялась статистически незначительно.
В офтальмологической картине до облучения кроликов не выявили каких-либо изменений со стороны органа зрения. После облучения на всем сроке наблюдения за животными только у одного кролика (16,7%) на следующие сутки после лазерной коагуляции появилась умеренно выраженная поверхностная инъекция конъюнктивы (рис.4), которая самостоятельно купировалась в течение следующих суток. В остальных случаях (83,3%) каких-либо изменений со стороны конъюнктивы, радужки, оптических сред, глазного дна в течение всего срока наблюдения выявлено не было.
 |
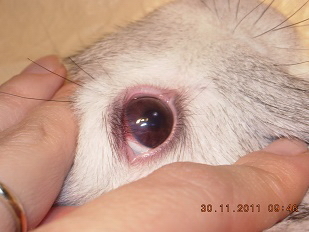 |
| Рис.3. Силиконовый ограничитель на волоконном наконечнике. | Рис. 4. Инъекция конъюнктивы через сутки после лазерной коагуляции. |
Внутриглазное давление измеряли перед лазерной коагуляцией. Среднее значение ВГД при тонометрии по Маклакову грузиком массой 10 грамм составило 19,3±0,42 мм рт. ст. Сразу после воздействия лазерным излучением на роговицу кроликов измерение внутриглазного давления тонометром Маклакова не проводили, чтобы исключить какие-либо дополнительные факторы воздействия на роговицу, кроме лазерной коагуляции. Внутриглазное давление измерялось пальпаторно через 10 и 60 мин после коагуляции и оставалось нормальным в течение следующих трех суток. Внутриглазное давление на 4 сутки после проведения лазерной коагуляции роговицы статистически не отличалось от исходных значений.
Результаты гистологических исследований: в первой группе наблюдения (мощность лазерного излучения 250 мВт и длительность импульса 2.9 сек) через сутки после лазерной коагуляции в строме роговицы наблюдали очаг коагуляционного некроза в виде обратного конуса, доходящий до глубоких стромальных слоев, основанием 740,6 мкм и глубиной 412,6 мкм. В очаге воздействия происходила денатурация стромальных волокон. Ядра кератоцитов были сохранены, находились в состоянии пикноза, что говорит об отсутствии карбонизации. Имелась также переходная зона реактивных изменений стромы с нарушенной архитектоникой коллагеновых пластин обратимого характера. Эпителий в очаге воздействия неравномерной толщины, клетки в состоянии пикноза, вакуолизация цитолазмы (рис. 5).
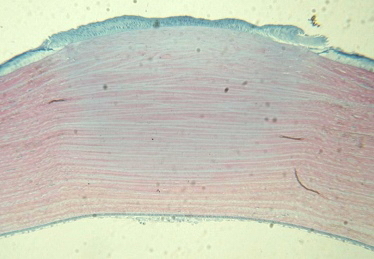
Рис. 5. 1-е сутки после лазерной коагуляции. Неравномерное утолщение эпителия в очаге лазерного воздействия. В строме очаг коагуляционного некроза в виде обратного конуса. Здесь и на рис. 6-11 полутонкий срез, полихромное окрашивание. Ув.125.
Десцеметова мембрана интактна на всем протяжении. В проекции излучения на протяжении меньшем, чем вершина конуса наблюдали признаки дезорганизации эндотелия: клетки увеличены в размере за счет отека, изменены промежутки между клетками, часть ядер в состоянии пикноза, по площади диаметром 417,7 мкм (рис. 6).

Рис. 6. 1-е сутки после лазерной коагуляции. Интактная десцеметова мембрана. Отечность эндотелиальных клеток, часть ядер в состоянии пикноза. Ув. 250.
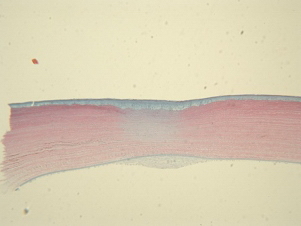
На 7 сутки после лазерной коагуляции наблюдали следующую морфологическую картину: строма роговицы сжата в виде песочных часов, увеличение активности кератоцитов - пролиферация и синтез. Уменьшение толщины стромы компенсаторно восполняется за счет гиперплазированного переднего эпителия и сформировавшейся ретрокорнеальной мембраны веретеновидной формы из фиброцеллюлрных компонентов без сосудов. Размеры мембраны - основание 502,5 мкм и выстояние 71,4 мкм (рис.7).
На 16 сутки после лазерной коагуляции сохраняется конфигурация роговицы в виде сглаженных песочных часов. Строма имеет дефект в передней трети, заполненный гиперплазированным эпителием, и менее выраженный дефект в задней трети, частично восполненный небольшой ретрокорнеальной мембраной, с основанием 478,2 мкм и выстоянием 63,8 мкм, которая большей частью покрыта слегка измененным эндотелием. Наблюдается пролиферация кератоцитов, признаков некроза нет (рис. 8).
 |
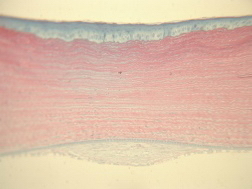 |
| Рис. 7. 7-е сутки после лазерной коагуляции. Строма роговицы в форме песочных часов. Гиперплазия переднего эпителия. Ретрокорнеальная мембрана. Ув. 125. | Рис. 8. 16-е сутки после лазерной коагуляции. Дефект передней трети стромы, заполненный гиперплазированным эпителием. Пролиферация кератоцитов. Небольшая ретрокорнеальная мембрана, слегка измененный эндотелий. Ув. 125. |
Таким образом, при воздействии экспериментальным лазерным коагулятором при мощности 250 мВт и длительность импульса 2.9 сек произошла денатурация стромальной ткани, ее контракция и постепенное замещение новыми компонентами (пролиферация кератоцитов, гиперплазия эпителия, ретрокорнеальная мембрана) для воссоздания прежней архитектоники стромы.
Во второй группе наблюдения (мощность лазерного излучения 150 мВт, 1,3 сек и длительность импульса 1,3 сек) через сутки после лазерной коагуляции в верхней трети стромы наблюдали очаг воздействия в виде неправильной пирамиды с пологим куполом, с основанием 149,3 мкм и глубиной 52,9 мкм. В очаге воздействия кератоциты отечны, сохраняют жизнеспособность. Эпителий в зоне воздействия в состоянии, близком к коагуляционному некрозу (рис. 9).
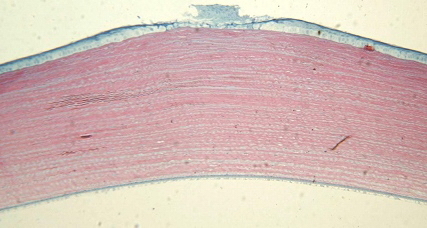
Рис. 9. 1-е сутки после лазерной коагуляции. Коагуляционный некроз эпителия. Кератоциты отечны, жизнеспособны. Ув. 125.
Отдельные эндотелиальные клетки увеличены за счет отека, грубых изменений эндотелия нет (рис. 10).
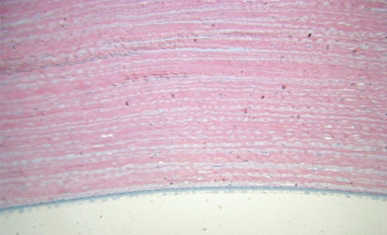
Рис. 10. 1-е сутки после лазерной коагуляции. Отечность отдельных эндотелиальных клеток. Ув. 250.
К 9 суткам после лазерной коагуляции наблюдали утолщение передних слоев эпителия в виде фасетки. В строме в проекции очага воздействия пролиферация кератоцитов в зоне, где было максимальное повреждение лазерным излучением. Средние и глубокие слои стромы практически не изменены. В десцеметовой мембране небольшой дефект, который послужил входными воротами для миграции кератоцитов, сформировавших нежную ретрокорнеальную мембрану с основанием 143 мкм и выстоянием 26,7 мкм. Мембрана полностью покрыта неизменными эндотелиальными клетками, а отсутствие гидратации задних слоев стромы свидетельствует о сохранении барьерных свойств эндотелия (рис. 11).

Рис. 11. 9-е сутки после лазерной коагуляции. Утолщение передних слоев эпителия. Пролиферация кератоцитов в зоне воздействия. Дефект десцеметовой мембраны. Ретрокорнеальная мембрана, покрытая неизмененными эндотелиальными клетками. Ув. 250.
Таким образом, имеющийся диапазон энергетических параметров прибора является достаточным для дозированного воздействия на роговицу и безопасного для других структур глаза. Морфологическая картина роговицы через различные сроки после лазерной коагуляции подтверждает возможность применения данного лазера как с коагуляционной, так и с терапевтической (стимуляция пролиферации кератоцитов) целью. При этом лазерное воздействие не оказывает влияния на общее состояние животных.
