Актуальность
Концепция скрининга в здравоохранении, то есть активного выявления болезни или предболезненного состояния у лиц, считающихся или cчитающих себя здоровыми, в течение XX в. быстро распространилась и в настоящее время широко принята в большинстве развитых стран. При правильном использовании скрининг может быть действенным инструментом в профилактике заболеваний. Однако необходимо соблюдать устоявшиеся принципы и критерии и препятствовать внедрению практики проведения скрининга, которая не соответствует этим требованиям [19]. Согласно второму докладу Национального комитета по скринингу Соединенного Королевства (2007 г.) скрининг – это услуга в области здравоохранения, состоящая в том, что представителям конкретной популяции, которые не обязательно понимают, что они подвержены риску заболевания или уже страдают болезнью либо ее осложнениями, задаются вопросы или предлагается тест для выявления лиц, которым с большей вероятностью будет оказана помощь, а не причинен вред, дальнейшими тестами или лечением с целью снижения риска заболевания или его осложнений [10]. Преимущества скрининга полностью описаны в течение многих лет: ранняя диагностика и вмешательство приведут к улучшению прогноза у некоторых пациентов; лечение на этой стадии может быть менее радикальным, удастся сэкономить скудные ресурсы служб здравоохранения, а лица с истинно отрицательными результатами теста будут успокоены [7]. Наиболее подходящей формой скрининга следует считать систему регулярного надзора и выявление случаев заболевания в системе первичной медико-санитарной помощи. Несколько простых тестов, таких, как выявление нарушений зрения, могут внести значительные изменения в комфорт и качество жизни [19].
Анализируя данные многоцентровых рандомизированных исследований, можно сделать вывод о вовлечении в обследование так называемых «активных» пациентов. Эти пациенты не только осведомлены о своем заболевании, но и регулярно посещают офтальмолога, проходят диагностическое обследование, выполняют рекомендации врача и следуют его назначениям. В то же время имеется большая группа людей, имеющих скрытую патологию органа зрения, которые никогда не придут к врачу или обратятся с терминальными стадиями заболевания. Таким образом, целью скрининга является выявление так называемых «неактивных», инертных пациентов и, при наличии соответствующих клинических данных, разработка алгоритма диагностики и лечения. В рамках проекта «Предвидеть – значит видеть» ГБОУ ВПО «ВГМА им. Н.Н. Бурденко» Минздрава России и студенческого волонтерского объединения «Млечный путь» анализировались данные пациентов, которые прошли скрининговое обследование в Центре Галереи Чижова, г. Воронеж, на предмет выявления основных офтальмологических заболеваний: возрастной макулярной дегенерации (ВМД) и глаукомы. Основной контингент обследованных составили лица старше 40 лет.
Старение населения – одна из доминирующих тенденций XXI века. По последним данным Организации объединенных наций к 2012 году число пожилых людей выросло почти до 810 млн человек и всего через 10 лет превысит 1 млрд. человек, т.е. увеличится за десятилетие почти на 200 млн. человек. Один из мощнейших факторов, сопровождающих демографические изменения, – это снижение функциональных возможностей органа зрения [8]. По оценкам специалистов в мире насчитывается 285 млн. слабовидящих и 39 млн. слепых, лица старше 50 лет и старше составляют 56% и 82% соответственно [17]. В развитых странах основной причиной слепоты и инвалидности является возрастная макулярная дегенерация. В России заболеваемость ВМД составляет 15 случаев на 1000 населения [1] и неуклонно растет. В структуре первичной инвалидности по ВМД больные в трудоспособном возрасте составляют 21%, а в пенсионном возрасте – 32% [2]. Общая поражённость населения имеет прямую зависимость от возраста и составляет 10% в 40 лет, 15% в 65-74 года, 25% в 75-84 года, 30% в 85 лет и старше [3]. «Влажная» форма ВМД встречается в 10-15% случаев, но в 90% случаев она становится причиной резкой потери центрального зрения вследствие тяжелых экссудативных и геморрагических изменений на глазном дне [13].
Не менее актуальным является раннее выявление глаукомы, которая вызывает необратимое повреждение не только зрительного нерва, но и сетчатки [6]. По данным Российской межрегиональной ассоциации офтальмологов (2006), в России насчитывается более 850 тысяч больных глаукомой. Заболеваемость составляет 1 на 1000 населения в год. Пораженность населения с возрастом увеличивается: 0,1% больных глаукомой выявлено в возрасте 40-49 лет, 2,8% - в возрасте 60-69 лет, 14,3% - в возрасте старше 80 лет. Более 15% общего количества слепых потеряли зрение от глаукомы [5]. Ранняя (своевременная) диагностика имеет целью выявление глаукомы до развития атрофических процессов в диске зрительного нерва, слое нервных волокон сетчатки и появления типичных дефектов в поле зрения. Постановка диагноза глаукомы на начальной стадии должна базироваться на данных диагностических методик с учетом асимметричного характера клинических и морфофункциональных характеристик парных глаз и факторов риска развития заболевания [4].
Для выявления функциональных изменений макулярной зоны сетчатки врачами и пациентами традиционно используется наиболее простой и доступный метод - тест Амслера. Перед офтальмологом обычно ставится вопрос стадии изменений макулярной зоны для возможного применения лечебных воздействий. Именно для этой цели может быть использован 3D-компьютерный пороговый тест Амслера (3D-Computer threshold Amsler test, 3D-CTAG) [9]. 3D-CTAG позволяет выявить нарушения функции макулы в большем проценте случаев, чем стандартный тест Амслера, дает возможность количественно оценить зрительные расстройства и проследить динамику изменений дефектов поля зрения у одного и того же пациента [9, 11, 15, 18]. Причем, 3D-CTAG хорошо коррелирует со структурными изменениями в макуле. Время выполнения теста 4-5 минут для одного глаза [15]. Проведенные ранее исследования C. Robison, R. Jivrajka и др. выявили, что с помощью теста 3D-CTAG можно дифференцировать сухую и влажную форму макулярной дегенерации [16].
Исследования цветоощущения и контрастной чувствительности в большинстве случаев основывается на применении пороговых таблиц или цветовых маркеров на периметре Фестера. Данные тесты используются для выявления лишь грубых нарушений цветоощущения и имеют ряд существенных недостатков: выцветание таблиц, дряхление страниц, перелистываемых многократно при контрольном тестировании, возможность запоминания фигур и тестов, длительность исследования, плохая цветовая печать, необходимость тиражирования таблиц, интегральный показатель нарушения цветоощущения, не имеющий количественной оценки, отсутствие возможности дифференциации и уточнения характера нарушения цветоощущения. И самое главное - невозможность уловить цветослабость - тонкие нарушения цветоощущения. Наибольшее распространение и признание в диагностике приобретенных нарушений цветового зрения получили панельные тесты, созданные на основе стандартного "атласа цветов" Munsell – Farnsworth-Munsell Dichotomous D15 (FM D15) и Farnsworth-Munsell 100 Hue Test (FM100). Использование данных тестов представляет собой простой метод для проверки цветового зрения. Полученные в результате исследования данные могут быть применены для ранней диагностики многих заболеваний органа зрения, а также с целью оптимизации терапии и оценки ее эффективности. Отличительной особенностью FM 100 является выявление пороговых изменений цветовосприятия у лиц с функциональной и органической патологией световоспринимающего аппарата глаза, а именно сетчатки и зрительного нерва [12,14,20]. Тест Фарнсворта-Манселла с использованием 100 тест-объектов является наиболее оптимальным для изучения способности к различению цветов, однако, ввиду длительности его в условиях массового скрининга более целесообразно использование сокращенного теста FM D15.
Цель. Раннее выявление возрастной макулярной дегенерации и глаукомы.
Материал и методы. Анкетирование проводилось с использованием специально подготовленного для скрининга опросника (табл. 1).
Таблица 1. Анкета участника скрининга в проекте «предвидеть – значит видеть»
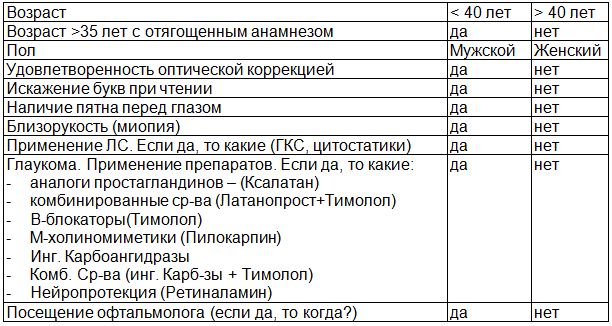
Функциональные тесты включали исследование цветовосприятия с помощью теста Манселла (Farnsworth-Munsell Dichotomous D15 и Farnsworth-Munsell 100 Hue Test), тест Амслера, 3D-CTAG метод (см. табл. 2).
Критериями теста Манселла (Farnsworth-Munsell 100 Hue Test) являлись следующие показатели цветоощущения, установленные с помощью FM 100: цветовой тест ЦТ (единица измерения: Total Error Score TES), уровень распознавания цветов, дефицит цветового зрения, тип цветового дефицита ТЦД.
Также проводился 3D-компьютерный тест Амслера. С помощью 3D-CTAG теста с использованием сенсорного дисплея iPad 3 (диаголь 9,8 дюймов) При этом дефекты в центральной области поля зрения (21×33°) оцениваются количественно на пяти индивидуально выбранных уровнях контрастности при непосредственном взаимодействии пациента с сенсорным дисплеем. Для проведения теста используется необходимая коррекция для близи. Объем неувиденных ячеек зависит не только от размера скотом на разных уровнях контрастности, но и от выбираемого пациентом нулевого уровня, что отражает степень уменьшения холма зрения.
Критерии 3D-CTAG для оценки состояния центральных отделов сетчатки: количество выявленных дефектов; абсолютная величина объема потери поля зрения, [deg^2 %]; отношение объема потери поля зрения к холму видения, % of 69300.00 [deg^2 %]; нулевой уровень контрастности; итоговая потерянная площадь, %, - отношение площади скотомы на наивысшем уровне контрастности к площади скотомы на низшем уровне контрастности, умноженное на фактическую глубину скотомы; итоговая сохраненная площадь, %, - отношение площади сохраненного поля зрения на наивысшем уровне контрастности к площади сохраненного поля зрения на низшем уровне контрастности, умноженное на фактическую глубину скотомы.
Бесконтактная тонометрия выполнялась с помощью пневмотонометра Reichert 7. Норма P0=10-21 мм рт. мт. Также проводилась прямая офтальмоскопия с использованием офтальмоскопа Heine beta 200S и непрямая офтальмоскопия с помощью зеркального офтальмоскопа ОЗ-5.
Результаты и обсуждение.
Во время скрининга обследовано 86 человек от 7 до 87 лет, средний возраст составил 58 лет. Из них до 40 лет – 12 человек (14%); старше 40 лет – 74 человека (86%); 83% (71 человек) - женщины; 17% (15 человек) - мужчины. Результаты скрининга показали, что женщины более активно интересуются вопросами своего здоровья, чем мужчины.
Контингент обследованного населения включал лиц, которые подлежат обследованию на глаукому в возрасте старше 40 лет и лиц старше 35 лет, имеющих факторы риска развития глаукомы: родственников, страдающих глаукомой, миопией свыше 4,0 D, общей патологией – сахарным диабетом, заболеваниями щитовидной железы, системной гипотензией, аутоиммунными заболеваниями. Актуальность проведенного скрининга подтверждается необходимостью обследования группы риска не менее 1 раза в год [6].
По данным анкетирования 87% (75 человек) пользуются очками и только 20% (15 из 75 человек) удовлетворены своей оптической коррекцией. Неудовлетворенность оптической коррекцией может быть первым признаком асимметрии клинических проявлений между парными глазами при глаукоме или следствием большего искажения текста в глазу со значительными изменениями макулярной области сетчатки (ВМД), при этом 36% (31 человек) отмечают искажение букв при чтении; 18% (17 человек) - появление пятна перед глазом.
Среди опрошенных были лица с уже установленной патологией органа зрения: 28% (24 человека) страдают близорукостью, 1 человек возрастной макулярной дегенерацией, 6 человек - глаукомой, 4 из них применяют один препарат из группы β-адреноблокаторов; 1 – α-адреномиметик; 1 – использует 2 препарата (β-блокатор и ингибитор карбоангидразы).
- опрошенных (20%) никогда не были на приеме у офтальмолога, из остальных 69 (80%) человек 29 (42%) проходили обследование более 1 года назад (от 1 до 20 лет).
Таблица 2. Результаты обследования
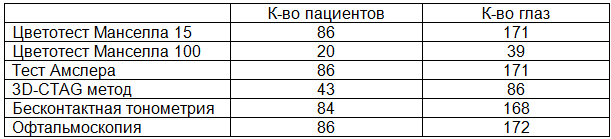
По результатам диагностических тестов (табл. 2) у 22% (19 человек) испытуемых патологии не обнаружено. При этом у 6 из них имелись жалобы на искажение линий при чтении, что можно объяснить недостаточной оптической коррекцией для близи.
Цветотест Farnsworth-Munsell Dichotomous D15 был проведен 86 испытуемым (171 глаз), из которых 20 (23%) выполнили тест безошибочно. У 66 (77%) определялись нарушения восприятия цветов, преимущественно на синий и зеленый оттенки. Farnsworht-Munsell 100 Hue Test выполнили 20 (23%) человек (39 глаз). У 3 человек (6 глаз), из них 2 женщины и 1 мужчина, был выявлен средний уровень распознавания цветов и дефицит цветовосприятия легкой степени, общее количество ошибок (Total Error Score, TES) не более 100, что является вариантом нормы для 68% населения. У 7 человек (14 глаз), 6 женщин и 1 мужчина, – низкий уровень распознавания цветов и дефицит цветовосприятия средней степени, TES = 101 – 200, что соответствует слабости цветовосприятия, но еще не является цветоаномалией. При выполнении теста у 10 человек (19 глаз), 8 женщин и 2 мужчины, выявлен низкий уровень распознавания цветов и тяжелый дефицит цветовосприятия, TES = 201 и более, что может быть связано с органической патологией сетчатки и зрительного нерва. Кроме того, наименьшее количество ошибок и, следовательно, более высокий уровень цветовосприятия были отмечены у лиц моложе 40 лет.
При проведении теста Амслера изменения определились у 7 (8,1 %) обследуемых; у 80 (92,5%) патологии не обнаружено.
3D-CTAG метод выполнен у 43 человек на 86 глазах. На выполнение теста в среднем приходилось по 5 минут на каждый глаз, в первую очередь 3D-CTAG выполнялся лицам, показавшим дефекты при проведении бумажного варианта теста Амслера. У 8 человек (18,6%) на 15 глазах функциональных изменений макулы не зарегистрировано. Дефекты поля зрения выявлены у 11 человек (25,5%) на 14 глазах (16,2%). Из них у 5 человек (11,6%) на 5 глазах имеются центральные скотомы, у 6 человек (13,9%) на 9 глазах сужение полей зрения с периферии, причем у 3 человек с сужением поля зрения (на 3 глазах) на момент осмотра уже был поставлен диагноз глаукома. Появление центральных скотом – признак макулопатии или оптической нейропатии, которые можно подтвердить с помощью офтальмоскопии. Кроме того, у 24 человек (55,8%) дефектов в центральном поле зрения нет, но отмечено увеличение значения нулевого уровня контрастности. У 12 человек (27,9%) нулевой уровень контрастности был увеличен незначительно – от 4 до 9%, что может быть следствием снижения остроты зрения в результате нарушения прозрачности оптических сред. У второй половины обследованных, увеличение нулевого уровня было 10% и более, что свидетельствует о дисфункции макулярной области сетчатки, а значит, эти лица попадают в группу риска ВМД и требуют дальнейшего обследования.
По результатам офтальмоскопии у 12 человек (27,9%) определялась сглаженность макулярного рефлекса и мелкие твердые друзы в макулярной области, то есть начальные признаки возрастной макулярной дегенерации. Этим структурным изменениям соответствовали функциональные нарушения в виде увеличения значения нулевого уровня контраста на 3D-CTAG. У 1 больной ВМД на правом глазу темно-серый дистрофический очаг со светлым контуром диаметром 2 ДЗН, на левом – светлый дистрофический очаг диаметром 1 ДЗН. При этом при проведении 3D-CTAG на правом глазу определяется увеличение значения нулевого уровня контрастности до 22% и центральная скотома, затрагивающая все уровни контрастности, причем площадь дефекта на низких уровнях контрастности больше, чем на высоких, итоговая потерянная площадь меньше 100%, что является характерным признаком влажной формы ВМД [18]. На левом глазу имеется увеличение нулевого уровня контрастности до 41% и центральная скотома на низких уровнях контрастности, что характерно для сухой формы ВМД. Таким образом, у данной больной с помощью 3D-CTAG метода зарегистрированы признаки отека сетчатки на правом глазу, то есть состояния, требующего скорейшего медицинского вмешательства, в том числе с применением анти-VEGF препаратов, с целью сохранения зрительных функций. Еще у 4 человек с центральными дефектами поля зрения обнаружены дистрофические очаги в макулярной области без признаков транссудации.
Последующее обследование в условиях амбулаторного приема с использованием оптической когерентной томографии в качестве дополнительного метода подтвердило наличие сухой формы ВМД у 4-х пациентов с центральными дефектами поля зрения, а также у 5 пациентов с увеличенным нулевым уровнем контрастности по данным 3D-CTAG. Также диагностирована хориоидальная неоваскуляризация с признаками отека сетчатки на правом глазу и географическая атрофия на левом глазу больной ВМД с дефектами центрального зрения, характерными для влажной формы. Кроме того, у одной больной с повышенным нулевым уровнем контрастности, не имеющей центральных дефектов, на ОСТ диагностирована начальная стадия макулярного отека. Последним двум пациентам назначена противоотечная терапия ингибиторами карбоангидразы и нестероидными противовоспалительными средствами до решения вопроса о терапии анти-VEGF препаратами.
Полученные данные коррелируют с имеющимися в литературе сведениями о чувствительности и специфичности теста Амслера и 3D-CTAG. Так, бумажный тест Амслера выявляет дефекты поля зрения у 79% больных с влажной формой ВМД и в 26% - с сухой формой, тогда как 3D-CTAG в 100% и 41% случаев, соответственно [18].
Повышенное внутриглазное давление (выше 21 мм рт. ст.) определено в 7,1 % случаев (6 человек), из них только двое обследуемых знали о наличии у них глаукомы и использовали гипотензивный препарат (β-адреноблокатор). У этих пациентов выявлено повышение ВГД на одном глазу до 27 мм рт. ст., то есть в данном случае не достигнуто давление цели и требуется назначение второго препарата или переход на фиксированную комбинацию. Среди больных глаукомой у 1 больного на правом глазу диск зрительного нерва (ДЗН) серый, границы четкие, тотальная экскавация (острота зрения – proectio lucis certa, функциональные тесты на этом глазу не проводились), на левом, как и еще у 2-х больных (на 2-х глазах) – ДЗН сероват, границы четкие, краевая экскавация. Это соответствовало концентрическому сужению поля зрения при выполнении 3D-CTAG, низкому уровню распознавания цветов и тяжелому дефициту цветовосприятия, характерным для III стадии глаукомы. У 4-х больных (на 6 глазах) ДЗН бледноват, границы четкие, экскавация расширенная, при проведении 3D-CTAG дефектов поля зрения не выявлено, но отмечается увеличение нулевого контрастного уровня до 7-25% (среднее 11,67%), что встречается при I-II стадии глаукомы. Кроме того, 3D-CTAG позволяет выявить скотомы с височной стороны поля зрения, соответствующие расширению слепого пятна, аркуатные дефекты и назальную ступеньку [16], то есть изменения поля зрения, характерные для начальной и развитой стадии глаукомы, однако при проведении скрининга таких изменений не выявлено.
Больным с повышенным внутриглазным давлением впоследствии проведено детальное обследование, включающее тонометрию по Маклакову, компьютерную статическую периметрию, прямую и непрямую офтальмоскопию с целью выявления глаукомы. Данные пациенты в дальнейшем были обследованы в условиях амбулаторного приема, и им рекомендовано применение комбинированной терапии с использование аналогов простагландинов.
Обсуждение результатов и выводы
Таким образом, мы можем заключить, что проведенное скрининговое обследование населения в рамках проекта «Предвидеть – значит видеть» показало, что тест Манселла (Farnsworth-Munsell Dichotomous D15 и Farnsworth-Munsell 100 Hue Test) и 3D-CTAG метод являются достаточно простыми, неинвазивными методиками, которые могут применяться с целью скринингового обследования населения.
В итоге, признаки дисфункции макулярной области обнаружены у 17 человек (39,5% обследованных), повышенное внутриглазное давление – у 6 человек (7,1%). Таким образом, в результате скрининга были выявлены лица, относящиеся к группе риска развития возрастной макулярной дегенерации и глаукомы, а также с начальными стадиями развития этих заболеваний, которые получили рекомендации по образу жизни и были направлены в медицинские учреждения для дальнейшего обследования и своевременного проведения профилактических и лечебных мероприятий, позволяющих предупредить развитие и прогрессирование органических и функциональных нарушений сетчатки и зрительного нерва.
Выражаем благодарность заведующей кафедрой офтальмологии ГБОУ ВПО «ВГМА им. Н.Н.Бурденко» Министерства здравоохранения РФ, проф., д.м.н. Ковалевской Марии Александровне, аспиранту кафедры офтальмологии Туровец Е.К., а также студенческому волонтерскому движению «Млечный путь» в лице Шолоховой Ю.В., Фроловой А.И., Карповец Н.М., Голиковой В.А., Яковлевой А.А., Антонян В.Б., Рябининой В.В.
