Одну из лидирующих позиций среди причин слабовидения и слепоты занимают воспалительные заболевания роговицы и её травмы [1,2].
По данным Всемирной организации здравоохранения (ВОЗ) среди причин, приводящих к необратимой утрате зрения, слепота вследствие заболеваний роговицы занимает 4 место (5,1%) после катаракты (47,9%), глаукомы (12,3%) и возрастной макулярной дегенерации (ВМД) (8,7%) [4].
Течение гнойных кератитов и язвы роговицы на современном этапе приобретает более тяжелый, длительный характер в силу полиморфизма этиологических факторов и клинического течения и представляет большие трудности для эффективного лечения [3].
Не смотря на то, что в настоящее время имеется большой выбор лекарственных средств и методов консервативного лечения, развитие резистентности микроорганизмов к используемым препаратам и высокая частота развития осложнений обусловливают поиск и разработку новых методов лечения язв роговицы.
На кафедре глазных болезней РУДН совместно с Институтом общей физики им. А.М. Прохорова АН РФ в рамках инновационного образовательного проекта (ИОП) проводится изучение применения лазерного коагулятора ближней ИК области спектра 1,44 мкм для лечения язвы роговицы.
В исследовании используется экспериментальная модель лазерного коагулятора с длинной волны 1,44 мкм, разработанная в Институте общей физики им. А.М. Прохорова АН РФ. Эксперимент проводили на 22 глазах кроликов породы Schinschilla массой 1,5-3,0 кг. У всех животных была получена модель бактериальной язвы роговицы в центральной зоне (рис. 1).
Сформировали три группы наблюдения: I группа (8 глаз) – антибиотикотерапия + лазерная коагуляция язвенного дефекта; II группа (8 глаз) - антибиотикотерапия + лазерная коагуляция язвы + последующее лазерное облучение воспалительного очага; III группа (6 глаз) – контрольная – только антибиотикотерапия.
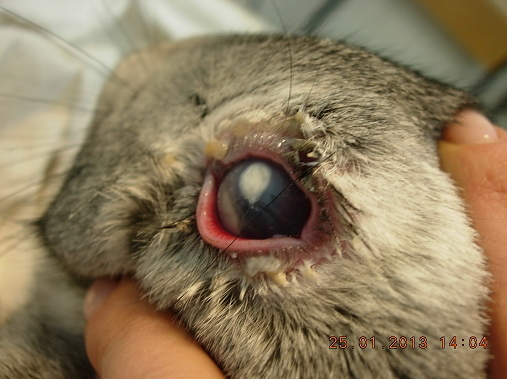
Рис. 1. Развитие воспалительного процесса в роговице лабораторного животного. Гипопион в передней камере.
На 4-е сутки в I и II группах проводили лазерную коагуляцию язвы. Во II группе, начиная с 5-х суток после инфицирования роговицы, в течение 4 дней ежедневно проводили низкодозированное лазерное облучение воспалительного очага с целью стимуляции процессов регенерации. Оценивали рост микроорганизмов по результатам посевов с центра язвенного дефекта на 3, 7 и 11 сутки от начала эксперимента в опытной группе I и группе контроля. Экспериментальных животных выводили из опыта на 14 сутки после проведения лазерной коагуляции. Проводили морфологическое исследование роговицы, фоторегистрацию и морфометрический анализ изображений.
Наблюдали следующие результаты: Смешанная инъекция в I группе сохранялась в среднем до 5±0,76 дней, во II группе в среднем исчезала на 4,25±0,71 сутки, в группе контроля сохранялась до 7,1±0,98 дней (α <0,05). Гнойно-слизистое отделяемое в I группе сохранялось в среднем до 4,38±1,03 дней, во II группе отделяемое сохранялось в среднем до 3,25±0,92 дней, тогда как в группе контроля до 6,0±0,89 дней (α <0,05). Средние сроки эпителизации роговицы после начала лечения в первой группе составили 6,25±0,92 суток, во второй группе 5,25±0,46 суток. В группе консервативного лечения явления эпителизация поверхностного дефекта происходила только на 9±1,26 сутки (α <0,05). Бактериологический контроль показал более высокую эффективность комбинации антибактериальной терапии и лазерной коагуляции язвенного дефекта. В I группе на 4 сутки после проведения лазерной коагуляции рост микроорганизмов определялся в 37,5%, в группе контроля в 67,7%, на 8 сутки после лазерной коагуляции в I группе рост отсутствовал во всех посевах, в контрольной группе сохранялся в 16,7%.
Результаты гистологического исследования: в группе контроля сохранялась картина диффузного кератита. В I группе (270 мВ, 0,95 сек) произошла заместительная гиперплазия эпителия, отсутствие послойной дифференцировки, выраженная контракция стромы. Язвенный дефект замещается рубцовой тканью. Задние слои стромы также сильно изменены. Эндотелий в области очага воздействия отсутствует, при этом в пограничной зоне на границе с соседними, неизмененными, участками эндотелий нормальный (рис. 2).
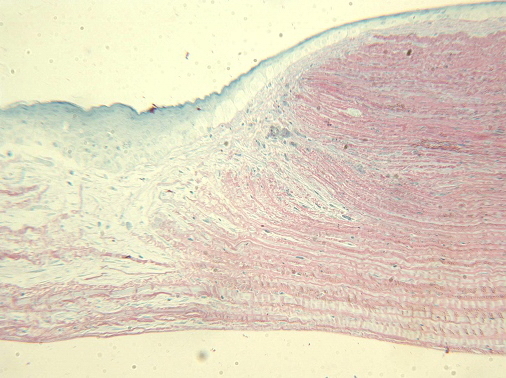
Рис. 2. Эпителий гиперплазирован, не дифференцирован послойно. Уменьшение толщины стромы в 2 – 2,5 раза. Язвенный дефект замещается рубцовой тканью. Эндотелий отсутствует. Ув. x125.
При коагуляции 250 мВт, 0,95 сек наблюдали сходную картину. При снижении дозы облучения морфологическая картина была более благоприятная. При мощности 270 мВт и длительности импульса 0,79 сек. наблюдали следующие изменения: эпителий гиперплазирован за счет слоя базальных клеток. Язвенный дефект занимает около ½ стромы. В центральной зоне происходит синтез новой стромальной ткани. Эндотелиальные летки умеренно отечны, сохранены. Очевидно, что лазерное излучение при вышеописанных энергетических параметрах оказывало сильное повреждающее воздействие, результатом которого стало выраженное уменьшение толщины роговицы в зоне воздействия и дефект эндотелия.
При снижении дозы облучения морфологическая картина была более благоприятная. При мощности 270 мВт и длительности импульса 0,79 сек, энергия излучения 231 мДж, наблюдали следующие изменения: эпителий над областью очага гиперплазирован за счет слоя базальных клеток. Язвенный дефект занимает около ½ стромы. Процесс регенерации завершен не до конца - на периферии очага визуализировался воспалительный инфильтрат с новообразованными сосудами. В центральной зоне воспаления практически не наблюдается, происходит синтез новой стромальной ткани в виде незрелой соединительной, волокна которой расположены хаотично - происходит замещение язвенного дефекта рубцовой тканью. Непосредственно под зоной воспаления эндотелиальные летки умеренно отечны, сохранены (рис. 3).
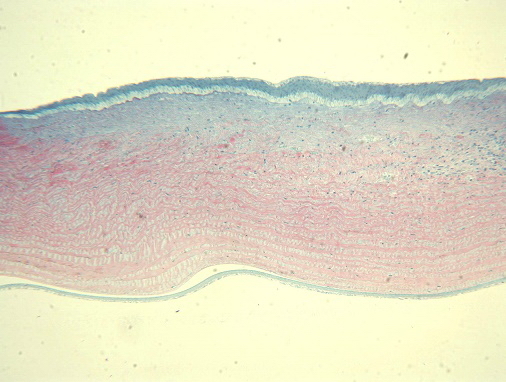
Рис. 3. Гиперплазия эпителия с правильной дифференцировкой. В центральной зоне незрелая соединительная ткань. На периферии очага воспалительный инфильтрат с новообразованными сосудами. Ув. x125.
При мощности лазерного излучения 250 мВт и длительности воздействия 0,79 сек, энергия излучения была минимальной и составляла 197 мДж. Наблюдали заместительную гиперплазию эпителия в области воспалительного очага, расположенного в 6-7 слоев и заполняющего язвенный дефект, отмечается умеренная дисплазия – базальные клетки еще не дифференцированы. Субэпителиально расположен слой молодой соединительной ткани, отличающейся по своему строению от глубжележащей неизмененной стромальной ткани (гиперцеллюлярен, больше плотность фибробластоподобных клеток). Язвенный дефект занимает 1/6 толщу стромы, воспалительных клеток не отмечается. Идет активная пролиферация соединительной ткани: кератобласты формируют пластины, параллельные основным пластинам стромы роговицы, но волокна незрелые, расположены более рыхло, с увеличенными промежутками. Таким образом, идет активное восполнение стромального дефекта. Глубжележащая строма не изменена. Эндотелий в зоне воздействия интактен (рис. 4).
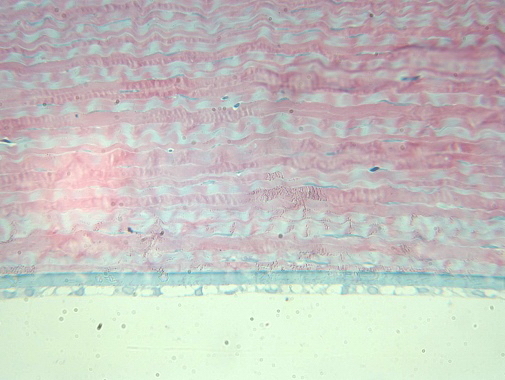
Рис.4. Неизмененный эндотелий в зоне воздействия. Ув. x250.
В II группе помимо лазерной коагуляции язвы проводили низкодозированное лазерное облучение воспалительного очага (150 мВт, 0,11 сек) ежедневно в течение 4 дней. При коагуляции (270 мВт, 0,95 сек) и последующим лазерном облучении наблюдали следующую морфологическую картину: эпителий в зоне воздействия расположен в 2-3 слоя. Рубцовая ткань, занимающая примерно ½ толщины стромы, контрактирует, придавая роговице конфигурацию в виде песочных часов. Визуализируются фибробластоподобные веретенообразные клетки и воспалительные клетки в небольшом количестве. Отмечается отечность задних слоев стромы, десквамация эндотелия. Имеется нежная ретрокорнеальная мембрана, образованная рубцово-измененной новообразованной субэпителиальной тканью (рис. 5).
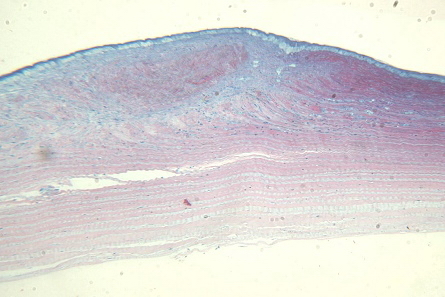
Рис. 5. Эпителий расположен в 2-3 слоя, гипертрофия базального слоя. Рубцовая ткань контрактирует, сближая соседние неизмененные участки. Задние слои стромы отечны. Эндотелий десквамирован. Ув. x125.
При коагуляции с мощностью 250 мВт и длительностью импульса 0,95 сек и последующим низкодозированным лазерным облучением отмечали неравномерность эпителия, субэпителиально отмечается усиленная пролиферация фибробластных клеток с формированием новой нежной рыхлой соединительной ткани с правильным ходом волокон, с хорошим прогнозом на заживление и оптические свойства. В средних слоях стромы сохраняется воспалительный инфильтрат с примесью фибробластоподобных клеток, формирующих правильную стромальную ткань. В проекции очага отмечается отслойка десцемтовой мембраны, а также разрежение плотности эндотелиальных клеток (рис. 6).
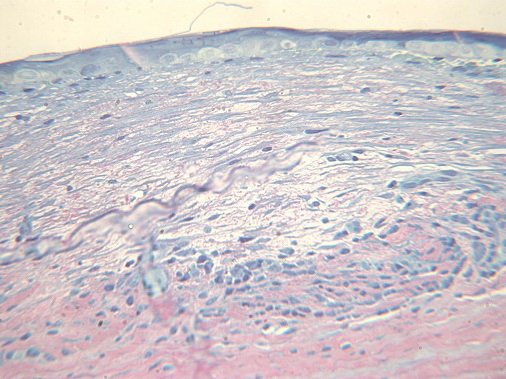
Рис. 6. Пролиферативная стадия воспаления - усиливается пролиферация фибробластных клеток с формированием новой рыхлой соединительной ткани. Ув. x600.
Описанные морфологические изменения подтверждают, что данные энергетические дозы обладают излишним повреждающим действием на роговицу: контракция стромы, отслойка десцеметовой мембраны, ретрокорнеальная мембрана, десквамация или отек эндотелия.
При мощности 270 мВт и длительности импульса 0,79 сек с последующим низкодозированным лазерным облучением в строме отмечали гиперцеллюлярность поверхностных слоев за счет фибробластоподобных клеток. Фибробласты параллельны поверхности роговицы, что свидетельствует о хорошем прогнозе на заживление и восстановление оптических свойств. Встречаются отдельные воспалительные клетки (рис. 7). Глубокие слои стромы не изменены. Десцеметова мембрана сохранна. Эндотелий не поврежден, однако отмечается небольшая разрыхленность эндотелиальных клеток.
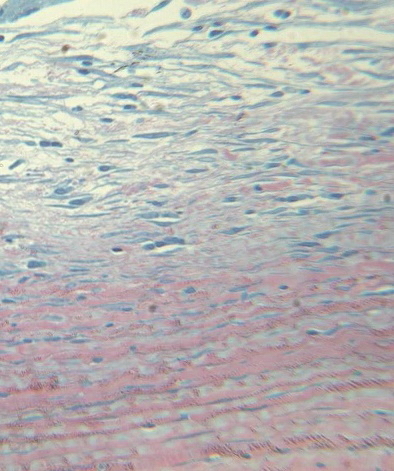
Рис. 7. Гиперцеллюлярность поверхностных слоев стромы за счет фибробластоподобных клеток. Фибробласты параллельны поверхности роговицы. Ув. x250.
При мощности лазерного излучения 250 мВт и длительности воздействия 0,79 сек и последующим низкоинтенсивным лазерным облучением в очаге эпителий сохранен, сохраняются незначительные признаки воспаления: отмечается умеренно выраженный воспалительный инфильтрат в строме, новообразованные сосуды, отмечается активная фиброплазия - формирование параллельно расположенных волокон стромальной ткани с благоприятным прогнозом на восстановление оптических свойств. Глубокие слои стромы не изменены. Децеметова мембрана нормальна. Эндотелий интатктен (рис. 8).
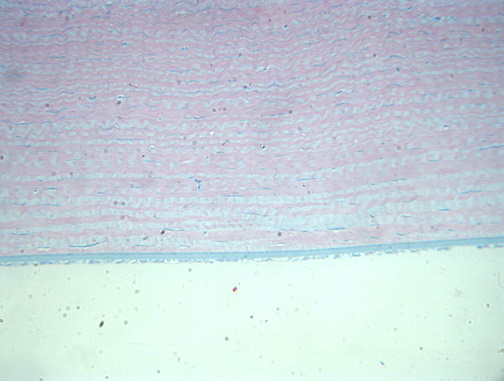
Рис. 8. Интактные глубокие слои стромы и эндотелий. Ув. x250.
Таким образом, применение коагуляции язвенного дефекта экспериментальным лазером с длиной волны 1,44 мкм в лечении язвы роговицы приводит к ускорению репаративных процессов, более быстрому купированию воспалительных явлений. При этом еще более эффективно проведение на втором этапе воспалительного процесса низкодозированного лазерного облучения. При сравнении опытных групп и группы контроля процесс заживления намного интенсивнее происходит в опытных группах, что можно объяснить лазерной коагуляцией язвы, позволяющей эффективно санировать очаг воспаления, ускорив тем самым наступление фазы пролиферации. Наиболее оптимальными параметрами для эффективной санации язвенного дефекта роговицы, не оказывающими повреждающего воздействия на глубжележащие структуры (десцеметова мембрана, эндотелий) являются: мощность излучения 250 мВт и длительность импульса 0,79 сек, энергия излучения 231 мДж. Cравнение результатов в опытных групп I и II позволяет сделать вывод, что после лазерной коагуляции язвы с последующем низкоинтенсивном лазерном облучении в течение нескольких дней с мощностью 150 мВт и длительностью импульса 0,11 сек. наблюдается формирование более нежной рубцовой ткани с параллельным ходом волокон, позволяющее предполагать на отдаленном сроке хорошие оптические свойства роговицы и высокие зрительные функции. Результаты проведенных исследований позволяют применить экспериментальный лазерный коагулятор с длиной волны 1,44 мкм в клинической практике для лечения язвы роговицы различной этиологии.
