Введение. С позиции современных представлений в развитии остеопороза и остеопенических состояний имеет значение нарушение внутрикостных механизмов ремоделирования под действием метаболических факторов, и, в первую очередь, расстройств кальций-фосфорного гомеостаза и маркеров ремоделирования костной ткани [1]. Однако, адекватная оценка этих показателей у детей разного возраста без учета критических периодов роста невозможна, так как именно в эти периоды могут наблюдаться наиболее значимые метаболические сдвиги в костной ткани. В этой связи, изучение показателей кальций-фосфорного обмена, кальций-регулирующих гормонов и маркеров ремоделирования костной ткани у здоровых детей разного возраста в сыворотке крови и моче является необходимым условием для понимания метаболических изменений, происходящих в костной ткани в периоды линейного роста скелета и накопления костной массы.
Материалы и методы. Биохимическое исследование показателей кальций-фосфорного обмена и маркеров костной резорбции и костеобразования проводили в сыворотке крови и моче у 86 здоровых детей и подростков. Минеральная плотность костной ткани оценивалась методом двухэнергетической рентгеновской абсорбциометрии с использованием остеоденситометра Hologic, DPX, Discovery-A, США, с применением детских программ. У всех обследованных оценивалась МПКТ поясничного отдела позвоночника (фронтальная проекция, L1-L4); проксимальных отделов бедренных костей (программа Dual Hip – оба бедра: по области шейки бедра – Neck, по области в целом – Total Hip); всего скелета (программа Whole Body: оценка скелета в целом – TOTAL и скелета без учета области головы - Subtotal). Уровень минерализации скелета оценивали по показателю МПКТ и Z-критерию (SD).
Показатели кальций-фосфорного обмена определяли с использованием биохимического анализатора электролитов «Sreеn Master Plus», Швейцария с использованием стандартных наборов реактивов «Bio-la-test calcium C-130», «Bio-la-test fosfor Р 80», Lahema, Чехия. Уровень паратиреоидного гормона (ПТГ) в сыворотке крови исследовали методом электрохемилюминесцентного иммуноанализа на аппарате «Elecsys 1010», Roch, Австрия. Уровень кальцийтонина (КТ) определяли радиоиммунологическим методом с использованием наборов «Cis bio international», Франция. Концентрацию ОКЦ в сыворотке крови исследовали методом электрохемилюминесцентного иммуноанализа на аппарате «Elecsys 1010», Roch, Австрия с использованием тест-системы «N-МID Osteocalcin», Roch, Австрия. Активность щелочной фосфатазы (ЩФ) в сыворотке крови исследовали на биохимическом анализаторе электролитов «Sreеn Master Plus», Швейцария с использованием набора Lahema, Чехия. Активность ТРКФ в сыворотке крови определяли спектрофотометрическим методом в модификации, адаптированной к набору реактивов «Sigma» с использованием цитрат-тартратного буфера.
Результаты. Анализ результатов исследований общего кальция сыворотки крови у детей в возрасте 7–10 лет показал, что содержание этого макроэлемента составляет 2,31±0,03 ммоль/л, что соответствует нормальным референтным значениям этого показателя. В группе детей старше 10 лет отмечена значительная вариабельность этого показателя, а также достоверное снижение уровня кальция в сыворотке крови 2,12±0,02 ммоль/л (р < 0,05) по сравнению с детьми более младшего возраста. Однако следует отметить что, полученные в группе детей 10–14 лет показатели содержания кальция, не выходят за пределы референтных данных (табл. 1).
Известно, что определение уровня общего кальция сыворотки крови представляет клиническую значимость лишь как факт, свидетельствующий о поступлении кальция в кровь, но не отражающий истинное содержание кальция как активного катиона, участвующего в обменных процессах. В связи с этим считают, что уровень ионизированного кальция лучше отражает его метаболизм кальция, чем показатели общего кальция. Поэтому определение ионизированного кальция в сыворотке крови наиболее информативно. Как показало проведенное исследование, уровень ионизированного кальция в сыворотке у здоровых детей в возрастной группе 11–14 лет снижен и составляет 0,86±0,04 ммоль/л (р < 0,1) (табл. 1), что в 1,3 раза ниже референтных пределов этого показателя.
Таблица 1. Биохимические показатели метаболизма костной ткани обмена у здоровых детей разного возраста
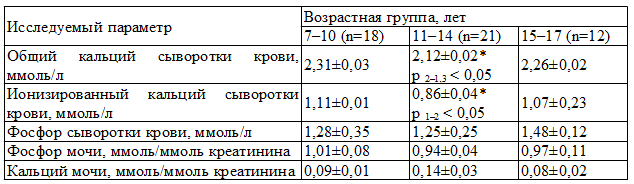
Содержание неорганического фосфора в сыворотке крови, кальция и неорганического фосфора в моче, по отношению к клиренсу креатинина, у здоровых детей соответствовал референтным значениям и не имело статистически значимых различий во все возрастные периоды (табл. 1).
Таким образом, анализ результатов исследований общего кальция в сыворотке крови здоровых детей показал, что в целом его уровень соответствует нормативным значениям во все возрастные периоды. Вместе с тем, индивидуальный анализ показателей уровня кальция позволил установить, что у 6 из 67 (9,0%) здоровых детей 7–10-летнего возраста и у 3 из 18 (16,7%) детей 14–17 лет выявлена гипокальциемия (от 2,06 до 2,21 ммоль/л), однако, при расчете средних значений в этих возрастных группах эти результаты не нашли своего отражения.
Выраженной гипокальциемии (менее 2,0 ммоль/л) ни у одного ребенка выявлено не было. Установленная гипокальциемия в группе здоровых детей 11–14 лет вероятнее всего является следствием повышенных затрат организма на минерализацию костной ткани при усиленных темпах роста скелета и периода пубертата.
В определенной мере уровень экскреции кальция и фосфора с мочой косвенно позволяют судить о состоянии их всасывания в кишечнике. Известно, что в процессе интенсивного роста и высоких темпов обновления костной ткани происходят определенные изменения в кристаллах гидроксиаппатита, участвующего в минерализации белкового органического костного матрикса. В случае повышенного освобождения катиона из гидроксиаппатита и увеличения его в русле, усиливается его экскреция с мочой.
По нашим данным, только у детей 11–17 лет имеет место некоторая тенденция к увеличению кальция в моче при относительно низком его содержании в сыворотке крови у детей в этой группе. Все эти результаты согласуются с мнением многих авторов, что у детей именно в период активного ростового скачка активно протекают обменные процессы в костной ткани по сравнению с другими возрастными группами.
Таким образом, изученные биохимические показатели кальций-фосфорного обмена у здоровых детей закономерно изменяются в разные возрастные периоды у подавляющего большинства детей, что согласуются с наличием определенных периодов роста скелета и накопления костной массы. Об этой связи убедительно свидетельствуют полученные особенности изменений биохимических параметров в разные возрастные периоды у в группе у здоровых детей. В процессе возрастной динамике изучавшихся показателей выявлены определенные сдвиги (чаще – относительные, в ряде случаев – достоверные), которые совпадали с критическими периодами детства.
Во всех возрастных группах детей отмечается относительная стабильность ионного минерального гомеостаза, что обеспечивается механизмами экстра- и интрацеллюлярного перераспределения катионов, гормональной регуляцией ионного гомеостаза ПТГ и КТ, а так же экскреторной функцией почек. Последнее подтверждается полученными данными по уровню кальция и фосфора в моче. Несмотря на то, что в возрастные периоды 11–14 лет констатируется вполне достоверная умеренная гипокальциемия, этот факт лишь свидетельствует о высокой потребности в этом катионе в костной ткани в процессе ее минерализации в основной период линейного роста скелета [2].
Регуляция костного ремоделирования является сложным процессом, на который влияет множество факторов, среди которых наиболее важное значение имеет гормональная регуляция кальций-фосфорного обмена. Основными регуляторными гормонами являются паратиреоидный гормон (ПТГ) и кальцитонин (КТ). ПТГ является основным регулятором кальциевого обмена в организме, снижая выделение кальция и увеличивая выделение фосфора из организма, в результате чего повышается концентрация ионов кальция и фосфатов в крови. КТ продуцируется клетками парафолликулярного эпителия (С-клеток) щитовидной железы, является физиологическим антагонистом ПТГ, в остеоцитах ингибирует ферменты, разрушающие костную ткань [3].
Содержание ПТГ в сыворотке крови у здоровых детей во всех возрастных группах не превышало пределы референтных норм. Установлено, что у здоровых детей с увеличением возраста уровень ПТГ снижается. Так, в возрастной промежуток 7–10 лет и 11–14 лет зарегистрирован уровень ПТГ в пределах 10,71±1,02 и 9,01±0,84 пмоль/л. Достоверное снижение концентрации ПТГ отмечено у детей в возрасте 15–17 лет. В этом возрасте уровень показателя снижается в 1,4 раза и составляет 8,01±0,08 пмоль/л (табл. 2).
Содержание КТ в сыворотке крови у здоровых детей во всех возрастных группах находилось в пределах референтных норм. Обнаружено, что с возрастом концентрация этого гормона у детей увеличивается. Так, в возрасте 15–17 лет уровень КТ превышает показатели детей 7–10 лет и 11–14 лет в 1,8 и 2 раза и составляет 4,09±0,12 пмоль/л (табл. 2).
Таким образом, нами показано, что с увеличением возраста у здоровых детей происходит изменение двух основных кальций-регулирующих гормонов, направленных на максимальное поддержание необходимого уровня кальция, потребность в котором у детей возрастает в период пубертата, основного ростового скачка и в постпубертатный период. Несмотря на это, а также на тот факт, что в возрастной период 15–17 лет имеет место достоверные отличия уровней КТ и ПТГ по сравнению с более младшими детьми, уровень этих гормонов у детей находится в пределах физиологической нормы и не выходит за пределы референтных значений.
Таблица 2. Уровень кальций-регулирующих гормонов у детей разного возраста

В группе здоровых детей 7–10 лет имеет место достаточно высокий уровень ПТГ, который способствует поддержанию допустимого уровня ионизированного кальция в крови за счет стимуляции остеокластов и торможения его экскреции с мочой.
Содержание КТ, который считается функциональным антагонистом ПТГ, с возрастом увеличивается. Это является компенсаторным механизмом снижения резорбции костной ткани, благодаря которому у детей в периоды активного ростового скачка и накопления костной массы происходит превалирование остеосинтетических процессов над резорбцией.
Можно предположить, что у здоровых детей в возрастной группе 10–14 лет на фоне низких показателей ПТГ при достаточно сниженной концентрации кальция в крови (2,12±0,02 ммоль/л, табл. 2) имеет место недостаточная ответная реакция ПТГ в ответ на гипокальциемию.
Физиологическое снижение уровня ПТГ с возрастом у здоровых детей приводит к подавлению активности как остеокластов, так и остеобластов [4], что в итоге обуславливает изменение костного обмена, биосинтеза коллагена и неколлагеновых белков костной ткани и определяет уменьшение скорости костеобразования в будущие возрастные периоды.
Процессы ремоделирования костной ткани складываются из сочетания двух разнонаправленных элементов – резорбции и костеобразования. В норме эти процессы урегулированы, тесно между собой взаимосвязаны и составляют основу постоянного динамического обновления вновь образованной кости. Для отражения тех метаболических сдвигов, которые происходят непосредственно в костной ткани у детей разного возраста нами проведено исследование маркеров костеобразования и резорбции.
Из маркеров костеобразования определяли в сыворотке крови активность ЩФ (щелочная фосфатаза) и содержание ОКЦ (остеокальцин), из маркеров резорбции – ТРКФ (тартрат-резистентная кислая фосфатаза) в сыворотке крови и содержание дезоксипиридинолина (ДПир) в моче.
Фермент ЩФ катализирует отщепление фосфора от органических соединений и имеет изоформы. Костная щелочная фосфатаза продуцируется остеобластами, ее синтез возрастает при увеличении дифференцировки этих клеток и при ускоренном костеобразовании [5].
Величина общей активности ЩФ сыворотки крови детей трех основных сравниваемых групп была наиболее высокой в группе детей 7–10 лет и составляла 212,1±21,4 Ед/л, что соответствует референтным значениям показателя для этого возраста. С возрастом в группе детей старше 10 лет величина общей активности щелочной фосфатазы снижается. Так, в группах детей в возрасте 11–14 и 15–17 лет наблюдалось достоверное уменьшение общей активности ЩФ по сравнению с детьми более младшего возраста (р < 0,05; р < 0,03) (табл. 3).
Таблица 3. Биохимические маркеры костного ремоделирования у здоровых детей разного возраста

Наши данные соответствуют имеющимся в литературе данным и вполне подтверждают существующее мнение о том, что общая активность фермента, имеющего изоформы, менее информативна, чем активность его фракций. Однако, следует отметить, что согласно литературным данным у детей до 18 лет в сыворотке крови при анализе превалирует активность именно костной фракции щелочной фосфатазы среди других фракций и составляет 80–85%, так как вклад печеночной и других изоформ минимален [6].
В нашем исследовании полученные показатели активности ЩФ оказались достаточно высокими в группах детей старше 10 лет по сравнению с референтными значениями (табл. 3). Так, уровень ЩФ у детей в возрасте 11–14 лет составлял - 126,9±12,0 Ед/л, в возрасте 15–17 лет - 132,9±23,3 Ед/л (референтные значения для детей старше 10 лет - 39–92 Ед/л). Этот факт позволил нам сделать заключение, что достаточно высокая активность ЩФ у детей отражает интенсивность процессов костеобразования и накопления костной массы у детей в период интенсивного роста скелета. Подтверждением этих данных является изученный профиль ОКЦ в возрастном аспекте. ОКЦ относится к неколлагеновым белком костной ткани и по современным представлениям является маркером метаболической активности остеобластов [7]. Содержание ОКЦ в сыворотке крови всех обследованных детей трех возрастных групп находилось в референтных пределах. Так, в возрастной группе 11–14 лет содержание ОКЦ составляло 19,6±6,6 нг/мл, 7–10 лет - 13,1±5,4 нг/мл, а в возрастной группе 15–17 лет - 14,7±4,3 нг/мл.
Обнаружено достоверное увеличение в 1,3 и 1,5 раза содержания ОКЦ в сыворотке крови в возрастной период 11–14 лет по сравнению с показателями двух других возрастных групп (р < 0,05) (табл. 3).
ТРКФ отражает состояние активности остеокластов и выраженность резорбтивных процессов в скелете [8]. Уровень активности ТРКФ сыворотки крови у здоровых детей не имел статистически значимых отличий во всех возрастных группах (табл. 3).
Наиболее высокая активность фермента зарегистрирована в возрастных группах 7–10 и 11–14 лет. Так, активность ТРКФ в сыворотке крови здоровых детей в этом возрасте составляла 3,8±0,6 ЕД/л и 3,7±0,4 ЕД/л, соответственно (табл. 3).
После 15 лет у детей активность фермента несколько снижалась, но не ниже референтных значений фермента и составляла 2,9±0,9 ЕД/л (табл. 3).
Костный коллаген характеризуется наличием поперечных связей между отдельными молекулами коллагена, представленных дезоксипиридинолином (ДПид) и пиридинолином, показатели которых в моче являются наиболее адекватными маркерами резорбции костной ткани.
Наиболее высокое содержание ДПир в моче у детей отмечено в возрасте 7–10 лет по сравнению с более старшими возрастными группами и составляет 79,6±23,2 нмоль/моль креатинина (табл. 3).
С возрастом содержание ДПир в моче у здоровых детей снижается. При обобщенном анализе трех возрастных групп детей установлено отсутствие увеличения или уменьшения содержания ДПир в моче от референтного значения. Так, в возрастной группе 11–14 лет содержание ДПир составляло 43,7±19,4 нмоль/моль креатинина, а в возрастной группе 15–17 лет - 34,9±17,1 нмоль/моль креатинина.
Достоверные отличия уровня ДПир в моче отмечены у детей 11–15 и 15–17 лет по сравнению с детьми 7–10-летнего возраста (р<0,05;р<0,01) (табл. 3).
Выявленный в нашем исследовании повышенный уровень ОКЦ у детей 11–14-летнего возраста совпадает с периодом активного ростового скачка и свидетельствует об усилении образования неколлагеновой части белкового костного матрикса и ее минерализации, благодаря высокой аффинности ОКЦ к гидроксиапатиту кальция.
Таким образом, установлено, что во всех возрастных группах у здоровых детей регистрировались нормальные или несколько повышенные концентрации ОКЦ в сыворотке крови и нормальное или несколько пониженное содержание ДПир в моче – маркера костной резорбции. Это свидетельствуют о той или иной степени сбалансированности важнейших составляющих костного ремоделирования – остеосинтеза и резорбции с относительным превалированием процессов формирования костной ткани у здоровых детей.
