Многочисленные работы, посвященные исследованию роли оксида азота (NO) в регуляции различных физиологических процессов в организме, опубликованные в последние десятилетия, привели к существенному изменению взглядов на целый ряд основополагающих биохимических процессов. По значимости открытие физиологической роли этого соединения сравнивают с открытием нового материка [1].
Исследование свойств NO показало, что это эндогенно вырабатываемое вещество обладает большой химической активностью и коротким временем жизни. Подобные свойства обуславливают возможность депонирования NO в ряде нитрозосоединений, сохраняющих его биологическую активность, но обладающих при этом большей стабильностью. Таких соединений известно несколько, одними из основных подобных соединений являются s-нитрозотиолы (RSNO).
К настоящему времени точные механизмы образования RSNO неизвестны [10], но имеются данные, что они образуются в результате деятельности ферментов NO-синтаз, при этом формирование RSNO возможно в результате функциональной активности любой изоформы этого фермента [12]. Rassaf T. еt al. [21] показано, что при введении в локтевую вену препаратов NO в крови следом увеличивается содержание RSNO, что явилось подтверждением мнения о том, что RSNO – это запасная форма NO.
В целом следует отметить, что RSNO исследованы несравненно менее чем NO, и их изучение находится в стадии накопления данных. Необходимо так же подчеркнуть, что существуют особые методические трудности, осложняющие их исследование; к ним следует отнести отсутствие унифицированного метода определения RSNO, общепризнанных референтных интервалов и стандартов. Поэтому данные о количественном содержании этих веществ у разных авторов могут существенно отличаться.
Тем не менее, к настоящему времени установлены некоторые функции, которые выполняют RSNO в деятельности организма и его систем в норме и патологии: RSNO, так же как и NO, регулируют сосудистый тонус, обеспечивают насыщение тканей кислородом и обуславливают эффект от тренировок [8,15]; важна и в некоторой степени изучена к настоящему времени роль RSNO в функционировании респираторного тракта [19,20]; у RSNO выявлено наличие выраженных антимикробных свойств [13,23]. Исследованиями современных ученых показано их участие в процессах апоптоза посредством нитрозилирования и денитрозилирования каспаз [9,17]. Известно, что регуляция деятельности кишечной нервной системы во многом определяется RSNO [22]. Основным недавним достижением является установление факта, что нитрозилирование белков с конечным образованием RSNO является важным регуляторным механизмом клеточных функций и самостоятельным путем передачи клеточных сигналов, весьма сходным с фосфорилированием. Путем посстрансляционной модификации различных белков RSNO участвуют в регуляции их функциональной активности [14,17].
Из всего вышеперечисленного следует насколько важны, могут быть RSNO для формирования патологических состояний. Однако в настоящее время наиболее исследована роль RSNO лишь при бронхиальной астме и сосудистой гипертензии. Обращает на себя внимание то обстоятельство, что при изучении RSNO усилия ученых сосредоточены в основном на экспериментальных работах и на исследованиях, посвященных выяснению роли RSNO в норме и патологии у взрослых. Работы, посвященные изучению этих соединений в процессе формирования патологических состояний у детей, практически отсутствуют. Поэтому целью настоящего исследования явилось изучение количественных особенностей содержания NO и RSNO в сыворотке крови детей, страдающих хроническими заболеваниями в разных отделах пищеварительного тракта, а также выяснение особенностей взаимодействия NO и RSNO при этих патологических состояниях.
Материалы и методы исследования. В исследовании принимали участие 238 детей обоего пола в возрасте от 3 до 17 лет, страдающих различными хроническими заболеваниями желудочно-кишечного тракта; в том числе - 26 детей с патологией верхнего отдела пищеварительного тракта (ЗВОПТ) без разделения по стадиям заболевания и степени активности, из них: 15 детей с язвенной болезнью двенадцатиперстной кишки (ЯБДК) и 11 пациентов с гастроэзофагеальной рефлюксной болезнью (ГЭРБ), 72 ребенка с патологией кишечника; из них 52 - с неспецифическим язвенным колитом (НЯК) и 20 детей с болезнью Крона (БК). В связи с отсутствием в литературных источниках данных о содержании RSNO в сыворотке крови здоровых детей и этическими сложностями, связанными с получением образцов крови у этого контингента, то в соответствии с рекомендациями ГОСТ Р 53022.3-2008 [5] для сравнительного анализа использованы данные общегоспитальной группы, состоящей из 782 детей с различной патологией желудочно-кишечного тракта и аллергическими заболеваниями.
Кровь для проведения исследований получали утром, натощак, путем венепункции локтевой вены. Юридическим основанием для проведения этой манипуляции явилось наличие информированного согласия пациентов или их родителей. Получение сывороток осуществлялось стандартным способом.
RSNO определялись спектрофотометрическим методом, основанном на отщеплении нитрозогрупп RSNO при помощи ионов ртути с последующей детекцией азокрасителя, полученного при помощи реактива Грисса [16]. Суммарное содержание нитритов и нитратов определялось по методу Грисса, при этом восстановление нитратов в нитриты проводилось с помощью хлористого ванадия [4,18].
Полученные данные подвергнуты статистической обработке с помощью пакета программ «STATISTICA 6.0». Поскольку было выяснено, что распределения величин во всех анализируемых группах отличаются от нормального, определялись непараметрические показатели статистического анализ: медиана, верхний и нижний квартили, минимальное и максимальное значения; достоверность различий между исследуемыми группами оценивалась при помощи критериев Краскела-Уоллиса и Манна-Уитни.
Результаты исследования и их обсуждение. Данные, полученные в результате исследования сывороток крови детей, страдающих различными хроническими заболеваниями ЖКТ, представлены в табл. 1. Минимальное содержание RSNO в сыворотке крови отмечено у детей, больных ГЭРБ (медиана - 100,00 нм/мл). Более высокие значения получены для сывороток крови детей, страдающих ЯБДК, однако эти группы статистически неотличны по величине показателя, как между собой, так и с группой сравнения.
Таблица 1. Статистические показатели содержания RSNO при различных заболеваниях ЖКТ у детей
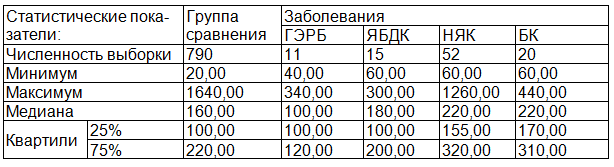
Самые высокие значения показателя отмечены в группах детей с НЯК и БК, по уровню RSNO эти группы статистически неотличны между собой, но имеют высоко статистически значимые отличия как от группы сравнения, так и от значений показателя в группах детей с ГЭРБ и ЯБДК (р=0.000).
На основании полученных результатов (прежде всего достоверности разницы) на следующем этапе исследования данные по количественному содержанию RSNO были переформированы в три укрупненные группы: одну группу составили значения RSNO в сыворотках крови детей с ЗВОПТ, в другую включены величины показателя в сыворотках крови детей с ВЗК, группа сравнения изменений не претерпела. Результаты статистической обработки этих групп представлены на рис.1.
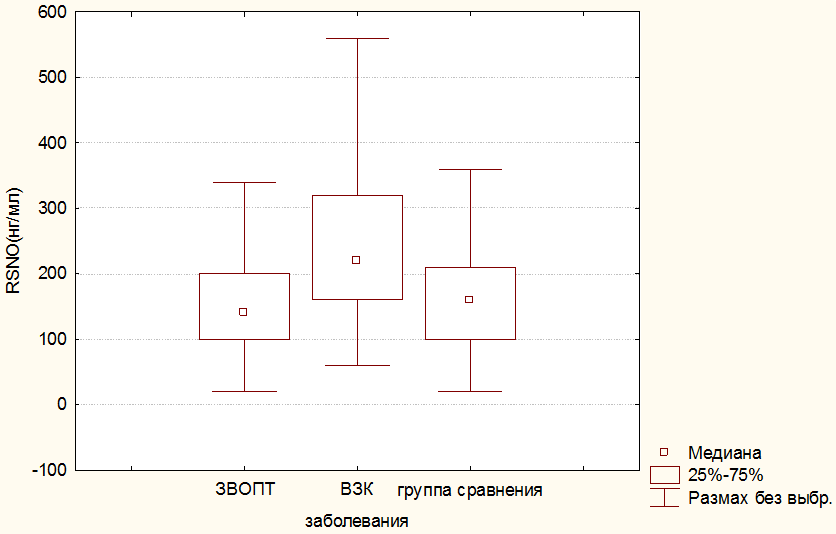
Рис. 1. Уровни значений RSNO (в нг/мл) в группах детей с ВЗК и ЗВОПТ.
Как свидетельствуют данные статистической обработки, содержание RSNO у детей с ЗВОПТ статистически неотлично от такового показателя, рассчитанного для группы сравнения. Различия между содержанием RSNO в группах детей с ЗВОПТ и ВЗК высоко статистически значимы (р=0.000). Подобную ситуацию мы склонны рассматривать, прежде всего, как одно из проявлений меньшей выраженности воспалительного процесса при ЗВОПТ по сравнению с ВЗК.
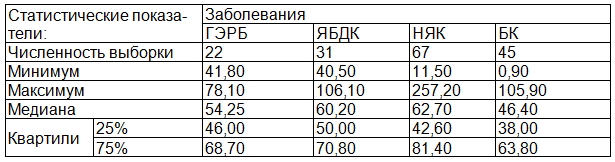
Аналогичному анализу были подвергнуты и результаты по содержанию в исследуемых сыворотках общих метаболитов азота (суммарного содержания нитритов и нитратов). По общепринятому мнению этот показатель характеризует степень активности NO-синтаз, то есть прямо зависим от количества синтезируемого этими ферментами оксида азота [4]. Данные о содержании общих метаболитов оксида азота (в мкМ), полученные в результате исследования сывороток крови детей, страдающих различными хроническими заболеваниями ЖКТ, представлены в табл. 2.
Как видно из представленных данных, количественное содержание общих метаболитов оксида азота в исследуемых сыворотках, во-первых, является повышенным по отношению к описанному в литературе количеству общих метаболитов азота, содержащихся в сыворотке крови здоровых детей (20-28 мкМ) [2], а, во-вторых, вполне сопоставимым между собой.
Таблица 2. Статистические показатели содержания NO у детей при различных заболеваниях ЖКТ
На следующем этапе исследования данные по количественному содержанию общих метаболитов оксида азота были переформированы в две укрупненные группы: одну группу составили значения NO в сыворотке крови детей с ЗВОПТ, а в другую включены величины показателя в сыворотке крови детей, страдающих ВЗК. Результаты статистической обработки этих групп представлены на рис.2.
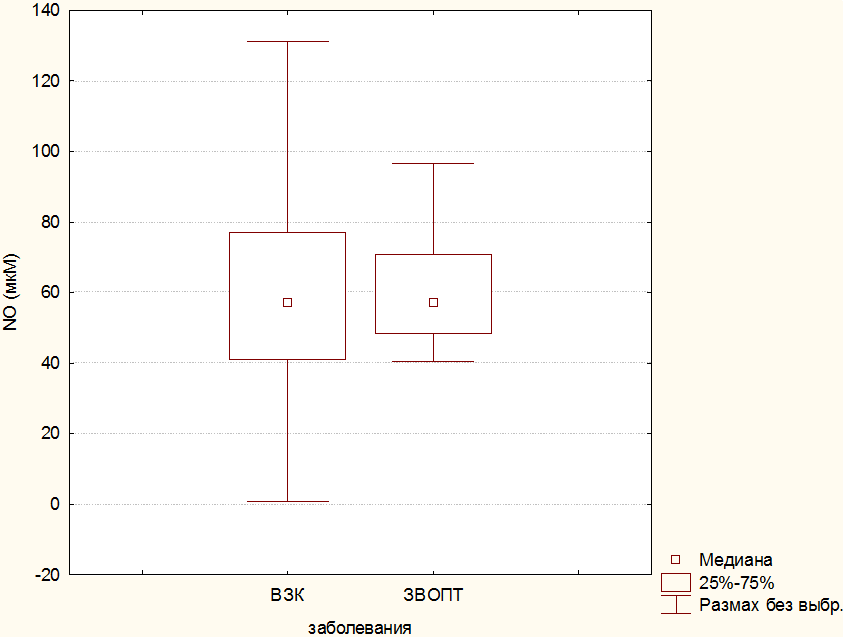
Рис. 2. Уровни значений NO (в мкМ) в группах детей с ВЗК и ЗВОПТ.
В представленных группах содержание NO весьма сходно по среднему уровню, различия между ними статистически незначимы.
В недавно опубликованной статье T.C.Savidge [22] указывает, что аберрантная активность синтаз оксида азота известна для многих заболеваний желудочно-кишечного тракта, но практически неизвестно, транслируется ли она в измененную активность RSNO. Данные, полученные в нашем исследовании, позволяют говорить о том, что повышенная активность NО-синтаз транслируется в измененную активность RSNO. Нами выявлено, что средние уровни NO при ЗВОПТ и ВЗК статистически неотличны между собой, а различия средних уровней производных от NO RSNO в сыворотке крови детей с ЗВОПТ и ВЗК имеют высокую статистическую значимость.
Для объяснения подобной ситуации следует обратить внимание на некоторые аспекты метаболизма NO и RSNO, описанные в ряде опубликованных работ. Так, Doullas P.T. et al. [10] выяснено, что образование RSNO (нитрозилирование белков) опосредуется целым рядом сложных молекулярных механизмов, при этом масс-спектрометрическими исследованиями выявлены сайты нитрозилирования, расположенные в α-спиралях 192 изученных белков и 328 пептидов, эти сайты оказались окруженными заряженными аминокислотами и управляющимися белок-белковыми и молекулярными взаимодействиями, а так же модифицированными металлопротеинами. H. Bayir et al. [6] опубликованы данные о том, что гомеостатические концентрации RSNO зависят от физиологического состояния.
Известно, что при повышении активности NO· способность супероксиддисмутазы (СОД) конкурировать с ним за О· резко падает, приводя к реакции между NO· и О· с образованием пероксинитрита [3]. В недавних исследованиях показано, что активация нитрозилирующего стресса, а именно S-нитрозилирование комплекса I в митохондриях (NADH-убихиноноксидоредуктазы, С-I) в изолированных кардиомиоцитах крыс вызывала последующую продукцию активных форм кислорода (АФК) митохондриального происхождения [7]. Все вышесказанное определяет образование своеобразного патологического круга: при недостаточной активности антиоксидантной защиты баланс в системе «прооксиданты – антиоксиданты» смещается в сторону прооксидантов, определяя последующую интенсификацию нитрозилирующего стресса, что, в конечном счете, и может предрешить трансформацию физиологически адаптивных реакций в патологические.
Триггерами окислительного и нитрозилирующего стрессов могут быть разнообразные факторы, от генетических дефектов до чисто стохастических событий (например, степень восстановленности редокс-компонентов в данный момент). Тем не менее, отсутствие защиты от активных форм азота (АФА) и АФК с одной стороны и необходимость интенсивного образования NO· при воспалении может приводить в конечном счете к повреждению клеточного окружения за счет образования токсичных метаболитов ·ONOO· и 3-нитротирозина. На наш взгляд, именно на этом этапе необходимо функционирование защитного механизма, который мог бы транслировать нежелательную для организма активность NO в иные, неопасные (или менее опасные) для организма соединения, роль которых по нашим данным могут выполнять RSNO. Основанием этого заключения является выявленный нами факт, что уровень NO при исследованных заболеваниях у детей одинаков, а различия в концентрациях RSNO между этими группами имеют высокую статистическую значимость. Аналогичную ситуацию для детей с черепномозговыми травмами описали H. Bayir et al. [6] указав, что рост концентрации RSNO у таких детей наблюдается при увеличенном синтезе NO. Все эти факты, на наш взгляд, позволяют предположить существование в организме особого защитного механизма, основной задачей которого является предотвращение нитрозилирующего стресса, поэтому одной из функций RSNO является защитная.
Одновременно с тем, разнообразные функции RSNO в организме, данные о том, что биоактивность NO чаще опосредуется сигналами RSNO, нежели гуанилилциклазы [22], а так же сведения, свидетельствующие об образование RSNO как не случайном событии, зависящем от физиологического состояния [6,10] – все эти факты позволяют предположить, что RSNO принадлежит особое значение в патогенезе заболеваний желудочно-кишечного тракта у детей, которое, несомненно, требует дальнейшего исследования.
Выводы. Содержание RSNO в сыворотке крови детей, страдающих различными нозологическими формами гастроэнтерологической патологии, различно и максимально выражено при ВЗК, что, по всей видимости, обусловлено различной интенсивностью воспалительного процесса, свойственной тому или иному заболеванию.
Содержание NO при исследованных нами ЗВОПТ и ВЗК является повышенным, но статистически неотличным между этими группами.
Одинаковый уровень NO и существенная разница в уровнях производного от этого NO RSNO в сыворотках крови детей с ВЗК и ЗВОПТ могут свидетельствовать о наличии в организме особого механизма защиты от нитрозилирующего стресса в результате функционирования которого высокие концентрации NO, обладающие повреждающим воздействием на живые клетки, транслируются в менее опасные для организма соединения – RSNO.
Учитывая современные литературные данные о том, что образование RSNO неслучайно и осуществляется сложными молекулярными механизмами, а так же новые сведения о том, что биоактивность NO чаще опосредуется сигналами RSNO, нежели гуанилилциклазы, можно предположить, что роль RSNO в патогенезе заболеваний желудочно-кишечного тракта у детей гораздо шире, нежели значение соединения депонирующего NO, что, несомненно, требует дальнейшего изучения.
