Введение. Несмотря на достигнутый в медицине прогресс в изучении этиологии, патогенеза, клиники, терапии и профилактики хронического гастродуоденита, данное заболевание продолжает оставаться одной из наиболее актуальных медико-социальных проблем, что обусловлено его широким распространением среди населения, риском развития диспластических изменений и недостаточной эффективностью лечебных мероприятий [1]. В детской популяции он находится на уровне от 153 до 235‰ с тенденцией к дальнейшему увеличению, в том числе и воспалительно-деструктивного процесса в слизистой оболочке желудка и двенадцатиперстной кишки [2].
В настоящее время ключевым фактором в развитии гастродуоденальной патологии является Helicobacter pylori, контаминация которой слизистой оболочки при данных заболеваниях достигает 85% [3, 4]. Наряду с этой бактерией ряд авторов обращает внимание на присутствие в желудке вирусов и их влияние на течение воспалительного процесса. Так, опубликованы работы, посвященные роли вирусов герпеса 1–8 типов в развитии гастрита [5-7]. Показано выявление вируса папилломы человека при хронических воспалительных и предопухолевых заболеваниях желудка [8]. Однако этих работ явно не достаточно для определения роли данных микроорганизмов в развитии поражений слизистой оболочки верхних отделов желудочно-кишечного тракта.
Известно, что воспалительный процесс в гастродуоденальной слизистой оболочке сопровождается активацией иммунной системы с непосредственным участием цитокинов [9, 10]. Их сдвиги, по-видимому, играют существенную роль в персистенции вирусной и бактериальной микрофлоры, в том числе в желудке и двенадцатиперстной кишке и могут способствовать прогрессированию и хронизации патологии. Определение цитокинового статуса позволяет судить об интенсивности воспалительной реакции, активности заболевания и эффективности проводимой терапии [11].
Показано, что выраженную противовирусную активность проявляет фактор некроза опухоли α (ФНО-α), оказывая прямое повреждающее действие на клетки-мишени и вызывая лизис клеток, инфицированных вирусом. Он является необходимым и в то же время достаточным индуктором местных и системных воспалительных реакций [12]. Регуляция про- и противовоспалительных цитокинов осуществляется интерлейкином 2, способным компенсировать проявления иммунной недостаточности за счет восстановления баланса лимфоцитов – Т-хелперов 1 и 2 типа. Его изменения являются показателем активации Т-клеточного иммунитета [13].
Большинство авторов указывают на нарушения ФНО-α и ИЛ-2 в сыворотке крови при хроническом гастродуодените [14-17]. Имеются лишь единичные литературные данные, посвященные этой проблеме при данной патологии, касающиеся их определения непосредственно в очаге воспаления - ФНО-α в желудочном соке у детей дошкольного возраста [18] и м-РНК ИЛ-2 и ФНО-α в слизистой оболочке у взрослых [19]. Недостаточно также исследований, показывающих изменения цитокинового профиля при воспалительных изменениях слизистой оболочки желудка и двенадцатиперстной кишки при различном микробном пейзаже в данной области [19], причем у детей с данной патологией подобные данные отсутствуют, что представляет большой интерес.
Цель исследования: установление у детей с хроническим гастродуоденитом взаимосвязи изменений состава микрофлоры желудка и двенадцатиперстной кишки и показателей цитокинов в желудочном соке и сыворотке крови.
Материалы и методы. На базе Нижегородского НИИ детской гастроэнтерологии наблюдалось 85 детей с хроническим гастродуоденитом в возрасте 5-17 лет, из них 51 мальчик и 34 девочки. Всем больным проведено комплексное обследование, включающее клинический осмотр, лабораторные и инструментальные методы диагностики, в том числе фиброэзофагогастродуоденоскопию, желудочное зондирование, внутрижелудочную рН-метрию, морфологическое исследование биоптатов слизистой оболочки фундального, антрального отделов желудка и двенадцатиперстной кишки.
Эндоскопические и гистологические изменения оценивались в соответствии с разделами «Рабочей классификации хронического гастрита, дуоденита, гастродуоденита у детей» [20].
Наличие ДНК Helicobacter pylori (H.p.), вирусов папилломы человека высокого канцерогенного риска (ВПЧ) 16, 18 типов, простого герпеса (ВПГ) 1, 2 типов, цитомегаловируса (ЦМВ) в желудочном соке и биоптатах гастродуоденальной слизистой оболочки выявлялось методом полимеразной цепной реакции («Вектор Бест»).
Пациенты были разделены на группы в зависимости от состава микрофлоры: 1-ую из них составили 21 человек с наличием ассоциаций микроорганизмов (H.р. и/или ВПЧ 16, 18, и/или ЦМВ, и/или ВПГ 1, 2), 2-ую - 15 пациентов с исключительно вирусной персистенцией (ВПЧ 16, 18 или ВПГ 1, 2 и/или ЦМВ), 3-ю - 18 наблюдаемых только с хеликобактерной инфекцией. В группу сравнения вошел 31 ребенок (37%) без представленной выше микрофлоры (рисунок 1). Контрольную группу составили 10 детей, не страдающих хроническим гастродуоденитом и относящихся к I или II группам здоровья.
Содержание фактора некроза опухоли α и интерлейкина-2 в желудочном соке и сыворотке крови определялось методом ИФА (ООО «Протеиновый Контур», Россия, Санкт-Петербург и «Bender Medsystems», Австрия соответственно).
Статистическая обработка проведена с использованием программы Statistica, версия 6.0. Описательная статистика признака включала среднее значение (М), ошибку средней величины (m). Для сравнения показателей между группами использовали точный критерии Манна-Уитни, Вилкоксона. Различия считались достоверными при достигнутом уровне значимости соответствующего статистического критерия р<0,05.
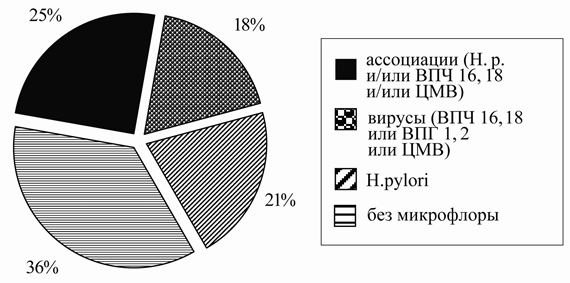
Рис. 1. Микрофлора желудка и двенадцатиперстной кишки у детей с хроническим гастродуоденитом.
Результаты и их обсуждение. Большинство наблюдаемых с хроническим гастродуоденитом поступили в отделение в периоде обострения – 76 человек, у 9-и была неполная клиническая ремиссия. У большинства больных давность заболевания составила более 3-х лет (42%) и с одинаковой частотой от 1 до 3 лет и менее года - у 27% и 31% детей соответственно. По данным внутрижелудочной рН-метрии у пациентов регистрировалась нормальная (в 38% наблюдений), а также повышенная (у 33% больных) и пониженная (у 29% обследованных) кислотопродуцирующая функция желудка.
До начала лечения у большинства детей отмечались боли в животе с локализацией, преимущественно, в области эпигастрия, а именно – у 48 из 85 (56%) пациентов, реже – в околопупочной области – у 28 (33%) человек. По интенсивности чаще всего встречались выраженные боли (42%). Пальпаторная болезненность эпигастральной и пилородуоденальной зон различной степени определялась у 53 (62%) и у 38 (45%) из 85 наблюдаемых. Проявления диспептического синдрома в виде отрыжки воздухом или пищей, тошноты регистрировались у 42 (49%) детей.
При эндоскопическом исследовании пациентов чаще всего выявлялись признаки неспецифического воспаления в виде отека и гиперемии в фундальном и антральном отделах желудка – у 62 (73%) и 48 (57%) из 85 обследованных соответственно, в двенадцатиперстной кишке – у 46 человек (54%). Необходимо отметить, что при исследовании антральной и бульбарной слизистой у 18 (21%) и 15 (18%) пациентов встречался узловатый процесс. Среди детей с одинаковой частотой определялись гастродуодениты с полипами и эрозиями желудка – у 15-и из 85 детей (18%).
Морфологически воспалительный процесс характеризовался преобладанием поверхностного воспаления – у 32 (38%) в желудке и 40 (47%) в двенадцатиперстной кишке из 85 обследованных. Диффузные изменения слизистой оболочки чаще встречались в дуоденальной слизистой - у 27 (32%) больных. У 12 человек (14%) присутствовала атрофия слизистой оболочки желудка. Для больных была более характерна средняя степень обсемененности Н.р. – у 22 из 39 (56%) детей с бактериальной персистенцией.
Одним из главных цитокинов, ответственных за развитие воспалительной реакции является ФНО-α. Установлено, что у всех наблюдаемых с хроническим гастродуоденитом данный показатель в желудочном секрете был значительно выше, чем в норме. При этом, при отсутствии выявления изучаемой микрофлоры его среднее значение отчетливо увеличивалось против такового у здоровых детей, составляя 48,86±10,34 пг/мл и 0,99±0,27 пг/мл (р=0,00001). Следует отметить, что у больных с ассоциациями микроорганизмов в желудке и двенадцатиперстной кишке уровень цитокина был максимальным - 112,77±16,54 пг/мл с достоверным отличием от предыдущих групп (р=0,007, р=0,00003). Подобная величина ФНО-α регистрировалась в желудочном соке при выявлении вирусов – 86,61±7,53 пг/мл (р=0,01 с группой без микрофлоры и р=0,0005 с контролем). При Н.р.-инфекции он был ниже, чем при смешанном и вирусном инфицировании – 64,94±5,82 пг/мл (р=0,043 и р=0,004), но также выше, чем в норме (р=0,0003). Таким образом, у детей с хроническим гастродуоденитом наличие воспалительной реакции в желудке и двенадцатиперстной кишке, ассоциированное с присоединением бактериальных и вирусных агентов сопровождалось значительным увеличением цифр ФНО-α в желудочном соке (рис. 2).

Рис. 2. Изменения уровня ФНО-альфа в желудочном соке в зависимости от состава микрофлоры желудка у детей с хроническим гастродуоденитом: р N - достоверность различий между нормой и детьми с ассоциациями микроорганизмов - р N*=0,00003, с вирусами - р N**=0,0005, с Н.р. - р N***=0,0003, без микрофлоры - р N****=0,00001; р’=0,007 - достоверность различий между группой детей с ассоциациями и без микрофлоры, р”=0,004 - достоверность различий между группой детей с ассоциациями и Н.р., р”’=0,01 - достоверность различий между группой детей с вирусами и без микрофлоры, р”’’=0,043 - достоверность различий между группой детей с вирусами и Н.р.
Аналогичная направленность нарушения содержания данного цитокина выявлялась в сыворотке крови, однако отчетливых его изменений на фоне вирусной персистенции в желудке и двенадцатиперстной кишке не наблюдалось. Так, у детей без микрофлоры при воспалении в слизистой оболочке гастродуоденальной области было отмечено повышение уровня ФНО-α по сравнению со здоровыми, равное 54,22±5,53 пг/мл и 11,10±2,77 пг/мл (р=0,000001). В присутствии изучаемых микроорганизмов его значение было также высоким, как и в контроле, составляя в группе детей с ассоциациями микробной флоры 98,21±19,46 пг/мл, с вирусами - 73,22±15,42 пг/мл и с Н.р. - 63,99±11,49 пг/мл, достоверно отличаясь только от нормы (р=0,000001, р=0,000009, р=0,000009). Полученные результаты свидетельствуют о том, что при хроническом гастродуодените концентрация ФНО-α в крови отчетливо повышается независимо от выявления и состава микрофлоры (рис. 3).
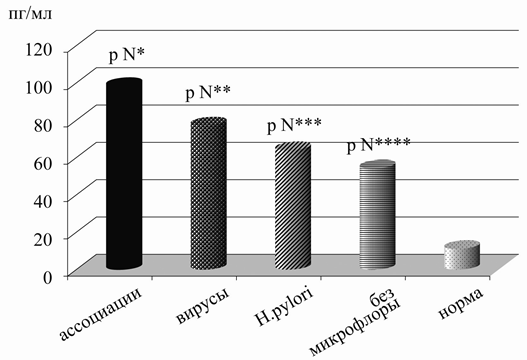
Рис. 3. Изменения уровня ФНО-α в сыворотке крови в зависимости от состава микрофлоры желудка у детей с хроническим гастродуоденитом: р N - достоверность различий между нормой и детьми с ассоциациями микроорганизмов - р N*=0,000001, с вирусами - р N**=0,000009, с Н.р. - р N***=0,000009, без микрофлоры - р N****=0,000001.
Таким образом, при наличии воспалительного процесса в слизистой оболочке желудка и двенадцатиперстной кишки у детей определяется отчетливое повышение содержания ФНО-α не только в непосредственной близости к очагу воспаления, но и на организменном уровне. В то же время только в желудочном соке выявлена взаимосвязь данного показателя с вирусной и вирусно-бактериальной персистенцией в желудке и двенадцатиперстной кишке. При этом значения ФНО-α были максимальными, что может являться критерием наличия этих микроорганизмов при данной патологии.
Самые высокие значения данного показателя при вирусно-бактериальном инфицировании и, в меньшей степени, – при исключительно хеликобактерной персистенции могут свидетельствовать о синергичности иммунной реакции на наличие ассоциаций микроорганизмов.
Одним из факторов, регулирующих изменения ФНО-α, а также других цитокинов, продуцируемых Т-клетками, является интерлейкин-2 [21]. При хроническом гастродуодените у детей выявлены его нарушения в желудочном соке. Так, при отсутствии инфекционных агентов установлено снижение уровня ИЛ-2 до 13,54±1,44 пг/мл с достоверным отличием по сравнению с нормой – 15,69±0,47 пг/мл (р=0,014). При наличии ассоциаций микроорганизмов данный показатель был отчетливо меньше, чем в вышеописанных группах и составлял 8,78±0,76 пг/мл (р=0,003, р=0,000001). Аналогичные низкие его цифры наблюдались при наличии вирусов – 8,49±1,30 пг/мл или Н.р. – 7,64±1,17 пг/мл (р=0,017, р=0,0002 относительно такового у пациентов без микрофлоры и р=0,00002, р=0,000004 с контролем). Полученные результаты свидетельствуют, что для хронического гастродуоденита у детей характерно уменьшение содержания ИЛ-2 в желудочном соке с минимальными его значениями при выявлении в желудке и двенадцатиперстной кишке вирусов и/или бактерий (рис. 4).
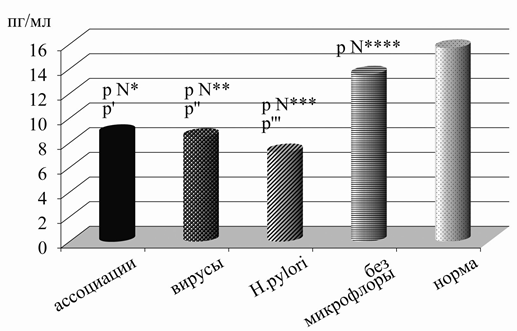
Рис. 4. Изменения уровня ИЛ-2 в желудочном соке в зависимости от состава микрофлоры желудка у детей с хроническим гастродуоденитом: р N - достоверность различий между нормой и детьми с ассоциациями микроорганизмов - р N*=0,000001, с вирусами - р N**=0,00002, с Н.р. - р N***=0,000004, без микрофлоры - р N****=0,014; p’=0,003 - достоверность различий между детьми без микрофлоры и с ассоциациями, p”=0,017 - достоверность различий между детьми без микрофлоры и с вирусами, p”’=0,0002 - достоверность различий между детьми без микрофлоры и с Н.р.
Что касается изменений данного цитокина в сыворотке крови, то при наличии воспаления в гастродуоденальной слизистой оболочке, неассоциированном с изучаемыми микроорганизмами, его величина, в отличие от желудочного сока не снижалась по сравнению с нормой, равняясь 11,72±1,18 пг/мл и 12,17±0,43 пг/мл. Однако, при выявлении сочетания вирусов и Н.р. в желудочном соке и двенадцатиперстной кишке регистрировались нарушения его содержания в крови, аналогичные таковым на уровне органа. При этом регистрировалось самые минимальные значения цитокина – 3,14±0,21 пг/мл (р=0,00001, р=0,000002 с приведенными выше группами). Аналогичные изменения с уменьшением величины ИЛ-2 наблюдались при исключительно вирусной персистенции - 3,69±0,47 пг/мл с достоверной разницей по сравнению со здоровыми детьми и пациентами без микрофлоры (р=0,000002, р=0,00004). При хеликобактериозе его уровень был также отчетливо ниже, чем у последних двух групп и составлял 7,46±1,29 пг/мл (р=0,009 и р=0,046), но значительно выше, чем при наличии ассоциаций и вирусов (р=0,006 и р=0,039) (рис. 5).
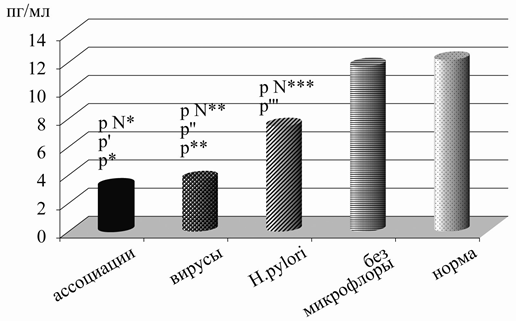
Рис. 5. Изменения уровня ИЛ-2 в сыворотке крови в зависимости от состава микрофлоры желудка у детей с хроническим гастродуоденитом: р N - достоверность различий между нормой и детьми с ассоциациями микроорганизмов - р N*=0,000002, с вирусами - р N**=0,000002, с Н.р. - р N***=0,009; p’=0,00001 - достоверность различий между детьми без микрофлоры и с ассоциациями, p”=0,00004 - достоверность различий между детьми без микрофлоры и с вирусами, p”’=0,046 - достоверность различий между детьми без микрофлоры и с Н.р., p*=0,006 - достоверность различий между детьми с ассоциациями и с Н.р., p**=0,039 - достоверность различий между детьми с вирусами и с Н.р.
Следовательно, у детей с хроническим гастродуоденитом величина ИЛ-2 в желудочном соке и сыворотке крови при выявлении изучаемых микроорганизмов имеет одинаковую направленность изменений, достоверно уменьшаясь как при вирусной, так и бактериальной персистенции и может ухудшать течение патологического процесса.
По-видимому, у детей с воспалительными изменениями в гастродуоденальной слизистой оболочке при наличии микроорганизмов, независимо от их состава имеет место сниженный уровень иммунной реактивности, прежде всего Т-клеточного звена [13, 22, 23]. Уменьшение содержания ИЛ-2 может быть связано с мобилизацией супрессорных механизмов, подавляющих активность лимфоцитов разнообразной специфичности в ответ на поликлональную активацию В-клеток микробными продуктами [24].
Выводы. У детей с хроническим гастродуоденитом установлены разнонаправленные нарушения цитокинов с повышением ФНО-α и снижением ИЛ-2 в желудочном соке и крови, взаимосвязанные с присутствием патогенной микрофлоры в желудке и двенадцатиперстной кишке, в частности, с вирусной и/или бактериальной персистенцией (вирусы папилломы человека 16,18, простого герпеса 1, 2, цитомегаловирус, Helicobacter pylori). При этом наиболее выраженные изменения цитокинов регистрировались в желудочном соке, в непосредственной близости к воспалительному процессу.
Нарушения уровней этих иммунологических показателей позволяют предположить наличие инфекционной составляющей в виде, прежде всего ассоциаций микроорганизмов, при хронических воспалительных заболеваниях верхних отделов пищеварительного тракта, что может изменить подходы к терапии.
