Введение. Прогрессирование тубулоинтерстициальных поражений почек (ТИПП) и поиск способов его торможения по-прежнему одна из наиболее актуальных проблем нефрологии [3]. Патогенез интерстициальных поражений почек сложен и детерминирован рядом генов. Основной подход к изучению роли молекулярно-генетических факторов в развитии тубулоинтерстициальных поражений почек связан с выявлением группы генов с потенциально наибольшим вкладом в патогенез заболевания. Гены вазоактивных систем регулируют системную и внутрипочечную гемодинамику, а также стимулируют гипертрофию и гиперплазию мезангиальных клеток и синтез межклеточного матрикса, а продукты экспрессии этих генов участвуют в развитии нефросклероза. Однако исследования о роли полиморфных вариантов генов вазоактивных систем в генезе тубулоинтерстициальных поражений почек не многочисленны и касаются единичных генов, контролирующих отдельные биохимические звенья этого сложного процесса. Для исследования было выбрано 3 гена-кандидата, полиморфные варианты которых согласно международным базам данных ассоциируются с заболеваниями почек. Мы исследовали гены, связанные с работой РААС: ген ангиотензин-превращающего фермента - ACE (I>D), 2 полиморфных варианта гена ангиотензиногена – АGT T174M (C>T) и AGT М235T (Т>C). Было изучено 3 полиморфных варианта в каждом из 4 генов, представляющих собой точечные замены в последовательности нуклеотидов, что предполагает изменение функции или экспрессии кодируемого белка.
Цель исследования: выявить полиморфные варианты гена ангиотензинпревращающего фермента и гена ангиотензиногена и определить их роль в прогрессировании тубулоинтерстициальных поражений почек у детей дошкольного возраста.
Пациенты и методы. Работа выполнена на кафедре детских болезней педиатрического факультета ГБОУ ВПО ИвГМА МЗСР России на базе детского нефрологического отделения ОГБУЗ ИвОКБ.
Проведено обследование 60 детей дошкольного возраста с тубулоинтерстициальными поражениеми почек (ТИПП). Отбор испытуемых проводился путем сбора анамнеза и выкопировки сведений из историй болезни. Контрольную группу составили 15 здоровых детей. Между основной и контрольной группами не отмечалось статистически значимых различий по возрасту и полу.
Молекулярно-генетические исследования проводились в ЗАО «Постгеномные и нанотехнологические инновации» г. Москва. Определение точечных мутаций (полиморфизмов) в геноме проводилось с помощью универсальной системы «SNP-экспресс» методом полимеразной цепной реакции с аллель-специфичными праймерами, основанном на реакции минисеквестрирования с последующим анализом продуктов на MALDI-TOF-масс-спектрометре.
Статистический анализ полученных данных проводился с использованием программы статистической обработки материала Statistica (версия 6.0). Частоты встречаемости генетических полиморфизмов определяли прямым подсчетом. Для оценки соответствия распределения генотипов генов-маркеров ожидаемым значениям при равновесии Хайди-Вайнберга и сравнения частоты встречаемости полиморфизмов в основной и контрольной группе использовали коэффициент ранговой корреляции (χ2) Пирсона и точный критерий Фишера для небольших выборок. Об ассоциации генотипов с предрасположенностью к заболеванию судили по величине отношения шансов (OR). OR - показатель отражающий во сколько раз вероятность оказаться в группе «случай» (больные) отличается от вероятности в группе «контроль» (здоровые) для носителя изучаемого генотипа. По OR судят о связи данного генотипа с риском развития заболевания. Если нижняя граница доверительного интервала для значения OR превышает 1, то OR>1 рассматривают как показатель повышенного риска развития болезни, связанного с генетическим маркером («фактор риска»); OR<1 (верхняя граница доверительного интервала менее 1 свидетельствует об отрицательной ассоциации генетического маркера с развитием болезни («фактор устойчивости»). Для расчетов использовали программу «Калькулятор для расчета статистики в исследованиях «случай-контроль» http://goo.gl/GGzLA.
Результаты и их обсуждение. Детей основной группы разделили на три группы: в первую группу были включены дети с оксалурией (n=15); во вторую - дети с дизметаболической нефропатией (ДН) (n=30); в третью - дети с тубулоинтерстициальным нефритом метаболического генеза (ТИН) (n=15).
Мы выявили распределение частот полиморфных вариантов генов РААС у обследованных детей (табл.1).
Таблица 1. Частота распределения полиморфных вариантов изучаемых генов РААС у обследованных детей (точный критерий Фишера)
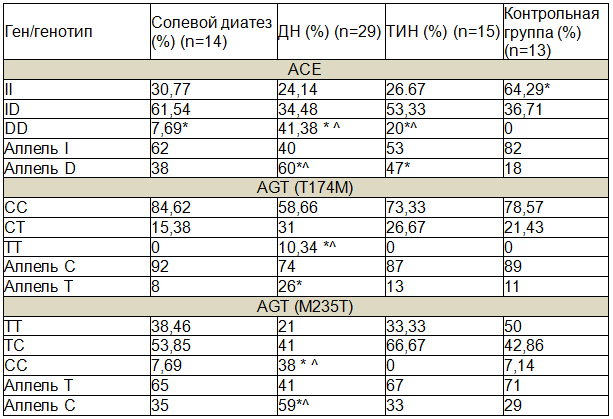
Примечание: * - достоверность различий между основной и контрольной группой (р<0,05); ^ - достоверность различий между группой с ДН и ТИН и группой с солевым диатезом (р<0,05).
У детей с ТИПП достоверно (p<0,05) чаще, по сравнению с контролем, встречались генотип DD и аллель D гена ACE, аллель T гена AGT 174, генотип CC и аллель С гена AGT 235, что, вероятно, определяет значимость данных полиморфных вариантов генов-маркеров в развитии этих заболеваний (табл. 1). Можно предполагать, что генотип DD и аллель D гена ангиотензинпревращающего фермента [1,4,5], аллель Т гена ангиотензиногена 174, а также генотип СС и аллель С гена ангиотензиногена 235[7] являются неблагоприятными в плане развития тубулоинтерстициального поражения почек. А генотип II гена ангиотензинпревращающего фермента [2,6,8,10], генотип СС гена ангиотензиногена 174 и генотип ТТ гена ангиотензиногена 235 можно считать благоприятными. Наши результаты соответствуют литературным данным о связи клинического течения и сохранности почечных функций с наличием определенных генотипов и аллелей [1,2,4,6-10]. Известно, что основными факторами, определяющими повреждение почек при ТИПП, считают ангиотензин II и альдостерон. Наличие D-аллеля ассоциируется с повышенным уровнем АПФ в тканях и в циркулирующем русле [11]. Можно предположить, что в механизмах развития заболевания в группе обследованных детей существенную роль играет повышение уровня АПФ в крови, в ответ на что происходит активация ангиотензина II, который непосредственно действует на эфферентные почечные артериолы, приводя к увеличению скорости гломерулярной фильтрации и повышению давления в почках, что, ведет к еще большему нарушению почечной гемодинамики. Регулируя системную и внутрипочечную гемодинамику, а также стимулируя гипертрофию и гиперплазию мезангиальных клеток и синтез межклеточного матрикса, продукты экспрессии изучаемых нами генов участвуют в развитии и прогрессировании нефросклероза. Ангиотензин II способен воздействовать на микроциркуляцию в почке на всех уровнях ее сосудистой системы.
Важное значение для оценки индивидуального генетического риска имеет установление ассоциации гена с заболеванием. При исследовании ассоциаций мы сравнивали распределение частот аллелей и генотипов полиморфных вариантов генов в группах пациентов с ТИПП и здоровых детей дошкольного возраста. Расчет относительного риска (OR) указывает на высокую вероятность развития ТИПП при наличии следующих полиморфных вариантов генов РААС: DD- генотипа гена ангиотензинпревращающего фермента(OR = 4,83), генотипов CT и ТТ гена ангиотензиногена в 174 положении (OR=2.67), генотипа CC гена ангиотензиногена в 235 положении (OR=2.67), по сравнению с контрольной группой (рис 1).
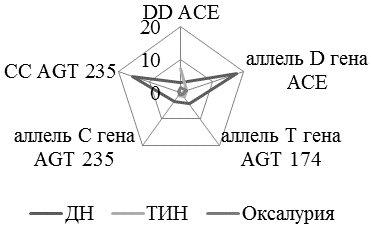
Рис. 1. Генотипы (аллели) изученных генов, ассоциированные с развитием тубулоинтерстициальных поражений почек у детей основных групп (OR).
Заключение. Таким образом, проведенный анализ свидетельствует о достоверной ассоциации полиморфизма генов ренин-ангиотензин-альдостероновой системы с развитием ТИПП. У обследованных детей выявлено достоверно значимое повышение частоты встречаемости генотипа DD гена ангиотензипревращающего фермента, генотипа ТТ гена ангиотензиногена 174 и генотипа CC гена ангиотензиногена 235. При расчете относительного риска установлены достоверные ассоциации генотипа DD и аллеля D гена ACE, аллеля T гена AGT 174, а также генотипа СС и аллеля С гена AGT 235 с развитием ТИПП у обследованных детей. Таким образом, выявление данных генотипов и алеелей можно рассматривать в качестве прогностически информативного генетического маркера предрасположенности к развитию и прогрессированию ТИПП у детей дошкольного возраста. Можно предложить тестирование этих полиморфных генов наряду с клиническими и лабораторными методами, как один из реальных путей выявления лиц с повышенным наследственным риском ТИПП.
