Введение. Дисфункция эндотелия (ДЭ) в последнее время рассматривается не только как составная часть патологического процесса, но и как первичный пусковой механизм формирования многих заболеваний, отягощающий их дальнейшее течение [1,2]. ДЭ относят к числу независимых факторов развития акушерско-гинекологических заболеваний и интегральной характеристики структурно-функционального состояния эндотелия. ДЭ проявляется в нарушении регуляции тонуса сосудов (вазодилатация, вазоконстрикция), анатомического строения сосудов (ремоделирование / ингибирование факторов пролиферации), гемостатической функции (синтез и ингибирование факторов фибринолиза и агрегации тромбоцитов) и местном воспалении (выработка про- и противовоспалительных факторов) [3,4].
Решающую роль в регуляции сосудистого эндотелия играет оксид азота (NO) – эндогенный регулятор физиологических процессов, роль которого в акушерстве и гинекологии активно изучается в последние годы [5,8,10].
В организме человека NO образуется из аминокислоты L-аргинина при участии фермента NO-синтазы (NOS). Семейство NOS включает три основные изоформы – нейрональную (nNOS, или NOS-I), индуцибельную (iNOS, или NOS-II) и эндотелиальную (еNOS, или NOS-III). В ходе синтеза NO образуется несколько альтернативных продуктов, в том числе свободных радикалов, активных форм кислорода, в том числе цитостатического, цитотоксического пероксинитрита (ONO-2) [10,16]. В зависимости от условий в результате синтеза NO могут преобладать токсичные продукты. Высокие концентрации NO, а также реактивные продукты оказывают прямое токсическое влияние, усугубляя отрицательное ионотропное действие NO. При этом страдает функция митохондрий, активизируется апоптоз эндотелиальных и сосудистых клеток. ДЭ является важным фактором формирования ряда патологических состояний и нарушений репродуктивной системы женщин [6].
С нарушениями функции эндотелия связано снижение иммунитета, нарушение функций ЦНС, нейроэндокринной системы, устойчивости к повреждающим воздействиям и защитных эффектов адаптации организма [7,8,10]. Выявлена зависимость продукции гормонов гипофизарно-яичниковой системы от уровня в организме женщин NO [9,11]. Вместе с тем, изучению функции эндотелия в условиях клиники у девочек-подростков с задержкой полового развития до сих пор уделялось недостаточное внимание. В настоящее время для оценки функции эндотелия, наряду с изучение в биологических системах (крови, семенной жидкости, слюне, моче) NO используют пробу с реактивной постокклюзионной гиперемией, в основе которой лежит расширение диаметра артерии в ответ на увеличение скорости тока крови, приводящего к увеличению напряжения сдвига, воздействующего на эндотелий [12,14]. Проба с реактивной гиперемией позволяет установить не только степень ДЭ, но и выявить обусловливающие ее факторы.
Цель исследования – оценка состояния функции эндотелия у девочек-подростков в зависимости от степени задержки полового развития.
Материал и методы исследования. В исследовании принимали участие 134 девочки-подростки в возрасте от 12 до 17 (15,3±1,18) лет, в том числе 30 с задержкой полового развития (ЗПР) I степени, 35 – со II и 34 с III степенью. У обследованных оценивали физическое и половое развитие, функциональное состояние репродуктивной системы, выделяя стадии полового развития согласно классификации J.M. Tanner [15]. Анализировали также данные ультразвукового исследования гениталий, молочных желез. В исследование не брали девочек с ЗПР с кариозными и воспалительно-деструктивными заболеваниями пародонта, острыми и хроническими заболеваниями сердечно-сосудистой системы, желудочно-кишечного тракта, печени, легких, почек, эндокринными и психическими заболеваниями.
Оценку NO-системы проводили путем определения в нативной слюне основных стабильных метаболитов NO (NO2- и NO3-) спектрофотометрическим методом на СФ-46 (Россия) с использованием реактивов Грейса [6]. Для исключения влияния на состав слюны принятой пищи забор ее осуществляли в утренние часы, натощак. Предварительно испытуемым предлагали 2 раза прополоскать ротовую полость теплой кипяченой водой.
Эндотелийзависимую вазодилатацию (ЭЗВД) с артериальной окклюзией на плечевой артерии проводили под контролем ультразвукового сканера GE Logic 700 pro фирмы «Book General Electric» (CША). Диаметр плечевой артерии и линейную скорость кровотока оценивали с помощью линейного датчика с частотой 5-10 мГц по методике D. Celemaior [13]. До начала исследования девочки лежали на спине в покое не менее 10 мин. Плечевая артерия (ПА) пережималась манжеткой сфигмоманометра до прекращения кровотока на 3,5-4 мин. После 3-4-минутной экспозиции быстрым сбрасыванием воздуха из манжетки восстанавливали кровоснабжение конечности и повторно измеряли диаметр артерии и скорость кровотока в ней. Потокозависимая дилатация как характеристика ЭЗВД рассчитывалась как отношение разницы диаметра плечевой артерии (ΔД), полученной при измерении диаметра после реперфузии (Д2) и в спокойном состоянии (Д1)-Д1-Д2, к диаметру артерии в покое (Д1). Дилатация выражалась в процентах от исходного диаметра, условно принятого за 100%.
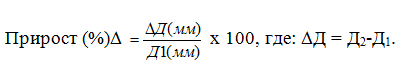
Потокозависимое изменение диаметра сосуда (ΔД) при возросшем напряжении сдвига и деформации эндотелия, обусловленные градиентом скорости и объемом протекающей крови, объясняется выбросом эндотелиальной выстилки артерии эндогенных релаксирующих факторов (NO), что в нормальных условиях приводит к расширению сосуда по сравнению с его первоначальным диаметром (Д1). Нормальной реакцией принято считать дилатацию артерии на фоне реактивной гиперемии более чем на 10% от исходного диаметра (Д1), меньшее или большее ее значение считалось патологическим. Контролем служили данные 20 девочек-подростков без видимых нарушений полового и физического развития.
Статистическую обработку результатов проводили с применением пакета Statistica for Windows, v.6 включая описательные методы и корреляционный анализ. Достоверными считали результаты при р<0,05.
Полученные результаты и их обсуждение. У девочек-подростков с ЗПР отмечаются значительные нарушения эндотелиальной функции, о чем свидетельствуют повышение концентрации NO в нативной слюне. С увеличением степени ЗПР экспрессия NO динамично возрастает (рис.1). У девочек с ЗПР I степени концентрация NO превышала контроль на 9,0% (р<0,05), II степени – на 18,3% (р<0,05), III степени – на 37,0% (р<0,05). Необходимо отметить, что уровень NO в слюне девочек с ЗПР II степени существенно не отличался от уровня NO у девочек с ЗПР I степени.
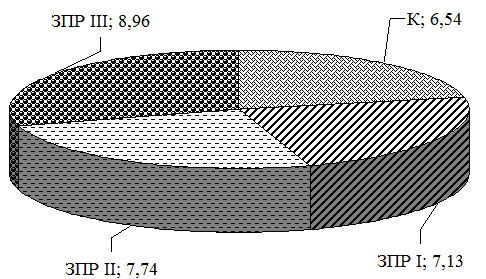
Рис. 1. Уровень NO (мкмоль/л) в слюне у девочек-подростков с различной степенью ЗПР
Вместе с тем у девочек с ЗПР III степени содержание NO в слюне было выше, чем у девочек с ЗПР I степени на 25,7% (р<0,01), а по сравнению с этим показателем у девочек с ЗПР II степени на 15,8% (р<0,05).
Проба с реактивной гиперемией была проведена у пациенток всех групп. Исходный диаметр плечевой артерии в группах был сопоставим, в среднем составляя 3,3 мм. В контрольной группе прирост диаметра плечевой артерии на 3-й секунде реактивной гиперемии соответствовал норме – 10,3% (р<0,002). В группах девочек с ЗПР I, II и III степени диаметр плечевой артерии был существенно ниже исходных показателей соответственно на 9,1 (р<0,01); 17,9 (р<0,01) и 27,8% (р<0,01), а по сравнению с контролем на 17,3 (р<0,01); 25,5 (р<0,001) и 35,5% (р<0,001) (табл. 1).
Выявление ЭЗВД более или менее 10% показало, что у 17 (85%) контрольной группы он был в пределах нормы, а у 1 (5%) и 2 (10%) девочек – соответственно выше и/или ниже нормы.
Следовательно, по показателям ЭЗВД ответа плечевой артерии на реактивную гиперемию, по меньшей мере, 15% девочек контрольной группы нельзя признать полностью здоровыми. Среди девочек-подростков с ЗПР I, II и III степени ЭЗВД менее 10% встречалась соответственно у 27 (90,0%), 32 (91,4%), 32 (94,1%), у остальных превышала 15%. Между степенью экспрессии NO и показателями ЭЗВД имелась обратная сильная корреляционная зависимость. У девочек с ЗПР I, II и III степени этот показатель составил соответственно -0,84; -0,89 и -0,93 (р<0,001).
Таблица 1. Динамика ЭЗВД у девочек с различной степенью ЗПР, M±m
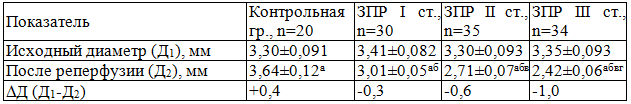
Примечание: р<0,05: а – по сравнению с исходным; б – по сравнению с контролем; в – по сравнению с ЗПР I ст., г – по сравнению с ЗПР II ст.
Учитывая это, можно признать, что высокий уровень NO в нативной слюне у девочек с ЗПР связан с функциональными нарушениями ЭЗВД и, как следствие, склонностью сосудов к вазоконстрикции, то есть гемодинамическим нарушениям.
При изучении диагностической ценности ЭЗВД установлено, что чувствительность метода (отношение числа истинно положительных результатов к общему числу обследованных девочек в группах) у девочек с ЗПР I, II и III степени составила соответственно 40,0, 36,0 и 37,0%, специфичность (отношение числа истинно отрицательных результатов к числу девочек без данного заболевания) – соответственно 93,3; 94,3 и 97,0%, диагностическая и прогностическая точность (отношение числа истинно положительных результатов к числу всех результатов) – 92,0; 92,7 и 94,4%.
Таким образом, у девочек с ЗПР отмечаются выраженные функциональные нарушения со стороны эндотелия, подтвержденные значительным увеличением в нативной слюне концентрации NO, снижением дилатации артерии при проведении компрессионной пробы, что указывает на вовлечение эндотелиальной выстилки сосудов при ЗПР и разном характере реактивности сосудистого эндотелия артериального русла у девочек с ЗПР. Сосудистый эндотелий является динамически изменяющейся поверхностью, который реагирует на различные как локальные, так и системные стимулы; фенотипические превращения (дисфункциональное состояние) могут быть патогенным фактором риска нарушений физического и полового развития у девочек. Неравнозначность реакции эндотелия в ответ на локальную ишемию была обусловлена, по-видимому, последовательным снижением чувствительности эндотелиального слоя резистивных сосудов к гидродинамическим сдвигам и формированием патологической системы регуляции сосудистого тонуса. Утрата способности реагировать на гидродинамические колебания, в первую очередь в связи с гормональными сдвигами, приводила к усилению метаболической зависимости функции эндотелия от уровня NO и рассогласованию процессов его выработки эндотелиальными клетками. В связи с этим структурно-функционально измененный эндотелий приобретал черты патологической детерминанты и определял экспансию патологической системы в целом, особенно у девочек с ЗПР III степени.
Неинвазивные методы могут служить диагностическим и прогностическим тестом оценки состояния функций сосудистого эндотелия, их роли в патогенезе и прогрессировании ЗПР.
Полученные нами данные отражают распространенность процесса и косвенно позволяют судить о состоянии эндотелия в зависимости от степени ЗПР у девочек-подростков. Кроме того, степень ЭД необходимо учитывать при выборе комплекса профилактических мероприятий и лечения.
Выводы
1. Определение уровня NO и ЭЗВД является информативным, высокоспецифичным диагностическим и прогностическим тестом оценки ЭД у девочек-подростков в динамике формирования ЗПР.
2. Выявление ЭД на основании повышения содержания NO в нативной слюне и снижения реактивности артерии по пробе ЭЗВД является прогностическим маркером неблагоприятного течения ЗПР, что следует учитывать при разработке тактики профилактических мероприятий и подборе терапии.
3. ЭД при ЗПР ассоциируется с высоким содержанием NO в нативной слюне и низким показателем ЭЗВД и является наиболее выраженным у девочек с ЗПР III степени.
