Актуальность. Когнитивная дисфункция, поведенческие расстройства, судороги и двигательные расстройства – общие осложнения менингита у взрослых и детей [8]. По последним данным Европейской федерации неврологических сообществ в европейской популяции у 15-20% больных с менингитом возникает инсульт, а у 5-10% - тромбоз венозных синусов. У 25-30% больных наблюдаются психические расстройства (астения, нарушение сна, эмоциональные расстройства и др.). Некоторые пациенты после болезни имеют постоянные расстройства зрения, вызванные оптической атрофией от оптикохиазмального арахноидита, персистирующей гидроцефалии или в результате корковой слепоты [2].
Поэтому, очень важным и актуальным вопросом на данном этапе есть изучение патогенетических механизмов, которые берут участие в повреждении нервных клеток при менингите и формировании осложнений со стороны центральной нервной системы (ЦНС).
Поражение ЦНС при различных патологиях возникает в результате множества сложных процессов, из которых избыточный выброс нейронами во внеклеточную жидкость нейромедиатора глутамата играет главную роль. Освобожденный глутамат стимулирует ионотрофные N-метил-D-аспартатные (NMDA) рецепторы. Чрезмерная активация этих рецепторов приводит к открытию соединенных с рецептором ионофоров, включая кальциевые каналы. В результате массивного вхождение в нейроны ионов кальция возникает активация плазматических протеолитических ферментов, которые повреждают клеточные структуры с последующей смертью нейронов через апоптоз или некроз. Соответствующие механизмы формируют основу феномена эксайтотоксичности (англ. excite - возбуждать) [4, 5, 7].
Корреляция между уровнем глутамата и тяжестью менингита с возникновением неврологических осложнений было продемонстрировано в нескольких исследованиях. Например, за данными Ma W. et al. (2003), у 70% больных на менингит с высоким уровнем глутамата наблюдались неврологические осложнения, особенно судорожный синдром. Кроме того, на степень осложнений со стороны ЦНС влияли как уровень глутамата, так и длительное сохранение его высоких концентраций в ликворе [6].
Было установлено, что концентрация глутамата в ликворе чётко коррелирует с концентрацией глутамата в сыворотке крови при острых менингитах, что достигается за счет проникновения мозгового глутамата в кровь через большой градиент концентрации и через поврежденный ГЭБ, что может использоваться для изучения влияния глутамата на течение заболевания [9].
Каскад биохимических и гистопатологических событий, вызванных ишемией, может длиться в течение многих дней и недель после того, как было вызвано повреждение [3].
Вследствие разрушения NMDA-рецепторов, образованные пептидные фрагменты рецептора (NR2-пептид) попадают в кровоток через поврежденный ГЭБ и вызывают реакцию иммунной системы с образованием специфических NR2-антител. На основе проведённых молекулярных исследований было предложено использовать NR2-пептид и NR2-антитела в качестве маркеров ишемического повреждения ЦНС [1].
Цель исследования. Исследовать наличие, выраженность и взаимосвязь механизмов эксайтотоксичности и церебральной ишемии при острых менингитах у детей, а также определить их влияние на развитие осложнений со стороны ЦНС.
Материалы и методы. Проведено диагностическое исследование образцов крови 40 детей в возрасте от 1 месяца до 18 лет, находившихся на лечении в Хмельницкой областной инфекционной больнице с 2010 по 2012 год, у которых был выявлен острый гнойный (ГМ) и серозный (СМ) менингит. Больные дети были разделены на две группы по 20 человек. Первую группу составили дети с ГМ, вторую – дети с СМ. Кроме того, нами обследовано 30 здоровых детей (контрольная группа) в возрасте от 1 месяца до 18 лет. Группы формировали с помощью случайной выборки.
Определение в сыворотке крови эксайтотоксических аминокислот - глутамата (Глу), аспартата (Асп) и глицина (Гли), проводилось методом ионообменной жидкостно-колоночной хроматографии в институте биохимии им. О.В. Паладина НАН Украины (г. Киев) у 40 больных и у 30 здоровых детей. Количественное определение антител к NR2-субъединице NMDA-рецептора в сыворотке крови определяли иммуноферментным методом (ELISA) с использованием тест-систем Gold Dot NR2 Antibody Test “Glutamat Kit” фирмы BCM Diagnostics (США) у 40 больных и у 10 здоровых детей. Исследование проводилось в лаборатории Винницкого национального медицинского университета им. Н.И. Пирогова. Образцы крови получали в 1 сутки после госпитализации и на 6-7 сутки заболевания.
Статистическую обработку результатов проводили в рамках пакета Statistica 6,0 с помощью критерия Стьюдента и 95% доверительного интервала (ДИ) для разницы средних. Корреляционный анализ проводили методом ранговой корреляции Спирмена.
Результаты исследования и их обсуждение. Анализируя данные в ходе исследования, было определено что, несмотря на лечение менингита, осложнения со стороны ЦНС определялись у 55% детей с СМ и у 65% детей с ГМ. У детей с СМ структура осложнений была следующей: судорожный синдром – 27,3%, астено-вегетативный – 63,6%, отек мозга – 18,2%, гидроцефалия – 9,0%. Структура осложнений у детей с ГМ: судорожный синдром – 23,1%, астено-вегетативный – 60%, отек мозга – 23,3%, гидроцефалия – 23,3%, парезы конечностей – 7,7%.
Приведенные данные свидетельствуют о существовании патогенетических механизмов при остром менингите, которые ведут к развитию поражения ЦНС и на которые не влияет стандартная терапия. Одним из таких механизмов может быть выделение возбуждающих нейромедиаторных аминокислот – глутамата и аспартата, лежащих в основе феномена эксайтотоксичности (ФЭ) (англ. “to excite” — возбуждать), который возникает вследствии ишемического поражения нейронов головного мозга.
Нами выявлено достоверное повышение уровней возбуждающих нейромедиаторных аминокислот в сыворотке крови детей с острыми менингитами в первые сутки заболевания, в сравнении с здоровыми детьми. Так, у здоровых детей уровень Глу составлял 45,37±16,32 мкмоль/л, у детей с ГМ он был достоверно выше, и составлял - 229,26±138,17 мкмоль/л (p<0,001) (95% ДИ, 132,89 - 234,88 мкмоль/л), у детей с СМ - 124,87±68,33 мкмоль/л (p<0,001) (95% ДИ, 53,48 - 105,51 мкмоль/л). Полученные данные свидетельствуют, что уровень Глу у детей с ГМ в 5,0 раза, а у детей с СМ в 2,7 раза был выше, чем у здоровых детей. На 6-7 сутки заболевания уровень Глу у больных с ГМ незначительно снизился до - 223,76±108,56 мкмоль/л, а у больных с СМ практически был без изменений и составлял 124,38±86,89 мкмоль/л. Оба показателя достоверно отличались от уровня здоровых детей (p<0,001) (95% ДИ, 138,06 - 218,71 мкмоль/л) и (p<0,001) (95% ДИ, 46,43 - 111,58 мкмоль/л), соответственно.
Уровень Асп у здоровых детей составлял 9,22±3,91 мкмоль/л, у детей с ГМ он был достоверно выше, и составлял 66,80±24,15 мкмоль/л (p<0,001) (95% ДИ, 48,58 - 66,57 мкмоль/л), с СМ - 46,07±19,51 мкмоль/л (p<0,001) (95% ДИ, 29,51 - 44,18 мкмоль/л). В среднем уровень Асп у детей с ГМ в 7,2 раза, а у детей с СМ в 4,9 раза был выше чем у здоровых детей. На 6-7 сутки заболевания уровень Асп у больных с ГМ и СМ незначительно снизился и составлял 64,95±29,76 мкмоль/л и 45,08±17,67 мкмоль/л, соответственно. Оба показателя достоверно отличались от уровня здоровых детей (p<0,001) (95% ДИ, 44,72 - 66,73 мкмоль/л) и (p<0,001) (95% ДИ, 29,17 - 42,54 мкмоль/л) соответственно.
Таким образом, значительное повышение уровней Глу и Асп в сыворотке крови детей с острыми менингитами свидетельствуют о наличии значительной выраженности эксайтотоксичности, что определяет его ключевую роль в развитии повреждения нейронов мозга. Кроме того, увеличение концентраций соответствующих аминокислот может свидетельствовать о степени повреждения гематоэнцефалического барьера (ГЭБ), поскольку в норме Глу и Асп не проникают в кровь через ГЭБ, а увеличение их концентраций в крови у больных с менингитом возникает за счет нейрональной фракции, которая попадает в кровь через поврежденный ГЭБ.
Уровень Гли у здоровых детей составлял 147,07±49,38 мкмоль/л, у детей с ГМ он был достоверно выше, и составлял - 353,03±130,56 мкмоль/л (p<0,001) (95% ДИ, 153,33 - 258,58 мкмоль/л), у детей с СМ - 228,15±48,41 мкмоль/л (p<0,001) (95% ДИ, 52,64 - 109,51 мкмоль/л), что свидетельствует о значительной активации и напряжении тормозных механизмов, противодействующих механизмам возбуждения. В среднем уровень Гли у детей с ГМ в 2,4 раз, а у детей с СМ в 1,5 раз были выше, чем у здоровых. На 6-7 сутки заболевания уровень Гли у больных с ГМ достоверно снижался и составлял 263,23±61,34 мкмоль/л (p<0,01) (95% ДИ, 24,50 - 155,09 мкмоль/л), а у больных с СМ увеличивался до уровня 247,74±58,14 мкмоль/л, в сравнении с первыми сутками заболевания. Оба показателя отличались от уровня здоровых детей (p<0,001) (95% ДИ, 84,56 - 147,75 мкмоль/л) и (p<0,001) (95% ДИ, 69,89 - 131,44 мкмоль/л), соответственно.
Уменьшение уровня Гли у больных с ГМ может свидетельствовать об истощении тормозных механизмов, которые противодействуют перевозбуждению нервных клеток. Увеличение уровня Гли у больных с СМ может свидетельствовать о активном противодействии тормозных механизмов процессам перевозбуждения нейронов, в противовес истощению этих механизмов при ГМ. Соответственные изменения в динамике Гли у больных с ГМ в сравнении с больными на СМ можна обяснить более высокой концентрацией возбуждающих аминокислот у больных с ГМ, что определенно может играть роль в истощении тормозных механизмов, которые не возникают при более низких концентрациях Глу и Асп у больных с СМ.
Нами выявлено достоверное повышение уровней аутоантител к фрагментам глутаматных рецепторов NR2A в сыворотке крови детей с острыми менингитами в первые сутки заболевания в сравнении со здоровыми детьми. Так, у здоровых детей уровень антител NR2A составлял 2,15±0,79 нг/мл, у детей с ГМ он был достоверно выше, и составлял 9,35±5,95 нг/мл (p<0,001) (95% ДИ, 3,29 - 11,10 нг/мл), у детей с СМ - 5,48±3,03 нг/мл (p<0,001) (95% ДИ, 1,31 - 5,34 нг/мл). В среднем, уровень Глу у детей с ГМ в 4,3 раза, а у детей с СМ у 2,5 раза были выше, чем у здоровых. На 6-7 сутки заболевания уровень антител NR2A у больных с ГМ увеличивался до уровня 9,41±5,08 нг/мл, з СМ до - 4,88±1,96 нг/мл и достоверно уровни данного класса антител отличались от уровня здоровых детей - (p<0,001) (95% ДИ, 3,92 - 10,59 нг/мл) и (p<0,001) (95% ДИ, 1,40 - 4,06 нг/мл), соответственно.
Следовательно, значительное повышение уровня аутоантител NR2A в сыворотке крови детей с менингитами в первые сутки заболевания свидетельствует о значительной выраженности церебральной ишемии, которая является основой развития ФЭ. Кроме того, рост уровня антител NR2A также может свидетельствовать о степени поражения ГЭБ, поскольку вследствии разрушения NMDA-рецептора создавшиеся ферменты рецептора попадают в кровь через повреждённый ГЭБ и вызывают реакцию иммунной системы с возникновением NR2-антител.
Достоверно высокий уровень антител NR2A на 6-7 сутки заболевания у больных с СМ и ГМ, в сравнении со здоровыми детьми, свидетельствует о продолжении церебральной ишемии и эксайтотоксичности даже в период ранней реконвалесценции.
Уровень нейромедиаторных аминокислот Глу, Асп, Гли и аутоантител NR2A у больных с ГМ достоверно превышали их уровень у больных с СМ в первые дни заболевания, что отражено в табл. 1.
Подобная тенденция для Глу и Асп наблюдалась на 6-7 сутки заболевания. Концентрация Гли значительно уменьшалась при ГМ и начинала увеличиваться у больных с СМ. Возможная причина изменений концентраций Гли была описана выше. Соответствующие уровни аминокислот и аутоантител NR2A и их динамика свидетельствовали о большей выраженности церебральной ишемии и ФЕ у больных с ГМ, что также коррелировало с большей частотой и тяжестью осложнений со стороны ЦНС у больных с ГМ.
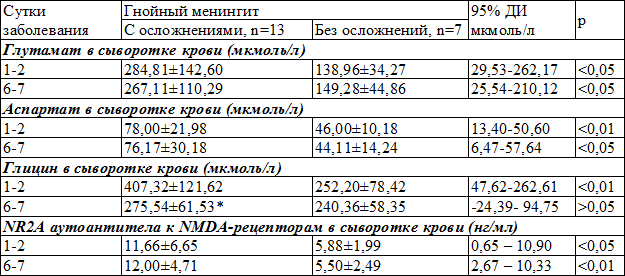
Характеризируя больных с ГМ с осложнениями и без осложнений, следует отметить, что уровень Глу в первые сутки заболевания и в динамике (6-7 сутки) достоверно был выше у больных с осложнениями со стороны ЦНС (табл. 2). Подобные изменения наблюдались и в концентрациях Асп и NR2A аутоантител.
Таким образом, разница уровней Глу, Асп и NR2A аутоантител в первые сутки заболевания и в динамике указывает на большую выраженность церебральной ишемии и эксайтотоксичности у больных с осложнениями со стороны ЦНС, в сравнении с больными без осложнений, и определяет их, как одну с основных причин возникновения осложнений со стороны ЦНС.
Таблица 1. Сравнительное содержание нейромедиаторных аминокислот, аутоантител NR2A в сыворотке крови и их динамика у детей с гнойными и серозными менингитами (M±m)

Примечание: р – достоверность разницы биохимических показателей крови (Глу, Асп, Гли, NR2A) между больными с ГМ и СМ в разные периоды заболевания; *- достоверность разницы динамики биохимических показателей крови (Глу, Асп, Гли, NR2A) у детей с ГМ
Таблица 2. Сравнительное содержание нейромедиаторных аминокислот, аутоантител NR2A в сыворотке крови и их динамика у детей с гнойными менингитами с осложнениями со стороны ЦНС и без них (M±m)
Примечания: р – достоверность разницы биохимических показателей крови (Глу, Асп, Гли, NR2A) между больными с осложнениями и без них в разные периоды заболевания; * - достоверность разницы динамики биохимических показателей крови (Глу, Асп, Гли, NR2A) у детей с осложнениями
Уровень глицина у больных с осложнениями достоверно был выше в первые сутки заболевания, в сравнении с больными без осложнений, что указывало на значительное напряжение тормозных механизмов, которые противодействуют процессам возбуждения и повреждения нейронов (табл. 2). В динамике уровень Гли снижался в обеих подгруппах, особенно в подгруппе с осложнениями (р<0,01), и на 6-7 сутки достоверно не отличался между подгруппами, что могло указывать на истощение тормозных механизмов защиты мозга, особенно у больных с осложнениями со стороны ЦНС.
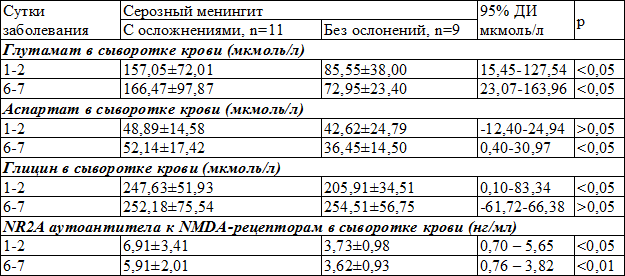
Результаты изменений нейромедиаторных аминокислот и NR2A аутоантител у больных с СМ с осложнениями и без осложнений были практически подобными к тем, что и у больных с ГМ (табл. 3).
Таблица 3. Сравнительное содержание нейромедиаторных аминокислот, аутоантител NR2A в сыворотке крови и их динамика у детей с серозными менингитами с осложнениями со стороны ЦНС и без них (M±m)
Примечания: р – достоверность разницы биохимических показателей крови (Глу, Асп, Гли, NR2A) между больными с осложнениями и без них в разные периоды заболевания
В отличие от больных с ГМ и СМ с осложнениями, у больных с СМ без осложнений, уровень глицина увеличивался, что могло указывать не на истощение, а на дальнейшую активацию тормозных механизмов защиты мозга от процессов перевозбуждения возможно через нетяжелое течение заболевания. Также наблюдалась тенденция к снижению уровней NR2A аутоантител в обеих подгруппах в отличии от больных с ГМ, что может указывать на меньшую выраженность церебральной ишемии, что сопоставимо с меньшим количеством осложнений со стороны ЦНС и их тяжестью.
В исследовании также было определено, что эксайтотоксические аминокислоты и NR2A аутоантитела имеют определенные корреляционные связи, о чем свидетельствуют данные табл. 4 и 5.
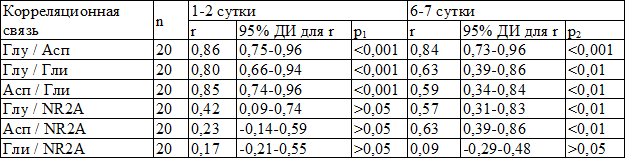
Данные табл. 4 свидетельствуют, что в первые дни заболевания у детей с ГМ наблюдалась тесная положительная связь между Глу и Асп (р<0,001), которая также прослеживалась в динамике к 6-7 суткам заболевания, что указывает на взаимопотенциирующее действие их на высвобождение друг друга. Слабую и недостоверною связь между уровнем Глу, Асп и содержанием NR2A аутоантител наблюдали в первые дни заболевания, которая достоверно увеличивалась в динамике на 6-7 сутки (р<0,01), что можно объяснить временем, которое необходимо для образование аутоантител, концентрация которых увеличивалась с первых дней и более легким течением заболевания. Сильная положительная теснота связи наблюдалась между Глу и Гли (р<0,001), а также между Асп и Гли (р<0,001), что может указывать на встречную активацию тормозных механизмов, направленных на защиту нейронов от процессов перевозбуждения, которые причиняются Глу и Асп. В динамике определялось снижение корреляционной связи между этими веществами, что могло указывать на постепенное истощение тормозных механизмов защиты мозга при последующем увеличении или стабильной концентрации Глу и Асп.
Таблица 4. Корреляционные связи между разными биохимическими показателями с использованием коэффициента ранговой корреляции Спирмена у детей с гнойными менингитами
Примечания: p1 – достоверность тесноты корреляционной связи в 1 - сутки заболевания; p2 – достоверность тесноты корреляционной связи на 6-7 сутки заболевания; r – коэффициент ранговой корреляции Спирмена
Таблица 5. Корреляционные связи между разными биохимическими показателями с использованием коэффициента ранговой корреляции Спирмена у детей с серозными менингитами
Примечания: p1 – достоверность тесноты корреляционной связи в 1 - сутки заболевания; p2 – достоверность тесноты корреляционной связи на 6-7 сутки заболевания; r – коэффициент ранговой корреляции Спирмена
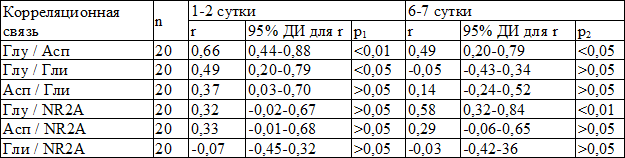
В первые дни заболевания у детей с СМ наблюдалась умеренная положительная связь между Глу и Асп (р<0,01), которая также прослеживалась в динамике к 6-7 суткам заболевания, что может указывать о взаимопотенциирующем действии на высвобождение друг друга этих медиаторов. Слабую и недостоверною связь между уровнем Глу, Асп и содержанием NR2A аутоантител наблюдали в первые дни заболевания, которая достоверно увеличивалась в динамике для Глу на 6-7 сутки (р<0,05), что можно объяснить временем, необходимым для образование аутоантител. Не наблюдалось увеличения связи в динамике между Асп и содержанием NR2A аутоантител, что возможно можно объяснить более легким течением заболевания и более низкой концентрацией Асп в сравнении с больными с ГМ. Умеренная положительная теснота связи наблюдалась между Глу и Гли (r=0,49, р<0,05), а также слабая - между Асп и Гли (r=0,37, >0,05) в первые дни заболевания, что может указывать на встречную активацию тормозных механизмов, направленных на защиту нейронов от процессов перевозбуждения. В динамике определялось снижение корреляционной связи между этими веществами. Учитывая снижение в динамике уровня Глу у больных с СМ и увеличение Гли то это могло указывать на постепенное выравнивание процессов возбуждения и торможения, что в отличии от больных на ГМ объясняется более легким течением заболевания.
Не наблюдалось корреляционной связи между Гли и NR2A аутоантителами, как в начале заболевания, так и в динамике у детей с ГМ и СМ. Поскольку Гли есть тормозной аминокислотой, а в малых концентрациях является агонистом глицинового сайта NMDA-рецептора в условиях нормального функционирования рецептора, он не принимает непосредственного участия в нейродеструктивных процессах и образовании аутоантител.
Выводы
1. Наличие высокого уровня NR2A аутоантител и их динамика у больных детей с острыми менингитами свидетельствует о развитии значительной церебральной ишемии, которая может иметь продолжительный период и определять развитие осложнений со стороны ЦНС.
2. Вследствии ишемического повреждения тканей мозга возникает избыточный выброс нейронами во внеклеточную жидкость возбуждающих нейромедиаторных аминокислот - глутамата и аспартата, которые формируют основу феномена эксайтотоксичности, что приводит к дополнительному повреждению нейронов мозга. Высокие уровни Глу и Асп у больных с острыми менингитами определяют тяжесть повреждения структур головного мозга и свидетельствуют о значительном вкладе механизмов эксайтотоксичности в развитии неврологических осложнений в процессе заболевания.
3. Дополнительным фактором, играющего роль в повреждении нейронов от эксайтотоксичности, может являться быстрое истощения тормозных механизмов защиты мозга, противодействующих процессам перевозбуждения, медиаторами которых есть, преимущественно, глицин и ГАМК.
4. Уровни NR2A аутоантител и эксайтотоксических аминокислот в крови у больных с острыми менингитами имеют корреляционные связи между собой, что свидетельствует о наличии общего патогенетического механизма приводящего в конце к развитию нейродеструкции.
