Введение. В научной разработке проблемы часто и длительно болеющих респираторными заболеваниями детей (ЧДБД), особенно раннего возраста, в настоящее время актуальным является поиск механизмов возникновения у детей напряженности процессов иммунного реагирования с разработкой способов их безопасной коррекции. Наиболее перспективным является подход, согласно которому дисфункция иммунной системы у этого контингента детей рассматривается не изолированно, а в рамках нарушения адаптационной стратегии организма ребенка в целом [1].
При таком подходе нарушения антиинфекционной резистентности у ЧДБД расценивают как проявление дезадаптации детского организма и считают следствием транзиторных, функциональных изменений системы иммунитета, развивающихся на фоне динамической дезинтеграции нейроэндокринной и иммунной систем детского организма, возникающей под влиянияним неблагоприятных факторов, которые приводят к развитию тканевой гипоксии, активации процессов перекисного окисления липидов и другим сдвигам в гомеостазе [2,3]. В связи с чем, интересно направление научного поиска способов восстановления нарушенных взаимоотношений иммунной и нейроэндокринной систем, что позволит повысить адаптационные возможности организма ребенка и снизить респираторную заболеваемость.
Основным направлением в реабилитации ЧДБД в настоящее время является использование препаратов иммуномодулирующего типа. Однако при таком подходе дисфункция иммунной системы корректируется без учета механизмов, приведших к ее возникновению [4]. На наш взгляд, при проведении оздоровления ЧДБД следует сконцентрировать внимание на том, что дезадаптация детского организма, проявляющаяся в склонности ребенка к частым острым респираторным заболеваниям (ОРЗ) и длительному их течению, всегда затрагивает несколько звеньев адаптивного ответа. Поэтому реабилитация этого контингента детей должна быть комплексной и направленной на устранение управляемых факторов риска, что создаст оптимальные условия для развития основных адаптационных систем организма ребенка.
Современные научные данные позволяют считать, что при формировании у детей в раннем возрасте дисбиозов толстого кишечника и ротоглотки нарушается генетически детерминированная программа созревания адаптационных систем детского организма и их интеграция, истощаются резервные возможности его иммунной системы, развивается дестабилизация гомеостаза, снижается колонизационная резистентность биотопов, что отражается на развитии ребенка и его заболеваемости [5-7]. В связи с чем, для реабилитации ЧДБД раннего возраста перспективным является применение методики, основанной на комплексной и длительной коррекции микроэкологического статуса ребенка, что позволяет физиологично воздействовать на все механизмы адаптации через нормализацию состава симбионтной микрофлоры кишечника и ротоглотки.
Целью исследования явилось повышение эффективности лечебно-реабилитационных программ для ЧДБД раннего возраста на основании применения микроэкологического подхода.
Материалы и методы. На базе Школы респираторного здоровья, организованной совместно кафедрой пропедевтики детских болезней Ростовского государственного медицинского университета и МБУЗ «Детская городская больница №2» г. Ростова-на-Дону, проводилось наблюдение и обследование 29 детей раннего возраста из группы часто и длительно болеющих респираторными заболеваниями.
Повторные ОРЗ у всех детей, вошедших в исследование, протекали с поражением верхних дыхательных путей, преимущественно в виде ринофарингита. Среди них 14 (48,3%) детей были в возрасте от 1года до 2 лет и 15 (51,7%) в возрасте от 2 до 3 лет. У всех пациентов было выполнено исследование состава просветной микрофлоры толстого кишечника и микрофлоры ротоглотки стандартным микробиологическим методом с выделением аэробных и анаэробных микроорганизмов в период клинического благополучия, через 3 и более недель после последнего эпизода ОРЗ. Кроме того, определяли присутствие антигенов адено-, рео- и ротавирусов в фекальном материале и антигенов адено- и реовирусов в мазках со слизистой оболочки ротоглотки с использованием реакции непрямой гемагглютинации с коммерческими тест-системами «Аденотест», «Реотест» и «Ротатест». Повторное обследование всех детей было проведено через год.
Статистическую обработку данных проводили с использованием пакета прикладных программ Statistica 6.0 с вычислением средних значений и среднего квадратического отклонения. Достоверность различий определяли с помощью параметрических (Стьюдента) и непараметрических (Манна-Уитни) критериев.
Результаты и обсуждение. При проведении объективного исследования у 44,8% ЧДБД выявлено дисгармоничное физическое развитие за счет дефицита массы тела I степени. У всех детей обнаружена лимфоаденопатия, с преимущественным увеличением шейной группы лимфатических узлов (до IVстепени). В 89,7% случаев в ходе осмотра выявлена гипертрофия небных миндалин I степени, в остальных случаях - II степени. Клинические проявления кишечной дисфункции регистрировалась у 49,6% ЧДБД. При этом в 24,1% случаев выявлена склонность к диарейному синдрому с появлением в каловых массах непереваренных комочков, слизи и зелени, резкого неприятного запаха, а в 25,5% случаев наблюдалась склонность к запорам спастического характера. У 17,2% пациентов наблюдались клинические проявления атопического дерматита в виде зудящих эритематозно-папулезных высыпаний различной локализации и степени распространенности.
Пациенты за год, предшествовавший обследованию, перенесли от 7 до 10 эпизодов ОРЗ (табл. 1).
Таблица 1. Характеристика респираторной заболеваемости ЧДБД до и после лечения
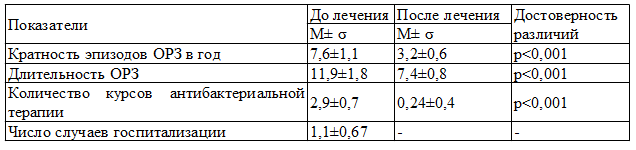
ОРЗ у всех детей протекали длительно (10-14 дней) и характеризовались длительно сохраняющимися катаральными симптомами (гиперемия слизистой оболочки ротоглотки, отделяемое из носа слизистого и слизисто-гнойного характера, влажный кашель) на фоне фебрильной температуры в течение 2-3 дней и выраженного интоксикационного синдрома в первые дни болезни с изменением поведения ребенка, сна, аппетита. Соответственно необходимость в применении антибактериальных препаратов возникала от 2 до 5 раз в год.
В результате проведенного микробиологического исследования установлено, что у всех детей наблюдались дисбиотические изменения в составе микрофлоры толстого кишечника. В большинстве случаев выявлен дисбиоз кишечника III степени (65,5%), в 34,5% случаев – II степени.
Анализ качественных изменений состава кишечной микробиоты показал, что в 100% случаев отмечался умеренный дефицит бифидобактерий (табл. 2).
Количество лактофлоры было нормальным у большей части пациентов (79,4%). Наиболее выраженные нарушения в облигатной микрофлоре обнаружены со стороны эшерихий. Типичные E. coli отсутствовали в 44,8% случаев, в то же время у 75,9% детей выделяли лактозонегативные эшерихии и у 27,6% - E. coli с гемолитической активностью. При наличии у детей дисбиоза кишечника III степени в составе микробиоценоза с одинаковой частотой (26,3%) регистрировали 3-х и 5-и компонентные ассоциации условно-патогенных микроорганизмов (УПМ), а в большинстве случаев (47,4%) – 4-х компонентные. С наибольшей частотой (26,3%) присутствовали ассоциации, состоящие из лактозонегативных эшерихий, клебсиелл и золотистого стафилококка. Несколько реже (в 21,1% случаев) выявляли 4-х компонентные ассоциации вышеперечисленных микроорганизмов с грибами рода Candida. При II степени дисбиоза кишечника у 60% детей встречались в основном разнообразные 2-х компонентные ассоциации УПМ и в 40% случаев 3-х компонентные ассоциации лактозонегативных эшерихий, золотистого стафилококка и дрожжеподобных грибов рода Candida.
Таблица 2. Характеристика микробиоты кишечника ЧДБД до и после лечения
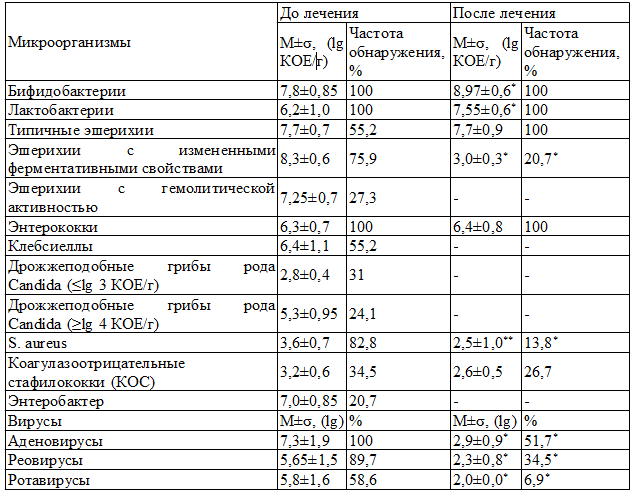
Примечание: здесь и далее * - p<0,001, ** - p<0,01, *** - p<0,05
Антигены аденовирусов обнаружены в фекалиях пациентов в 100% случаев. Инфицированность реовирусами кишечника ЧДБД отмечалась в 89,7% случаев. Ротавирусы были выявлены у половины пациентов.
При анализе результатов исследования микрофлоры ротоглотки (табл.3) было установлено, что в случаях обнаружения у обследованных ЧДБД дисбиоза кишечника III степени микрофлора ротоглотки у них была представлена 6-,7- и 8-компонентными ассоциациями симбионтных микроорганизмов в 44,4%, 38,9% и 16,7% случаев соответственно. В подавляющем большинстве ассоциаций регистрировали присутствие 3 представителей резидентной микрофлоры (коагулазоотрицательные стафилококки (КОС), пептострептококки, α-гемолитические и негемолитические стрептококки, а также нейссерии).
Факультативная микрофлора ротоглотки у этих детей была представлена 3 – 4, гораздо реже 5 симбионтами. Из них наибольший удельный вес имели S. aureus, энтерококки, коринеформные бактерии, фузобактерии и пиогенный стрептококк. Также необходимо отметить, что только на фоне дисбиоза кишечника III степени в составе микробных ассоциаций ротоглотки у пациентов обнаруживали кишечную палочку в 44,4% случаев. При II степени дисбиоза кишечника у ЧДБД микробиоценоз ротоглотки был представлен 5- и 6-компонентными ассоциациями микробов-симбионтов в 36,4% и 63,6% случаев соответственно.
Таблица 3. Характеристика микробиоты ротоглотки ЧДБД до и после лечения
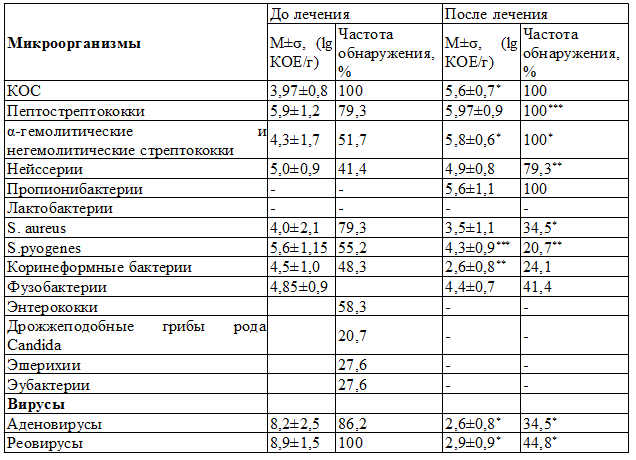
Ассоциации симбионтных микроорганизмов включали преимущественно 2 представителей облигатной флоры (КОС и пептострептококки, реже КОС и резидентные стрептококки). Нейссерии присутствовали лишь в 9,1% случаев (против 50% при дисбиозе кишечника III степени). Факультативная микрофлора была представлена 3-4 ассоциантами с наибольшим удельным весом S. aureus и S.pyogenes. Реже в ассоциациях присутствовали энтерококки и эубактерии. Антигены аденовирусов обнаружены в составе микробиоты ротоглотки у обследованных пациентов в 86,2% случаев. Реовирусы присутствовали в составе микробиоты ротоглотки у всех ЧДБД раннего возраста.
Таким образом, у детей с дисбиозом кишечника III степени склонность к повторным ОРЗ возникала, в связи со значимым негативным воздействием токсинов УПМ кишечника, вызывающих гиперстимуляцию и истощение мукозальной иммунной системы, дестабилизацию гомеостаза и дезинтеграцию нейроэндокринной и иммунной систем. Кроме того, с высокой частотой (52,6%) обнаруживали трехкомпонентные ассоциации вирусов при высокой концентрации вирусных антигенов, что свидетельствует об активации вирусов и представляет опасность для организма ребенка в связи с выраженным иммуносупрессивным действием этих патогенов. Более того, у ЧДБД с III степенью дисбиоза кишечника наблюдались значительные дисбиотические сдвиги в составе микробиоты ротоглотки в виде дефицита резидентных симбионтов, увеличения уровня и частоты встречаемости факультативных микроорганизмов (S. aureus, S.pyogenes, коринебактерии, фузобактерии), в том числе несвойственных данному биотопу эшерихий, а также реовирусов в высокой концентрации. Такой состав микробиоценозов обусловливает выраженное снижение колонизационной резистентности слизистой оболочки верхних дыхательных путей и нарушения иммунной функции лимфоидного кольца глотки [8,9]. Повышенная респираторная заболеваемость у пациентов с дисбиозом кишечника II степени в большей степени связана с неблагополучием в составе микробиоты ротоглотки. Нестабильность состояния этого биоценоза заключалась в видовом дефиците облигатных симбионтов (в подавляющем большинстве случаев отсутствие 4 представителей этой группы) на фоне обнаружения преимущественно 3-4 видов факультативных микроорганизмов с доминированием S. aureus (81,8%) и S.pyogenes (63,6%), а также реовирусов в значительной концентрации. Такие патологические микробиоценозы бесспорно способствуют возникновению склонности к повторным ОРЗ.
С целью повышения адаптационных возможностей и уровня резистентности каждому ребенку была назначена индивидуальная и дифференцированная лечебно-реабилитационная программа на основании результатов его клинического, лабораторного, микробиологического и вирусологического обследования. Соответственно основу программы составили мероприятия по комплексной коррекции выявленных у пациента нарушений в составе микроэкологического статуса:
1. лечебное питание;
2. селективная деконтаминация УПМ в микробиоте толстого кишечника и ротоглотки в сочетании с энтеросорбцией;
3. восстановление нормальной микробиоты организма;
4. поддерживающая терапия.
При организации диетотерапии в ежедневный рацион питания ЧДБД рекомендовали включать кисломолочные продукты, содержащие штаммы микроорганизмов, официально отнесенных к пробиотическим (бифидобактерии, лактобактерии, молочнокислые стрептококки и кефирный грибок). Особо обращали внимание родителей на целесообразность сочетания в диете ребенка различных видов кисломолочных продуктов. Это связано с тем, что продукты данного класса, изготовленные с применением разных штаммов пробиотических микроорганизмов, неодинаково влияют на состав микробиоценоза кишечника.
Также в диету детей включали продукты, имеющие в своем составе пребиотики (пищевые волокна, фруктоолигосахариды, инулин, пектин), овощи и фрукты. Учитывая, что ряд овощей, фруктов и ягод обладают антимикробной активностью [10], в питании ЧДБД раннего возраста рекомендовали использовать различные их сочетания (в свежем виде, в виде соков, компотов, морсов), в зависимости от видового состава УПМ, обнаруженных в составе микробиоты кишечника и ротоглотки у данного ребенка. При наличии у детей пищевой аллергии назначалась индивидуальная гипоаллергенная диета, которая также включала продукты, способные оказывать положительное влияние на микроэкологический статус ребенка, но с учетом индивидуальной переносимости.
Одновременно с диетотерапией осуществлялась медикаментозная коррекция выявленных у ЧДБД дисбиотических нарушений в микробиоте обоих биотопов. На первом этапе медикаментозной коррекции мы проводили селективную деконтаминацию – подавление условно-патогенных бактерий, грибов и вирусов в толстом кишечнике и ротоглотке с использованием кишечных антисептиков, бактериофагов (по результатам исследования чувствительности), бактерий с антагонистической активностью, противогрибковых и противовирусных препаратов. Следует отметить, что селективная деконтаминация осуществлялась в несколько этапов с применением всех перечисленных групп препаратов в определенной последовательности (в зависимости от выявленных микроэкологических нарушений) в комплексе с энтеросорбцией. Для орошения ротоглотки применяли раствор хлорофиллипта, ромазулана, сангвиритрина (7-10 дней). Продолжительность этого этапа реабилитации – 1 месяц.
Восстановление нормальной микробиоты организма осуществлялось путем длительного применения (не менее 1 месяца) пробиотиков на основе бифидобактерий. Для орошения ротоглотки применяли нормофлорин Л. Параллельно осуществлялась коррекция тканевого метаболизма с помощью препарата карнитина. После окончания курса приема пробиотиков рекомендовали применение пребиотиков в течение 3 месяцев. Продолжительность II этапа реабилитации составила 4 месяца.
Таким образом, на I этапе реализации лечебно-реабилитационных программ для ЧДБД мы осуществляли воздействие на микробиоту обоих биотопов с целью достижения как можно более полной элиминации из организма ребенка УПМ с выраженным патогенным и персистентным потенциалом, а также вирусов. В дальнейшем основные усилия были направлены на нормализацию состава микробиоценоза толстого кишечника - главного биотопа человеческого организма, от состояния которого зависит состав микробиоты других биотопов. Под действием сигнальных метаболитов нормальных симбионтов кишечника и вводимых извне пробиотических бактерий происходит восстановление функциональной активности иммунокомпетентных клеток лимфоидной ткани, ассоциированной с желудочно-кишечным трактом, что, в свою очередь, благодаря хоуминг эффекту приводит к восстановлению у ребенка местной иммунной защиты и колонизационной резистентности верхних дыхательных путей.
Динамическое наблюдение за ЧДБД осуществлялось в течение года. После окончания основного этапа лечебно-реабилитационной программы назначали поддерживающую терапию. Курсы поддерживающей терапии продолжительностью 1 месяц рекомендовали проводить неоднократно. Обязательным их проведение было весной и осенью, а также после перенесенных ОРЗ. Поддерживающая терапия включала 3 курса: 1 курс - кипферон (5 дней) и лизобакт (7 дней); 2 курс - пробиотик на основе бифидобактерий в поддерживающей дозе (1/3-1/2 от полной терапевтической дозы) в один прием и витаминоминеральные комплексы (1 месяц), пребиотик (3 месяца). Кроме того, только на этапе поддерживающей терапии, 3 курсом, после ликвидации избыточной антигенной нагрузки, которую оказывает на мукозальную иммунную систему микробиота толстого кишечника и ротоглотки с нарушенным составом, рекомендовали применение бактериальной вакцины – рибомунил по общепринятой схеме (осенью).
Оценка физического развития пациентов, проведенная в динамике, не выявила нарушений в этом критерии здоровья детей. При исследовании периферических лимфатических узлов в 2 раза уменьшилась частота обнаружения лимфоаденопатии. Только в 41,4% случаев наблюдалось увеличение переднешейных и подчелюстных лимфатических узлов до IV степени (p<0,001). Однако заднешейные лимфатические узлы у детей при повторном обследовании не пальпировались. При фарингоскопии в 100% случаев выявляли гипертрофию небных миндалин I степени. Увеличение небных миндалин I степени часто встречается и у здоровых детей этой возрастной группы, при этом оно рассматривается как физиологическое явление. Следует отметить, что в результате диетотерапии и проведенной коррекции микроэкологического статуса была достигнута стойкая ремиссия атопического дерматита у 17,2% детей, имевших клинические проявления этого заболевания до начала реабилитации. Значительно уменьшилась частота регистрации клинических проявлений кишечной диспепсии. Только у небольшого числа детей периодически наблюдались запоры спастического характера (10,3%) или разжижение стула (6,9%).
Анализ респираторной заболеваемости ЧДБД за прошедший год выявил выраженную положительную динамику (табл.1). Среднегодовая частота ОРЗ снизилась в 2 раза при достоверном уменьшении средней продолжительности эпизодов респираторных инфекций. При этом заболевания протекали с кратковременной и быстро купирующейся температурной реакцией, умеренно выраженными симптомами интоксикации. Катаральные симптомы сохранялись не более 10 дней. Необходимость в применении антибактериальных препаратов возникала у 24,1% пациентов, не более 1 курса в год. Лечение ОРЗ осуществлялось в амбулаторных условиях.
Повторное микробиологическое исследование состава просветной микрофлоры толстого кишечника показало, что в подавляющем большинстве случаев (86,2%) было достигнуто эубиотическое состояние кишечного микробиоценоза. Только в 13,8% случаев был выявлен дисбиоз кишечника I степени. Достоверно увеличился уровень бифидо- и лактобактерий (p<0,001), типичные эшерихии обнаружены в 100% случаев, уменьшились частота обнаружения и удельный вес лактозонегативных эшерихий, S.aureus (p<0,01), вирусов (p<0,001) (табл.2). Эшерихии с гемолитической активностью, клебсиеллы, энтеробактер, грибы рода Candida после лечения не определялись.
Восстановление после лечения нормальной кишечной микрофлоры сопровождалось выраженной положительной динамикой в составе микробиоты ротоглотки у всех пациентов. При повторном обследовании в подавляющем большинстве ассоциаций симбионтных микроорганизмов ротоглотки регистрировали присутствие всех резидентных симбионтов биотопа, и только в 20,7% случаев наблюдалось отсутствие одного из представителей этой группы микроорганизмов (табл.3). Вместе с тем, факультативная микрофлора ротоглотки после коррекции была представлена одним (82,8%), гораздо реже двумя (13,8%) и в единичном случае - тремя симбионтами. Достоверно уменьшилась частота обнаружения и уровень S.aureus, S.pyogenes, вирусов, а энтеробактерии и кандиды при повторном обследовании не были обнаружены. Соответственно после проведенной реабилитации соотношение между резидентными и факультативными микроорганизмами в микробиоценозах биотопа у ЧДБД стало соответствовать таковому у здоровых детей, что можно рассматривать как свидетельство восстановления до нормы микробиоты ротоглотки у всех детей.
Заключение. Таким образом, в результате проведенных лечебно-реабилитационных мероприятий у ЧДБД раннего возраста наблюдалось выраженное улучшение состояния здоровья в сочетании с повышением их антиинфекционной резистентности на фоне стабилизации микроэкологического статуса организма. Применение к реабилитации ЧДБД раннего возраста лечебно-реабилитационных программ на основе микроэкологического подхода привело к уменьшению частоты (в 2 раза), продолжительности (в 2-3 раза), тяжести течения у них ОРЗ, что свидетельствует об увеличении их адаптационного потенциала. Применение к реабилитации ЧДБД микроэкологического подхода, основанного на дифференцированной коррекции прогностически наиболее неблагоприятных сдвигов в составе бактериального, грибкового и вирусного компонентов микробиоценозов кишечника и ротоглотки является эффективным и позволяет вывести ребенка раннего возраста на более высокий уровень адаптации.
