Введение. Железодефицитные анемии (ЖДА) не однородны за своей природой [1], только 35-55 % анемий считаются вызванными исключительно дефицитом железа, остальные – следствие полидефицитного дисбаланса, или витаминно-минералодефицитные. В раннем детстве в периоды интенсивного роста, когда происходит формирование иммунологической реактивности [2, 3], становление внутренних органов, высокая активность обменных процессов наряду с низкой активностью ферментов, дети нуждаются в достаточном поступлении микроэлементов [4, 5]. Доказано, что дефицит железа, сопровождается снижением активности иммунной системы, даже при отсутствии анемии [6].
Дефицит микронутриентов, по мнению экспертов Всемирной организации здравоохранения – кризис в питании населения планеты ХХI столетия. При исследования современного типа питания у детей, как городских так и сельских, было сделано вывод, что в рационе преобладает дефицитный дисбаланс [3], что связано и с социально-экономической, и экологической ситуацией. Это негативно отражается на гармоничности физического и психического развития детского организма [7], ведёт к напряжении адаптационных процессов.
Проблема дефицита железа - это, прежде всего проблема питания [8, 9]. Главной причиной развития дефицита железа, согласно данным Американской академии педиатрии, считается исключительно грудное вскармливание после 4-х месячного возраста, употребление цельного коровьего молока или прикормов, бедных железом, и недостаточное потребление продуктов, природно богатых этим микроэлементом [10, 11].
Дефицит эссенциальных микроэлементов (металлов) в организме ведёт к избыточному накоплению токсических и потенциально-токсических соединений [12, 13]. Доказана обратная связь между уровнем гемоглобина в крови и концентрацией тяжёлых металлов в организме ребёнка.
Для нормального усвоения микроэлементов имеет значение не только их абсолютное число, а в большей мере сбалансированное поступление [14].
Абсорбция железа в кишечнике происходит эффективней при адекватном присутствии меди [15]. Медь необходима для синтеза гемма, ассимиляции железа с пищеварительного тракта, для высвобождения его из депо. Более 30-ти ферментов тканевого дыхания и системы антиоксидантной защиты организма медьзависимы. Доказано, что гипохромная анемия может развиваться при дефиците меди, даже при наличии железа в депо в достаточном количестве оно не сможет использоваться для синтеза гемоглобина без адекватного присутствия меди. Интересно, что концентрация меди в грудном молоке относительно стабильный показатель, малозависимый от экзогенных поступлений с продуктами питания у кормящей женщины, поэтому, у малышей на естественном вскармливании дефицит меди встречается намного реже.
Цинк влияет на процессы синтеза нуклеиновых кислот, активных веществ, рост клеток и опосредствовано влияя на кроветворение [2, 3, 16]. Кроме того, цинк входит в состав фермента карбоангидразы, который содержится преимущественно в эритроцитах и принимает участие в переносе углекислоты к легким. Установлен факт развития ЖДА при дефиците цинка. Цинк влияет на всасывание металлов в кишечнике, известно, что он является конкурентом меди при всасывании в тонком кишечнике. Описаны цинк-зависимые анемии, главными симптомами, каких являются извращение вкуса и мышечная гипотония. Эти симптомы характерны и для железодефицитной анемии.
Железо, медь, цинк и некоторые другие микроэлементы до какой-то степени имеют общие продукты в качестве пищевых источников и их сравнительно мало в цельном коровьем молоке [8, 11] – продукте, которым «злоупотребляют» при вскармливании детей раннего возраста, особенно среди сельских жителей. Дефицит одного микроэлемента может вносить дисбаланс в обмен других микроэлементов, что необходимо учитывать при выборе лечебных и реабилитационных мероприятий.
Цель исследования: исследовать уровень отдельных микроэлементов (меди и цинка) в сыворотке крови у детей раннего возраста с железодефицитной анемией.
Материалы и методы исследования. Обследовано 75 детей в возрасте от 1-го месяца до 3-х лет с железодефицитной анемией, пребывающих на стационарном лечении в гематологическом отделении Тернопольской городской детской клинической больнице. Проводилось общеклиническое исследование, биохимическое определение сывороточного железа (сж), меди, цинка, общей железосвязывающей способности сыворотки крови (ожсс), инструментальные методы исследования (ЭКГ, УЗИ внутренних органов), в случае необходимости проводился осмотр неврологом, окулистом и другими специалистами.
Общий анализ крови определялся с помощью гематологического анализатора. Биохимическим исследованием определялся уровень общего белка биуретовым методом [17], уровень сывороточного железа и общей железосвязывающей способности сыворотки крови – для подтверждения наличия железодефицита, как причины анемии и определения уровня микроэлементов (меди и цинка) в сыворотке крови фотометрическим методом [18].
Статистическая обработка результатов проводилась с использованием пакета прикладных программ STATISTICA 6.0 [19]. Обработку данных проводили с помощью стандартных методов вариационной статистики с вычислением средних величин и стандартных отклонений. Достоверность разницы двух сравниваемых показателей оценивалась по критерию Стьюдента. В качестве уровня статистической значимости было принято р<0,05.
В качестве контрольной группы отобрано 20 детей аналогического возраста, без наличия хронических и острых заболеваний на момент исследования, которые находились на вскармливании, близкому к рекомендуемому, с нормальными показателями общего анализа крови и отсутствием признаков латентной сидеропении (нормальными показателями феррокинетики). Диагноз ЖДА устанавливался в соответствии с положением Приказа №9 МЗ Украины от 10.01.2005 г. [20].
Результаты исследований. ЖДА І степени диагностирована у 24 (32 %) детей, ІІ степени – 21 (28 %), ІІІ степени – 18 (24 %) и IV степень – 12 (16 %) пациентов. Мальчиков среди обследованных с анемией больше, в сравнении с девочками: 44 (58,7 %) и 31 (41,3 %) соответственно. 29 (38,7 %) пациентов – это городские дети, в большинстве случаев страдающие легкой степенью заболевания; сельских детей обследовано 46 (61,3 %) – это в основном пациенты с тяжёлой и сверхтяжёлой анемией. Детей, в возрасте до 1-го года было 26 (34,7 %), от 1-го года до 2-х лет - 24 (32,0 %), остальные 26 (34,7 %) – от 2-х до 3-х лет. Самые частые жалобы, заставляющие родственников показать ребёнка врачу: снижение аппетита – в 25 (33,3 %) случаев, острое респираторное заболевание и повышение температуры – 17 (22,7 %), бледность кожи – 10 (13,3 %), в части детей – 9 (12,0 %) - анемию обнаружено при проведении профилактического исследования общего анализа крови в возрасте до года.
При поступлении родители жаловались на бледность ребенка, снижение аппетита, извращение вкуса (дети чаще всего ели землю, песок, бумагу, салфетки), вялость, утомляемость, раздражительность, задержку физического или психомоторного развития.
Анамнестически удалось выяснить, что 48 (64,0%) детей родились вследствие первой беременности, 24 (32,0%) - второй, остальные 9 (12,0%) - от третьей и последующих. В случае не первой беременности промежуток между предыдущей был больше 5-ти лет только в 8 (10,7%) пациентов. Физиологическое течение беременности наблюдалось у 35 (46,7%) матерей, осложнённое - в 40 (53,3%) случаев. Естественным путём родилось 66 (88,0%) детей, родоразрешение с помощью кесаревого сечения использовали у 9 (12,0%) случаев. Антенатальная профилактика анемии проводилась только в 17 (22,7%) случаев. Обращает внимание недостаточное проведение профилактических мероприятий по выявлению анемии, а именно – отсутствие профилактического общего исследования крови на первом году жизни ребёнка, только у 15 (20,0%) пациентов это обследование проводилось. Это было одной из причин позднего выявления железодефицитной анемии с тяжёлой и сверхтяжёлой степенью заболевания, особенно это характерно для негородских детей. У 12 (16,0%) детей анемию впервые диагностировано только в стационаре, где ребёнок находился в связи с другими заболеваниями, в этом числе 2 детей с тяжёлой и 1 ребёнок со сверхтяжёлой степенью анемии.
Тщательно изучались особенности вскармливания ребёнка, начиная с рождения. Питание, которое можно приравнивать к рациональному, отмечено лишь в 21 (28%) случае, в основном у детей с легким течением анемии. 6 (8%) детей с рождения находились на искусственном вскармливании, у 8 (10,7%) – заменено на искусственное уже на первом месяце жизни, 35 (46,7%) детей получали грудное молоко больше полгода, причём из них только 1 (1,3%) ребёнок с сверхтяжёлой анемией и 4 (5,3%) – с тяжёлой. В случае искусственного питания использовались простые или адаптированные смеси кратковременно, прикормы вводились с опозданием, нерегулярно. У всех детей с сверхтяжёлой анемией и большинства с тяжелой в пищевом рационе присутствовало цельное коровье молоко, или являлось основной пищей. А в остальных - доминировала молочная, молочно-растительная пища с низким или с почти отсутствующем потреблением мясных продуктов, особенно при тяжёлой и надтяжёлой анемии.
При осмотре анемический синдром отмечался у 65 (86,7%) обследуемых, сидеропенический - у 39 (52%), астено-вегетативный – у 31 (41,3%), функциональные изменения со стороны сердечно-сосудистой системы – у 73 (97,3%).
Задержку психомоторного развития выявлено у 7-ми (9,3%) детей, в том числе у 3-х детей со сверхтяжелой анемией. Дисгармоническое физическое развитие можно было наблюдать у 25 (33,3%) детей. В 17 (22,7%) пациентов с задержкой происходило прорезывание зубов. Лишний вес фиксировали у 2-х детей, вес, ниже возрастной нормы при поступлении отмечали у 11-ти (14,7%) пациентов.
В ходе обследования выявлены следующие сопутствующие заболевания: чаще всего диагностировали острые респираторные заболевания (от наличия остаточных явлений до бронхита) – у 20-ти (26,7%) пациентов, острый пиелонефрит – у 5-ти (6,7%), глистные инвазии (аскаридоз, энтеробиоз или токсокароз) – 6-ти (8%), атопический дерматит – у 5-ти (6,7%), рахит – у 6-ти (8%), гипотрофия – у 11-ти (14,7%), в этом числе у 3-х гипотрофия ІІІ степени, инфекционно-аллергическая лимфаденопатия – у 5-ти (6,7%).
Уровень гемоглобина при ЖДА І степени составлял (94,64±1,05) г/л, с последующим снижением, а при ІV степени – (42,73±1,41) г/л. Снижение уровня сывороточного железа сопровождалось ростом общей железосвязывающей способности сыворотки (табл. 1).
Таблица 1. Уровень сывороточного железа и общей железосвязывающей способности сыворотки крови у детей, (М±m)
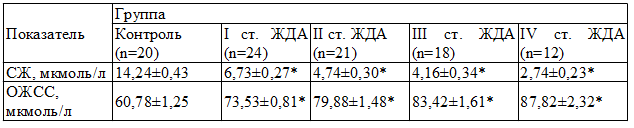
Примечание: * - р<0,001 в сравнении с контролем
Концентрация меди в сравнении со здоровыми ((13,97±0,43) мкмоль/л) в большинстве случаев была ниже: у 62,5% детей с І степенью ЖДА ((8,77±0,71) мкмоль/л); у 76,2% детей со ІІ степенью ЖДА ((9,51±0,48) мкмоль/л); у 50,0% с ІІІ степенью ЖДА (10,93±0,50 мкмоль/л) и у 75,0% детей с ІV степенью ЖДА (10,12±1,25 мкмоль/л). Как можно наблюдать с выше представленных чисел, при нарастании степени тяжести анемии наблюдалась тенденция к прогрессирующему снижению уровня меди в сыворотке крови в большинства пациентов с ЖДА.
Наблюдалась тенденция к снижению уровня цинка в сыворотке крови у большинства детей раннего возраста с ЖДА, в сравнении с здоровыми детьми (14,97±0,55 мкмоль/л) аналогичного возраста, с максимальной частотой у детей с І степенью ЖДА (11,19±0,35 мкмоль/л) - у 91,7% детей и со ІІ степенью ЖДА (10,90±0,44 мкмоль/л) - у 85,7% детей. Зависимости между этими цифрами и степенью сидеропении не прослеживается, возможно, это связано с относительно небольшой выборкой обследованных.
Нерациональное вскармливание и, как следствие, глубокий дефицит железа – основная причина дисбаланса других микроэлементов у детей. Выявление у большинства детей с ЖДА тенденции к снижению меди и цинка при дефиците железа в сыворотке крови при отсутствии корреляционной зависимости между уровнем этих металлов указывает на необходимость коррекции не только сидеропении, но и влиять на обмен меди и цинка.
Выводы. Течение ЖДА у детей раннего возраста сопряжено с дисбалансом и других микроэлементов, что может влиять на особенности развитие и возникновение иных дефицитных состояний; что в целом нарушает естественные процессы гармоничности формирования ребёнка.
