Введение. Болезни органов пищеварения занимают второе место в структуре детской заболеваемости, при этом до 70–90% из них приходятся на хронические гастриты и гастродуодениты, выявляемые у каждого третьего ребенка [6, 7, 11]. По сведениям Национального руководства по педиатрии, распространенность хронических гастритов и гастродуоденитов достигает 300–400‰ [11]. Многочисленные исследования показали, что у 70-100% детей с иммунопатологическими состояниями (ИПС - ревматическими заболеваниями, хроническим гломерулонефритом) выявляются воспалительные изменения слизистой гастродуоденальной зоны [1, 3, 5, 8-10, 13]. Следовательно, проблема диагностики и обоснования адекватной сопутствующей терапии поражения слизистой оболочки верхних отделов пищеварительного тракта у детей ИПС, является актуальной.
Цель исследования: по данным эндоскопического и функционального исследования представить характеристику изменений слизистой желудка и двенадцатиперстной кишки для обоснования медикаментозной терапии коморбидной патологии гастродуоденальной зоны у детей с иммунопатологическими состояниями.
Материалы и методы. Исследование выполнено на базе ГБУЗ «Нижегородская областная детская клиническая больница». Обследовано две группы детей школьного возраста: I группа (n=109) - больные с ИПС: ювенильные артриты (ЮА – n=61), хронический гломерулонефрит (ХГН, n=22), диффузные заболевания соединительной ткани (ДЗСТ, n=26); II группа – пациенты с хроническим гастродуоденитом (ХГД, n=109).
Исследование было рандомизированным, группы формировалась по мере поступления детей в стационар.
Критерии включения: I группа – дети школьного возраста (7-17 лет), получавшие в терапии ГКС и/или НПВП и/или ЦС, стаж заболевания более 6 мес., в данной группе эндоскопическое исследование проводили с учетом факторов риска поражения слизистой оболочки желудка (СОЖ) и слизистой оболочки двенадцатиперстной кишки (СОДПК); II группа - дети школьного возраста (7–17 лет) без ИПС и не получавшие в лечении глюкокортикостероиды (ГКС), цитостатики (ЦС), нестероидные противовоспалительные препараты (НПВП), наличие патологии верхних отделов желудочно-кишечного тракта (ЖКТ) по данным фиброгастродуоденоскопии (ФГДС).
Критерии исключения: для обеих групп - внутрижелудочная pH-метрия не проводилась детям с эрозивно-язвенными изменениями по данным ФГДС.
Диагноз основного заболевания у детей был верифицирован в соответствии с рабочими классификациями, предложенными по рекомендациям Национального руководства по педиатрии [11].
Всем детям обследование (ФГДС, внутрижелудочную pH-метрию) выполнено на основе информированного согласия на участие в исследовании. Получено разрешение локального этического комитета (протокол №8 от 24.10.2010 г).
ФГДС проводили на аппарате Exera CLV 160 фирмы “Olimpus” (Япония), утром, натощак, лежа на левом боку, эндоскопическую картину оценивали визуально. Внутрижелудочную pH-метрию — на аппарате «Гастроскан-5М» (НПП «Исток-Система», г. Фрязино, Россия) утром, натощак. Применяли 5-электродный рН-зонд. Концевой (дистальный) электрод располагали в двенадцатиперстной кишке. Четвертый электрод — в антральном отделе желудка. Третий — в теле, второй — в кардиальном отделе желудка, пятый (проксимальный) — в пищеводе. Регистрацию pH начинали после стабилизации показателей в ответ на введение зонда. В качестве стимулятора желудочной секреции использовали капустный отвар или мясной бульон. Оценку кислотообразующей и ощелачивающей функции пищевода, тела и антрального отдела желудка, двенадцатиперстной кишки осуществляли на основе сопроводительной документации к «Гастроскану-5М». Внутрижелудочную pH – метрию всем детям проводили только после проведения ФГДС.
Наличие и степень обсемененности Helicobacter pylori (Нp) определяли в мазках-отпечатках, полученных при ФГДС из биоптатов слизистой оболочки антрального отдела желудка. Степень обсемененности считалась слабой при количестве Hp до 20, средней до 50, высокой – более 50 микробных тел в поле зрения (окраска препаратов проводилась по Романовскому – Гимзе, используемое увеличение микроскопа х 360) [2].
Базу данных сформировали в СУБД FoxPro v.2.6. Статистический анализ проводили средствами пакета прикладных программ Biostatistics v. 4.03. Достоверность различий оценивали на основании анализа таблиц сопряженности и критерия Стьюдента, статистически значимым считали p≤0,05 [4].
Результаты исследования и их обсуждение. При первичном эндоскопическом исследовании у детей с ИПС (n=109) патология гастродуоденальной зоны была выявлена у 80,73% детей (n=88). Изолированный гастрит выявлен у 4,6% (n=5), изолированный дуоденит у 14,7% (n=16), гастродуоденит у 62% (n=67) пациентов I группы.
Выявлены статистически значимые различия (χ2=6,4, сс=2, p=0,04) в структуре гастродуоденальной патологии при сравнении с группой ХГД: гастродуоденит - 87% (n=94), изолированный дуоденит – 6,5% (n=7), изолированный гастрит - 6,5% (n=7).
У детей с ИПС достоверно чаще регистрировали (t=3,72, p=0,00) отсутствие изменений в СОЖ - 34% (n=37) и СОДПК - 24% (n=26), чем у детей с ХГД: СОЖ - 6,4% (n=7), СОДПК – 6,4% (n=7).
Среди пациентов трех подгрупп ИПС отсутствие изменений в СО гастродуоденальной зоны диагностировалось со следующей частотой – в СОЖ: ЮА - 21% (n=23), ХГН – 8,3% (n=9), ДЗСТ – 4,6% (n=5), в СОДПК: ЮА – 23,8% (n=18), ХГН – 3,7% (n=4), ДЗСТ – 3,7% (n=4).
Достоверных различий в структуре эндоскопических поражений СОЖ (χ2=2,5, сс=4, p=0,6): ЮА - 51,2% (n=37), ХГН - 23,9% (n=17), ДЗСТ - 24,9% (n=18) и СОДПК (χ2=5,9, сс=6, p=0,2): ЮА - 51,7% (n=43), ХГН - 21,7% (n=18), ДЗСТ - 26,6% (n=22) выявлено не было, поэтому они были объединены в одну группу - ИПС.
Не регистрировалось статистических различий при сравнении эндоскопической картины в СОЖ между I и II группой (χ2=1,8, cc=3, p=0,8) (табл. 1). Структура эндоскопической картины в СОДПК в сравниваемых группах (ИПС, ХГД) также статистически не различалась (χ2=5,9, cc=3, p=0,15) (табл. 1).
Таблица 1. Структура эндоскопических изменений СО гастродуоденальной зоны у детей с ИПС и ХГД, (абс. - %)
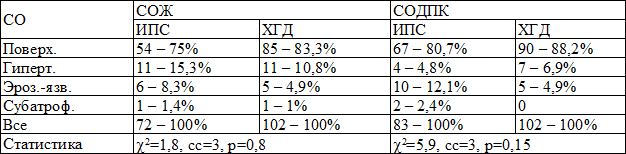
Примечание: *Поверх. – поверхностные изменения, Гиперт. – гипертрофические, Эроз.-язв. - эрозивно-язвенные, Субатроф. – субатрофические
Не диагностировалось однородных изменений по данным ФГДС при сравнении изменений в СОЖ и СОДПК в группе ИПС и ХГД (табл. 1).
В группе ИПС эрозивно-язвенные изменения выявлялись в 1,5 раза чаще в СОДПК (СОЖ – 8,3%, СОДПК – 12,1%). В группе ХГД эрозивно-язвенные изменения диагностировались с одинаковой частотой в СОЖ (4,9%) и СОДПК (4,9%) (табл. 1).
В группе ИПС: дуодено-гастральный рефлюкс (ДГР) выявлялся у 9% (n=10), эзофагит у 12% (n=13); в группе ХГД: ДГР – 13,8% (n=15), эзофагит 7,3% (n=8). Достоверных различий в структуре между группами не установили (χ2=1,4, cc=1, p=0,24).
Структура однотипных изменений в СОЖ и СОДПК между сравниваемыми группами достоверно значимо не различалась (χ2=2,9, cc=3, p=0,7).
У детей с ИПС выявлялись следующие однотипные изменения в СОЖ и СОДПК: поверхностные - 45% (n=49), гипертрофические - 4,6% (n=5), эрозивно-язвенные – 1,8% (n=2), субатрофические - 0,9% (n=1). У детей с ХГД: поверхностные – 72,5% (n=79), гипертрофические – 4,6% (n=5), эрозивно-язвенные – 1,8% (n=2).
У детей с ИПС и ХГД - Hp диагностировалось с достоверно одинаковой частотой: ИПС - 28,8% (n=19) и ХГД - 28% (n=16) соответственно.
В I группе при разных формах поражения в СОЖ (χ2=3,1, cc=2, p=0,22): поверхностные – 15%, гипертрофические – 6% и СОДПК (χ2=1,2, cc=3, p=1,00): поверхностные – 16,7%, гипертрофические 3%, эрозивно-язвенные – 3% - Hp выявлялась с достоверно одинаковой частотой.
Во II группе - СОЖ (χ2=2,8, cc=2, p=0,24): поверхностные – 21%, гипертрофические – 5% и СОДПК (χ2=5,6, cc=2, p=0,06): поверхностные – 21%, гипертрофические – 5%, эрозивно-язвенные – 1,75% - Hp также диагностировалась с одинаковой частотой.
После эндоскопического исследования 50 детям из группы ИПС и ХГД была проведена внутрижелудочная pH-метрия.
Пациенты с ИПС, которым проводилась внутрижелудочная pH-метрия, имели разнообразную эндоскопическую картину в СОЖ и СОДПК: 62% (n=31) поверхностный гастродуоденит, 18% (n=9) смешанный гастродуоденит, 10% (n=5) поверхностный дуоденит, 4% (n=2) поверхностный гастрит, 2% (n=1) гипертрофический гастрит, 2% (n=1) гипертрофический гастродуоденит, 2% (n=1) субатрофический гастродуоденит.
Получены следующие результаты внутрижелудочной pH-метрии, представленные в табл. 2.
Статистически значимых различий между значениями pH в теле желудка натощак (χ2=0,42, cc=3, p=1,00) и после стимуляции (χ2=1,1, cc=3, p=1,00) у детей с ИПС и ХГД не выявлялось, это значит, что по структуре - функция кислотообразования в желудке у двух групп была одинаковой (табл. 2).
У детей с ИПС выявлены достоверно значимые различия в структуре функции кислотообразования в теле желудка натощак и после стимуляции (χ2=15,3, cc=3, p=0,002) (табл. 2).
Синдром раздраженного желудка (вариант непрерывного кислотообразования в теле желудка натощак) наблюдался у 42% (n=21) детей. После стимуляции гиперацидность сохранялась у 12% (n=6) и регистрировалась у 2% (n=1) пациентов с нормацидностью натощак, что подтверждало повышенную функцию кислотообразования в желудке у данных пациентов.
Таблица 2. Характеристика кислотообразующей функции желудка у детей с ИПС и ХГД, (абс.-%)
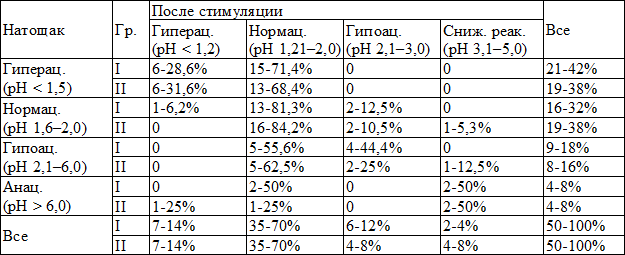
Примечание: Гр. - группы пациентов, Гиперац. - гиперацидность, Гипоац. - гипоацидность, Нормац. - нормацидность, Анац. - анацидность, Сниж. реак. на стимул. - сниженная реакция на стимулятор. ИПС - I, ХГД – II
Нормальный уровень кислотообразования натощак регистрировался у 32% (n=16) детей, но после стимуляции число таких детей увеличилось до 70% (n=35), из них у 26% (n=13) сохранялась нормацидность, у 30% (n=15) нормацидность регистрировалась после гиперацидности, у 10% (n=5) после гипоацидности, у 4% (n=2) после анацидности натощак, что свидетельствовало о нормальной функции кислотообразования у данных детей.
Гипоацидность натощак выявлялась у 18% (n=9) детей, но после стимуляции число таких пациентов уменьшилось до 12% (n=6), из них у 4% (n=2) гипоацидность регистрировалась после нормацидности натощак, что свидетельствовало об извращенной реакции на стимулятор, и у 8% (n=4) гипоацидность сохранялась, что можно было трактовать, как снижение функции кислотообразования.
Анацидность натощак регистрировалась у 8% (n=4), но после стимуляции число детей с анацидностью уменьшилось до 2% (n=1) и у 2% (n=1) наблюдалась сниженная реакция на стимулятор, что можно было трактовать как снижение функции кислотообразования.
У детей с ХГД также были выявлены статистически значимые различия в структуре функции кислотообразования в теле желудка натощак и после стимуляции (χ2=11,6, cc=3, p=0,01) (табл. 2).
Синдром раздраженного желудка (вариант непрерывного кислотообразования в теле желудка натощак) наблюдался у 38% (n=19) детей. После стимуляции гиперацидность сохранялась у 12% (n=6) и регистрировалась у 2% (n=1) пациентов с анацидностью натощак, что подтверждало повышенную функцию кислотообразования в желудке у данных пациентов.
Нормальный уровень кислотообразования натощак регистрировался у 38% (n=19) детей, но после стимуляции число таких детей увеличилось до 70% (n=35), из них у 32% (n=16) сохранялась нормацидность, у 26% (n=13) нормацидность регистрировалась после гиперацидности, у 10% (n=5) после гипоацидности, у 2% (n=2) после анацидности натощак, что свидетельствовало о нормальной функции кислотообразования у данных детей.
Гипоацидность натощак выявлялась у 16% (n=8) детей, но после стимуляции число таких пациентов уменьшилось до 8% (n=4), из них у 4% (n=2) гипоацидность регистрировалась после нормацидности натощак, что свидетельствовало об извращенной реакции на стимулятор, и у 4% (n=2) гипоацидность сохранялась, что можно было трактовать как снижение функции кислотообразования.
Анацидность натощак регистрировалась у 8% (n=4), но после стимуляции детей с анацидностью не выявлено, у 4% (n=2) наблюдалась сниженная реакция на стимулятор, что можно было трактовать как снижение функции кислотообразования.
У детей с ИПС и ХГД статистически достоверных различий в структуре функции ощелачивания антрального отдела желудка натощак (χ2=0,25, cc=2, p=0,88) и после стимуляции (χ2=0,39, cc=2, p=0,82) не выявлялось (табл.3).
В группе ИПС и группе ХГД достоверно значимых различий в структуре функции ощелачивания натощак и после стимуляции не диагностировалось (ИПС - χ2=0,14, cc=2, p=0,14; ХГД - χ2=0,65, cc=2, p=0,65) (табл.3).
В антральном отделе желудка у большинства пациентов обеих групп регистрировалось нарушение ощелачивающей функции (субкомпенсация, декомпенсация). Натощак: ИПС – 80%, ХГД – 82%. После стимуляции: ИПС – 84%, ХГД – 82% (табл. 3).
Нарушение функции ощелачивания трактовалось как снижение функциональной активности мукоцитов в антральном отделе желудка.
Таблица 3. Характеристика ощелачивающей функции антрального отдела желудка у детей с ИПС и ХГД, (абс.-%).
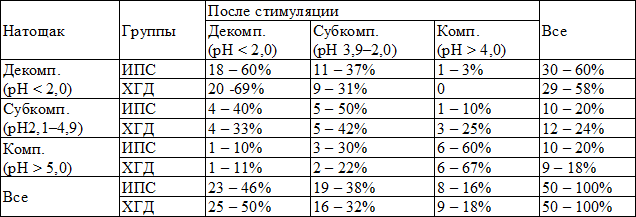
Примечание: Декомп. - декомпенсация ощелачивания, Субкомп. - субкомпенсация ощелачивания, Комп. - компенсация ощелачивания
Обсуждение полученных результатов. Патология гастродуоденальной зоны у детей с ИПС была выявлена у 80,73% детей, что не противоречит исследованиям других авторов [1, 3, 5, 8-10, 13].
Структура эндоскопической картины поражения слизистой гастродуоденальной зоны и функции секретообразования (кислотообразования, ощелачивания) получилась идентичной для обеих групп – ИПС, ХГД. Обсемененность Hp диагностировалось у детей с ИПС (28,8%) и ХГД (28%) одинаково часто.
По данным, полученным при проведении внутрижелудочной pH-метрии, предлагаются следующие рекомендации по выбору препаратов медикаментозной терапии:
1. При повышенной функции кислотообразования рекомендуется назначение ингибиторов протоновой помпы (ИПП) и/или антацидов.
2. При нормальной функции кислотообразования возможно назначение нескольких групп препаратов: антациды или гастропротекторы (препараты висмута), или ИПП.
3. В случае сниженной функции кислотообразования рекомендуется назначение гастропротекторов (препараты висмута).
Назначение медикаментозной терапии должно быть индивидуальным в зависимости от эндоскопической картины и результатов обследования на Hp, при выявлении которой решается вопрос о назначении эрадикации с учетом рекомендаций по Маастрихт IV [12].
Анализ результатов, полученных в ходе исследования, позволил сделать следующие выводы:
1. В нашем исследовании у 80,73% детей из трех подгрупп (ЮА, ХГН, ДЗСТ) было диагностировано коморбидное состояние в виде хронического гастродуоденита.
2. В ходе работы не выявили статистически значимых различий в структуре гастродуоденитов в зависимости от уровня кислотообразования и ощелачивания у детей с иммунопатологическими состояниями и хроническим гастродуоденитом. Следовательно, гастроэнтеролог может руководствоваться рекомендациями выбора медикаментозной коррекции нарушения секретообразования, едиными для пациентов обеих групп.
3. Полученные данные по ФГДС и внутрижелудочной pH-метрии у детей с ИПС рекомендуется использовать для последующего подбора индивидуального лечения в рамках стандартов, планирования объемов обследования, привлечения врачей – консультантов (гастроэнтерологов), подбора лекарственных препаратов для терапии сочетанной гастроэнтерологической патологии.
