Актуальность. Среди миодистрофий наиболее часто в детском возрасте диагностируются прогрессирующую мышечную дистрофию Дюшенна, Эмери-Дрейфуса, Эрба-Рота [2, 8]. Миодистрофия Дюшенна - наследственное заболевание, занимает второе место в мире по частоте встречаемости (1:5000 новорожденных мальчиков) [1, 4]. Мышечная дистрофия Дюшенна является наиболее разрушительной из всех мышечных дистрофий [5].
Генетический фактор - несовершенный ген - передается ребенку от матери, но у них самих нарушения не развиваются. Имеется 50-процентный шанс, что у каждого сына женщины-носительницы генетического фактора разовьется болезнь и 50% шанс, что каждая ее дочь станет носителем этого фактора [3, 6].
Несмотря на почти вековую историю изучения данной патологии, вопросы их патогенеза, достоверной диагностики и лечения остаются до сего времени неразрешенными. Существует большое количество классификаций, но отсутствие точных данных о первичном биохимическом дефекте не дает возможности построить ее по рациональному принципу [1, 7].
Поражения внутренних органов значительно утяжеляет течение основного заболевания. Пациенты теряют способность самостоятельно передвигаться между 7-ю и 13-ю годами, а погибают, нередко, в подростковом возрасте или на III декаде жизни; при этом вовлеченными в патологический процесс оказываются практически все органы и системы организма [3].
Таким образом, анализ данных литературы убеждает в необходимости проведения тщательного соматического обследования пациентов с прогрессирующей мышечной дистрофией (ПМД) с целью как можно раньше выявить нарушения и принять меры для своевременной коррекции и поддержания функции жизненно важных органов.
В связи с вышеизложенным, целью данного исследования явилось изучение клинико-диагностических особенностей мышечной дистрофии Дюшенна у детей.
Материалы и методы исследования. Проведен клинический анализ 37 детей с диагнозом прогрессирующая мышечная дистрофия Дюшенна. Возраст детей варьировал от 3 до 15 лет, средний возраст составлял 7,8±0,48 лет. Возраст к началу заболевания в среднем составлял 4,3±0,36 лет и варьировал в пределах от рождения до 8 лет.
Биохимическое исследование включало определение уровня ферментов крови трансаминаз (АЛТ и АСТ), креатинфосфокиназы (КФК), лактатдегидразы (ЛДГ).
Генеалогическим методом обследовано 240 родственников I степени родства (родители, сибсы) детей с ПМД. Составлена подробная родословная, куда входили сведения о заболеваниях в 3 поколениях семьи. Генеалогический материал собирался по обеим родительским линиям путём перекрёстного опроса обоих родителей, иногда бабушек и дедушек.
Результаты и их обсуждение. При анализе акушерского анамнеза было установлено, что беременность протекала в 32,4% на фоне анемии, в 10,8% - токсикоза. 10,8% матерей во время беременности перенесли острые респираторные вирусные инфекции (ОРВИ). Обострение хронических заболеваний во время беременности регистрировалось у 2,7% матерей больных детей. Возраст матери при рождении ребенка с ПМД в среднем составил 26,0±0,85 лет.
Число членов семей, у которых отмечалась ПМД составило 13,5%.
По результатам наших исследований в 4 (10,8%) родословных выявлены случаи ПМД у родных братьев и в 1 случае (2,7%) у дяди по материнской линии.
Из анамнеза жизни установлено, что в 13,5% регистрируется родственный брак. Так же было отмечено, что в большинстве случаев дети были рождены от 2 и 3 беременности (2,2±0,19) или 2-3 родов (2,15±0,17).
Двое детей были из двойни, хочется обратить внимание, что один из детей двойни был здоров.
Роды в 89,2% случаев протекали нормально, в 5,4% случаев стремительно и по 1 (2,7%) случаю наблюдались длительный безводный период и оперативные роды. Вес при рождении детей составлял в среднем 3130±107,3 гр. В асфиксии были рождены 8 детей, что составило 21,6%. Обвитие пуповиной регистрировалось у 5,4% детей.
Анализ развития у детей психомоторных навыков показал, что дети в большинстве случаев поздно начинали удерживать голову (48,6%), сидеть (после 9 месяцев и позже 51,3%). Психомоторное развитие в 35,1% случаев не соответствовало возрастной норме ещё до дебюта проявлений миодистрофии Дюшенна.
В 78,4% случаях в предварительном диагнозе выставлялся ПМД. Из 37 наблюдаемых больных только 1 пациент находился на диспансерном учете, остальные же обращались впервые.
По данным литературы симптомы обычно проявляются в возрасте 2-5 лет, когда мышцы нижних частей тела и позвоночника поражаются первыми. Согласно нашим данным, первые симптомы заболевания проявились в среднем 4,6±0,35 лет.
Основными клиническими симптомами мышечной дистрофии Дюшенна являются: нежелание ходить или замедленная ходьба; ненормальная ходьба, часто походка вперевалку или качающаяся походка; ходьба на пальцах ног; неспособность нормально прыгать или бегать; трудности подъема по лестнице, при входе или выходе из автомобиля; частые падения. В связи с ходьбой на пальцах ног у этих детей развивается переднее наклонное положение таза и, соответственно, деформация спины.
У 67,6% обследованных детей наблюдались проблемы с зубами, характеризующиеся расширением челюсти и расширение промежутка между зубами.
При осмотре наблюдалось увеличение объема мышц, особенно икр; ноги, как правило, поражаются симметрично. Наиболее часто псевдогипертрофии наблюдались у детей старше 6 лет и по мере дальнейшего прогрессирования болезни имели тенденцию к уменьшению.
У 21,6% наблюдаемых детей развились ранние мышечные контрактуры и ретракция пяточных (ахилловых) сухожилий.
Мышечные атрофии первоначально локализовались в мышцах тазового пояса, с максимальной выраженностью в проксимальных отделах нижних конечностей. С возрастом имели тенденцию к распространению в восходящем направлении на мышцы плечевого пояса, спины и проксимального отдела верхних конечностей.
При детальном неврологическом осмотре в 97,3% случаев наблюдается утиная походка, активные движения ограничены, с затруднением самостоятельной ходьбы в 72,9% случаев.
Обращает на себя внимание снижение и утрата коленных рефлексов при длительном сохранении ахилловых рефлексов. У детей в более старшем возрасте наблюдается снижение рефлексов с m.biceps et m.triceps.
Во всех наблюдениях отмечается тотальная мышечная гипотония и снижение мышечной силы, более выраженные в ногах. Мышечная сила в руках составляла в среднем 2,2±0,07, в ногах 1,25±0,03.
Судорожный синдром отмечен у 2 детей, что составило 5,4%, тремор у 1 ребенка – 2,7%.
Отличительной чертой миодистрофии Дюшенна является сочетание атрофии мышц с патологией костно-суставной, сердечно-сосудистой и нейроэндокринной систем.
В соматическом статусе у обследованных детей с миодистрофией Дюшенна выражена костная патология на ранних стадиях заболевания типичными нарушениями являются: поясничный лордоз (100%), кифосколиоз (94,6%), сколиоз (5,4%), деформации грудной клетки по типу "килевидной" или "ладьевидной" груди (32,4%), высокий свод стопы (100%).
По мере прогрессирования процесса развивается эквиноварусная деформация стоп и контрактуры крупных суставов.
Сердечно-сосудистые расстройства клинически проявлялись лабильностью пульса, артериального давления (АД), глухостью тонов сердца. На электрокардиограмме (ЭКГ) регистрировались изменения миокарда, блокада ножек пучка Гиса.
Наиболее частыми нарушениями со стороны сердца среди обследованных больных являлись: выраженная тахикардия, аритмии и развитие сердечной недостаточности.
На ЭКГ у больных с миодистрофией Дюшенна регистрировался глубокий зубец Q в отведениях 2, 3, aVF, V6. и высокий зубец в отведении V6.
Полученные данные свидетельствуют о поражении миокарда в области задне-нижней и латеральной стенок левого желудочка.
У больных в развернутой стадии заболевания наиболее часто выявляется гипертрофическая кардиомиопатия (51,4%) и дилятационная (27%), реже встречались - пролапс митрального клапана и миксома левого желудочка (21,6%).
У 40,5% больных наблюдались нейроэндокринные нарушения, из них у 53,3% регистрировался синдром Иценко-Кушинга и у 46,7% адипозогенитальная дистрофия.
У 35,1% обследованных детей наблюдались психомоторные навыки не соответствующие возрасту, а в более старшем возрасте умственная отсталость.
Среди 25 обследованных детей нами было проведено электронейромиографическое исследование (ЭНМГ) которое включало регистрацию биопотенциалов мышц кистей и стоп, измерение параметров прямого вызванного ответа мышцы (М - ответа) и поздно вызванных ответов.
Важным показателем состояния нервно-мышечного аппарата служит М-ответ. У всех обследованных детей данный показатель ниже как по tibialis anterior D, так и tibialis anterior S по сравнению с контрольной группы почти в 3,5 раза (Р<0,001). Скорость распространения возбуждения по нерву (СРВ) не отличалась от показателей контрольной группы с обеих сторон.
Таким образом, у всех обследованных детей в проксимальных отделах мышц нижних конечностей по данным ЭНМГ отмечалось первично-мышечное поражение с тенденцией к прогрессии и недостаточной реинервацией, которые были более выражение с возрастом.
Показатели лабораторных исследований были определены в сравнении с показателями здоровых детей (n=20). Данный анализ показал, что уровень КФК в основной группе был повышен в 71 раз, АЛТ в 15,2 раза, АСТ 8,4 раза, ЛДГ в 4,4 раза (рис. 1).
Высокая активность плазменных ферментов, прежде всего КФК отражает темп деградации миофибрилл в мышечных волокнах. Параллельно с повышением КФК наблюдалось увеличение концентрации и других ферментов цитолиза – лактатдегидразы и трансаминаз.
Увеличение уровня ЛДГ в крови свидетельствует о накоплении лактата крови, что в свою очередь приводит к гипоксии и вызывает чувство мышечной усталости, нарушает процесс тканевого дыхания.
Увеличение уровня трансаминаз (АЛТ и АСТ) в крови говорит всегда о большем, чем в норме, разрушении клеток соответствующего органа, в нашем случае мышцах.
Заключение. Таким образом, диагностика прогрессирующих мышечных дистрофий является сложной задачей, для решения которой необходимы создание и использование алгоритмов диагностики.
Диагноз прогрессирующая мышечная дистрофия Дюшенна основывается на данных клинико-генеалогического анамнеза, клинических особенностей заболевания (начало в 2-5 лет, симметричная атрофия проксимальных групп мышц, их развитие в восходящем направлении, псевдогипертрофия икроножных мышц, грубые соматические и нейроэндокринные нарушения, быстрое злокачественное течение заболевания).
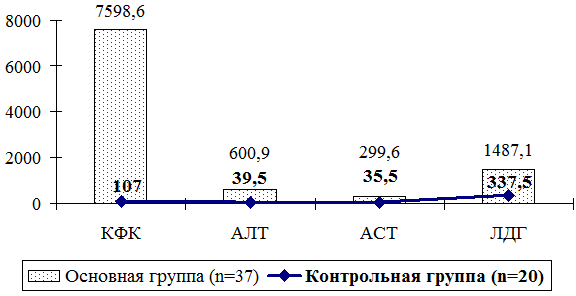
Рис. 1. Лабораторные показатели у обследованных детей в сравнительном аспекте
Имеют значение также данные биохимических исследований (повышение в сыворотке крови уровня КФК в 71 раз выше от нормы на фоне повышения АЛТ, АСТ и ЛДГ), электромиографии и патоморфологии, при которых определяют первично-мышечный тип поражения.
