Введение. Матриксные маталлопротеазы (ММР) представляют собой группу родственных по структуре цинкзависимых эндопептидаз, участвующих в деградации базальной мембраны и внеклеточного матрикса. Они секретируются в неактивной форме в межклеточное пространство, где активируются под действием других протеаз и принимают участие в тканевой перестройке. ММР – единственные протеолитические ферменты, способные денатурировать фибриллярные коллагены. В состав ММР входит 28 ферментов, которые делятся на пять подсемейств: коллагеназы (ММР-1, ММР-8, ММР-13), стромализины (ММР-3, ММР-10), матрилизины (ММР-7, ММР-26) и желатиназы (ММР-2, ММР-9). К соединениям, образуемым эндотелиальными клетками, относятся коллагеназы, стромализины и желатиназы, секретирующиеся в физиологических условиях в межклеточное пространство и разрушающие фибриллярные коллагены, фибронектин и другие белки внеклеточного матрикса [2]. Кроме того, ММР экспрессируются в мышечных клетках и фибробластах [4]. Установлено, что ММР-2, в отличие от ММР-9, экспрессируется в поврежденных артериях, благодаря чему является одним из маркеров воспаления [1]. Содержание ММР в физиологических условиях регулируется содержанием специфических тканевых ингибиторов матриксных металлопротеаз (MMPTI), представляющие собой небольшие белки, вступающие во взаимодействие с MMP в соотношении 1:1. Но MMPTI могут инактивироваться действием протеолитических ферментов – трипсина, хемотрипсина, эластазы нейтрофилов, благодаря чему значительно возрастает активность различных ММР [8]. Проведенные исследования показали, что при заболеваниях сердечно-сосудистой системы в сыворотке крови нарушается нормальное соотношение MMP и MMPTI, приводящее к развитию фиброза [1, 2].
Трансформирующий фактор роста (TGF-β) является сильнейшим стимулятором экспрессии гена, управляющего синтезом интерстициального коллагена [4]. Известно, что TGF-β обладает тремя основными функциями: изменение пролиферации клеток, усиление формирования клеточного матрикса за счет активации синтеза его компонентов и подавления деградации, иммуносупрессивное действие [3]. Именно с действием TGF-β связывают развитие фиброза при ряде патологических процессов [7]. Уникальный характер биологической активности TGF-β особенно ярко проявляется в регуляции защитных реакции в ткани легких. В легкие постоянно попадает большое количество патогенов, активирующих механизмы врожденного иммунитета и развитие воспаления. Гиперактивация воспалительной реакции может привести к отеку, а в случае хронического воспаления – к фиброзу. Для нивелирования этого процесса существует механизм регуляции воспалительной реакции, связанный с продукцией TGF в ткани легких [9]. TGF, с одной стороны, ограничивает активацию клеток иммунной системы, не позволяя воспалительной реакции перейти в гиперергическую фазу, а с другой стороны, активирует метаболизм соединительной ткани для быстрого восстановления исходной структуры ткани и недопущения развития фиброзирования [3].
С вышеуказанных позиций, определенный интерес представляет изучение факторов, приводящих к фиброзированию легочной ткани у детей при гриппе A H1N1/v (пандемическом гриппе), в том числе при осложненных его формах пневмонией.
Цель исследования – изучить содержание матриксных металлопротеаз (MMP-2, MMP-9) и трансформирующего фактора роста-β у детей с неосложненным гриппом и при осложненном его течении пневмонией.
Материалы и методы исследования. В исследование включен 201 ребенок с гриппом А H1N1/v, рандомизированные в две группы: первую группу составили 114 детей с неосложненным гриппом. Для определения тяжести течения гриппа А H1N1/v пользовались общепринятой классификацией гриппа [5]. Группу сравнения для этой группы составили 27 детей с сезонным гриппом A H3N2 в постэпидемический период.
87 детей с развившейся внебольничной вторичной вирусно-бактериаль-ной пневмонии на фоне пандемического гриппа объединены во вторую группу. Диагноз внебольничной пневмонии устанавливался на основании достоверных критериев, предложенных А.Г. Чучалиным и соавт. [6].
В качестве критериев тяжести внебольничной пневмонии у детей использовали модифицированную шкалу тяжелых внебольничных пневмоний у взрослых (2007) [10].
Группой сравнения для второй клинической группы составили 50 детей с внебольничной пневмонией в постэпидемический по гриппу период. Дети с атипичной этиологией внебольничной пневмонии (микоплазменная, хламидийная) из данной группы исключались. Диагноз гриппа А H1N1/v устанавливался на основании эпидемиологического анамнеза, комплекса характерных клинических симптомов и верифицировался путем обнаружения рибонуклеиновой кислоты (РНК) вируса в назофарингеальных мазках методом полимеразной цепной реакции (ПЦР) и/или с помощью реакции торможения гемагглютинации (РТГА) в парных сыворотках с нарастанием тира антител. Сезонный грипп устанавливался на основании идентификации РНК вируса гриппа A H3N2 в назофарингеальных мазках.
Распределение исследуемых по группам, полу и возрасту представлено в табл.1.
Таблица 1. Распределение больных по группам, полу и возрасту
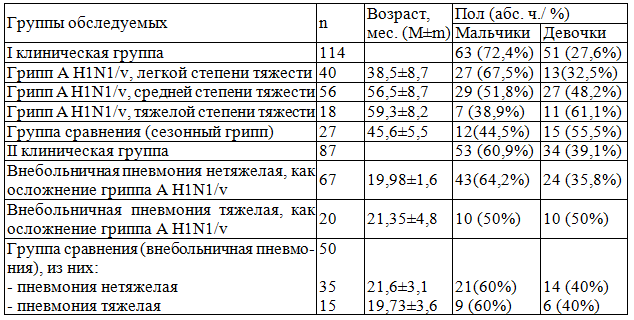
Контрольную группу составили 20 здоровых детей, сопоставимые по возрасту и полу с исследуемыми клинических групп.
Объектом для исследования явилась сыворотка крови. Количественное содержание ММР-2 и ММР-9 оценивали с использованием тест-систем «Quantikine MMP-2 и MMP-9 Immunoassay» производства R&D Systems, США. Определение концентрации MMPTI проводили тест-системой «BioSource HuTIMP-1 kit» производства BioSourse Europe S.A., Бельгия. Все измерения проводили с помощью автоматического вертикального фотометра «Multiscan MCC 340» согласно требованиям тест-систем. После чего производился расчет отношения ММР-2 и ММР-9 к MMPTI. Определение содержания TGF-β1 в сыворотке крови проводили с помощью набора для иммуноферментного анализа (производство фирмы «DGR Internarional inc.», Германия). Количественное содержание TGF-β1 выражали в пкг/мл, а ММР-2, ММР-9 и MMPTI – в нг/мл.
Полученные данные подвергали статистической обработке с помощью программ «Microsoft Office Exсel 2010 for Windows 7» и «STATISTICA 6.1». Для описания характера распределения количественных признаков определялись средние величины (М), стандартные отклонения (SD). Достоверность различий между двумя независимыми совокупностями оценивали с использованием непараметрического критерия Манна-Уитни. Различия сравниваемых показателей считались статистически значимыми при p<0,05.
Результаты исследования и их обсуждение. Известно, что выраженность клинических симптомов заболевания определяется степенью активности иммунных реакций, в процессе которых реализуется эффекторный цитолитический потенциал к вирус-инфицированным клеткам-мишеням при помощи физиологически активных медиаторов микробоцидного действия – катионных белков: ферментных (миелопероксидаза, лизоцим, эластаза) и неферментных (лактоферрин, ферритин, дифензины), осуществляющих нарушение целостности клеточной оболочки возбудителя и блокаду в нем ключевых метаболических процессов, благодаря действию продуктов метаболизма арахидоновой кислоты, секретируемых нейтрофилами в околоклеточное пространство, стимулирующих образование свободных радикалов и окиси азота, также необходимых для инактивации возбудителя. Поэтому первоначально нами исследовано содержание ММР-2, ММР-9, MMPTI в сыворотке крови у больных с неосложненным течением гриппозной инфекции.
Нами установлено, что уровень ММР-2, ММР-9, MMPTI достоверно отличался у пациентов с тяжелым и среднетяжелым течением гриппа A H1N1/v (табл.2).
Таблица 2. Содержание ММР-2, ММР-9, MMPTI и TGF-β1 в сыворотке крови у больных с неосложненным гриппом, M±SD
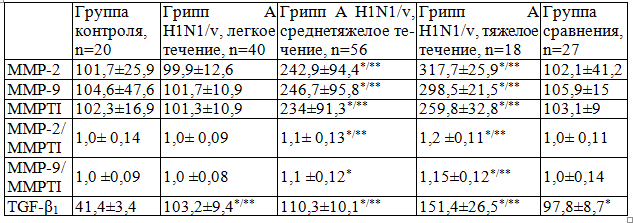
Примечание: * - статистическая значимость различий с контролем; ** - статистическая значимость различий с группой клинического сравнения
Между тем, в группе детей с сезонным гриппом, а также при легком течении пандемического гриппа уровень исследуемых металлопротеаз не только не отличался от группы здоровых детей, но и не нарушалось физиологическое отношение данных металлопротеаз к их специфическому ингибитору. Продукция ММР-2, ММР-9 у детей со среднетяжелой формой гриппа A H1N1/v превышала показатели контроля и аналогичные показатели при сезонном гриппе в 2,4 и 2,3 раза, соответственно (p=0,0001). Тогда как, тяжелое течение пандемического гриппа сопровождалось более высоким содержанием ММР-2, ММР-9, превышая показатели здоровых детей в 3,1 раза, а уровень у больных с гриппом A H3N2 – в 2,8 раза (p=0,0001). Кроме того, отмечено, что при тяжелом течении гриппа наблюдалась не только гиперпродукция металлопротеаз, но и нарушалось их физиологическое отношение с продукцией MMPTI (p=0,0001).
Продукция исследуемого TGF-β1 достоверно превышала показатели контроля у детей с гриппом, независимо от серологического типа вируса гриппа А (табл.2). Так, содержание TGF-β1 превышало показатели контроля при сезонном гриппе в 2,4 раза, при легком течении гриппа A H1N1/v – в 2,5, а у детей со среднетяжелыми и тяжелыми формами, соответственно, в 2,7 и 3,7 раза. В тоже время, показатели TGF-β1 у детей при пандемическом гриппе, независимо от тяжести его течения, достоверно отличались от аналогичных показателей детей при сезонном гриппе (p=0,0001). Отмечено, что с нарастанием тяжести пандемического гриппа увеличивалось содержание данного цитокина в сыворотке крови (p=0,0001).
Содержание ММР-2, ММР-9, MMPTI и TGF-β1 у больных с осложненным течением гриппа представлены в табл. 3.
Таблица 3. Содержание ММР-2, ММР-9, MMPTI и TGF-β1 в сыворотке крови у больных с осложненным гриппом, M±SD
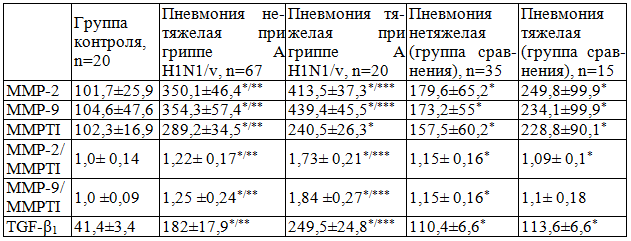
Примечание: * - статистическая значимость различий с контролем; ** - статистическая значимость различий с группой клинического сравнения (нетяжелая пневмония); *** - статистическая значимость различий с группой клинического сравнения (тяжелая пневмония)
Уровень исследуемых металлопротеаз повышался во всех исследуемых нами группах больных с пневмонией относительно здоровых индивидуумов. При этом обнаружено, что если при пневмонии, этиологически не связанной с пандемическим гриппом, уровень ММР-2 и ММР-9 превышал контрольные значения в 1,8 и 2,5 раза, независимо от тяжести ее течения, то значения исследуемых металлопротеаз при осложненном гриппе A H1N1/v превышали аналогичные показатели соответственно, в 3,4 и 4,1 раза. Причем, тяжелое течение пневмонии при пандемическом гриппе сопровождалось более значимым повышением уровня ММР-2 и ММР-9 не только по сравнению с контролем и группой сравнения (р=0,0001), но и относительно детей с нетяжелыми формами пневмонии при гриппе A H1N1/v (р=0,0001). Повышение показателей соотношения ММР-2 и ММР-9 к MMPTI также отмечены во всех исследуемых группах больных с пневмонией, исключая соотношение ММР-9 к MMPTI у детей с тяжелой пневмонией группы сравнения (р=0,061). Показатель отношения исследуемых металлопротеаз к их физиологическому ингибитору максимально увеличивался у детей с тяжелой пневмонией при гриппе и достоверно отличался от группы детей с нетяжелым ее течением (р=0,0001).
Содержание TGF-β1 у всех исследуемых также превышали контрольные значения. При этом выявлено, что максимальная продукция этого цитокина наблюдалась у детей с тяжелым течением пневмонии при пандемическом гриппе (р=0,0001), а различия в его уровнях статистически отличались в группах больных с тяжелым и нетяжелым течением пневмонии при гриппе A H1N1/v (р=0,0001).
В ходе проводимого исследования нас интересовали и возможные различия между содержанием изучаемых показателей в сыворотке крови у детей с неосложненным течением пандемического гриппа и при уже развившейся пневмонии. Нами зафиксировано, что различия всех исследуемых показателей у детей с тяжелой пневмонией при пандемическом гриппе значительно превышали аналогичные у детей с тяжелым гриппом (р=0,0001). Помимо этого, уровень ММР-2, ММР-9, MMPTI, TGF-β1 у детей с тяжелым течением гриппа превышал таковые показатели у детей с пневмонией, этиологически несвязанной с гриппом A H1N1/v, что подтверждает потенциальную способность вируса пандемического гриппа к фиброзу легочной ткани.
Таким образом, обнаруженное повышение концентрации TGF-β1 у детей с гриппом, более значимое при тяжелых формах пандемического гриппа обусловлено снижением активации клеток иммунной системы, направленных на ограничение воспалительной реакции. Превышение показателей ММР-2, ММР-9 и MMPTI у детей со среднетяжелым и тяжелым течением гриппа обуславливают течение физиологических процессов, приводящих к инактивации патогена. Однако, выявленные нарушения при данных формах физиологического соотношения исследуемых металлопротеаз к их ингибитору, могут объяснить с одной стороны интенсивность воспалительной реакции, характерной для более тяжелых форма гриппа, а с другой стороны, уже на этой стадии патологического процесса может стать значимым фактором риска развития фиброза легочной ткани. Гиперпродукция металлопротеаз и TGF-β1 при пневмонии, обусловленной вирусом гриппа A H1N1/v, должна расцениваться как фактор риска не только тяжелого течения пневмонического процесса, но и свидетельствовать о развитии фиброза легочной ткани, что требует тщательного катамнестического наблюдения за данной категорией пациентов.
Выводы
1. Среднетяжелые и тяжелые формы неосложненного пандемического гриппа у детей сопровождаются повышенной продукцией ММР-2, ММР-9, MMPTI.
2. Гриппозная инфекция у детей, независимо от серологического типа вируса гриппа А, характеризуется увеличением уровня TGF-β1, более выраженным при тяжелых формах пандемического гриппа.
3. Пневмония при пандемическом гриппе сопровождается гиперпродукцией ММР-2, ММР-9, TGF-β1, а также выраженным изменением соотношения металлопротеаз к их физиологическому ингибитору, более значимым при тяжелом ее течении, что является фактором риска фиброзирования легочной ткани.
4. Показатели ММР-2, ММР-9, MMPTI, TGF-β1 могут служить прогностическими критериями тяжести течения пневмонии при гриппе A H1N1/v.
