Введение. Метаэпифизарный остеомиелит (МЭО) у детей раннего возраста является серьезной проблемой детской хирургии [12, 13, 18, 19, 24], являясь одним из самых распространенных и тяжелых гнойно-воспалительных заболеваний периода раннего детства [2, 4, 14]. Клиническое течение этого заболевания имеет свои особенности [5, 12, 19, 25], чем обусловлена трудность его лечения. Несмотря на разнообразие имеющихся методов исследования, проблема своевременной диагностики остеомиелитического процесса остается во многом нерешенной. Частота ошибок в диагностике МЭО составляет 48,4-54,5% [7, 8, 15]. Особенно часты диагностические ошибки в ранние сроки от начала заболевания, достигая 61,1-64% [3]. Это обусловлено полиморфизмом клинических проявлений, «атипичным» течением заболевания, отсутствием патогномичных признаков, ранних рентгенологических проявлений, особенно у детей раннего возраста [1]. Трудность диагностики, тяжесть течения и неблагоприятные исходы определяют актуальность проблемы [7, 16, 22, 23].
Материал и методы. В основу данной работы положены результаты клинического наблюдения и обследования 102 больных МЭО в возрасте от 5 дней до 4 месяцев. Среди больных МЭО значительный удельный вес составили дети в возрасте до 1 месяца – 71 (69,6%) пациент. Мальчиков было 61 (59,8%), девочек – 41 (40,2%). В зависимости от клинической формы МЭО все больные были разделены на 2 группы: местно-очаговую и септико-пиемическую. На долю местно-очаговой формы МЭО пришлось 55 (53,9%) больных, септико-пиемической – 47 (46,1%). Диагноз МЭО ставился на основании проведенного клинического, бактериологического, лабораторного, инструментальных методов обследования.
Результаты и их обсуждение. Результаты оценки степени тяжести состояния больных МЭО при госпитализации в хирургический стационар показали, что из 102 больных поступили в тяжелом состоянии 59 пациентов (57,8%) и крайне тяжелом – 6 больных (5,9%). В состоянии средней степени тяжести поступило 37 (36,3%) больных.
Клиническое течение заболевания имело определенные особенности в зависимости от клинической формы заболевания. Из 55 больных местно-очаговой формой МЭО у 22 пациентов общее состояние было оценено как тяжелое (40%). Это было обусловлено их поздним поступлением в стационар – в 68,2% случаев. У 33 (60%) пациентов общее состояние было среднетяжелым, они были более активны, аппетит удовлетворительный или хороший, быстро восстанавливалась положительная динамика нарастания массы тела. При поступлении температурная реакция была следующей: субфебрильное её повышение отмечено у 31 (56,4%) больного из этой группы, у 9 (16,3%) её повышение носило фебрильный характер. У 15 (27,3%) больных температура тела оставалась в пределах нормы.
Из 47 больных септико-пиемической формой МЭО тяжелым общее состояние было у 37 пациентов (78,7%), что было обусловлено развитием синдрома эндогенной интоксикации. Клинически у этих детей определялись следующие признаки: снижение общей двигательной активности, вялость, кожа и видимые слизистые были сухими, бледными, часто с серовато-землянистым оттенком, тургор мягких тканей снижен, дети отказывались от еды или сосали очень вяло, быстро уставали, динамика массы тела была отрицательной. Косвенными признаками септического процесса были следующие: диарейный синдром у 21 (44,7%) больного, гепатомегалия – у 27 (57,4%), бледность кожных покровов с их серо-землинистым оттенком – у 25 (53,2%), явления гипотрофии – у 28 (59,6%), анемия у 30 (63,8%) больных. У 6 больных (12,8%) состояние было оценено как крайне тяжелое, что было связано с наличием развивающихся полиорганных нарушений на фоне выраженного септического процесса. Общее состояние этих пациентов оставалось крайне тяжелым в течение 5-10 суток. Несмотря на проводимую этиотропную, дезинтоксикационную, корригирующую и симптоматическую терапию симптомы синдрома эндогенной интоксикации (ЭИ) сохранялись с последующим постепенным снижением их интенсивности. Отмечен следующий характер повышения температуры тела при поступлении: у 24 пациентов (51,1%) отмечено её субфебрильное повышение, фебрильное – у 10 (21,3%). У 13 (27,6%) больных температура тела оставалась в пределах нормы с тенденцией к гипотермии. Высокая доля больных с нормальными показателями температуры тела относится к так называемому ареактивному типу, на наличие которого указывают и другие авторы [10, 12]. У таких больных на первый план выходили местные изменения.
Таблица 1. Клинические проявления МЭО у детей раннего возраста
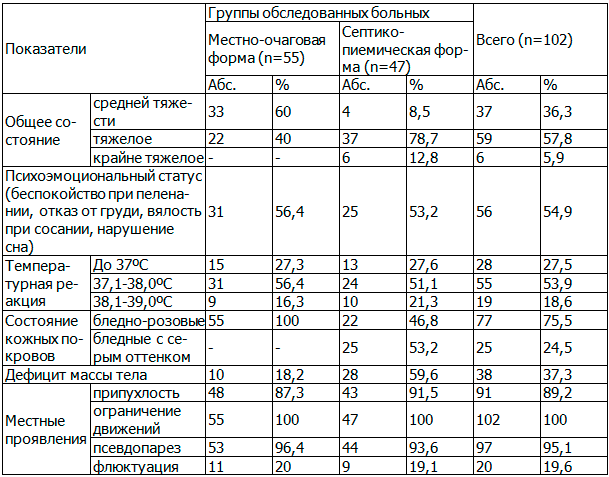
Примечание: здесь и далее n – количество больных.
Первыми общеклиническими признаками начинающегося заболевания, которые указывались родителями при сборе анамнеза, были нарушения со стороны психоэмоционального статуса ребенка: беспокойство, часто связанное с пеленанием, отказ от груди, вялость при сосании, нарушение сна, которые были отмечены у 56 (54,9%) больных. У 74 (72,5%) больных выявлено повышение температуры тела, у всех 102 больных - изменение цвета кожных покровов (бледность), их серый оттенок отмечен у 25 (24,5%) больных, что характерно в группе больных с септико-пиемической формой МЭО (табл. 1).
При оценке изменений массы тела выявлено следующее: её дефицит при поступлении отмечен у 38 (37,3%) больных, причем он более выражен в группе с септико-пиемической формой – 28 (59,6%) пациентов. Данное обстоятельство является косвенным признаком тяжести течения воспалительного процесса.
Характер местных симптомов МЭО зависел от локализации очага поражения. При поражении верхнего метаэпифиза плечевой кости верхняя конечность была разогнута во всех суставах и приведена к туловищу, при поражении дистального – согнута в локтевом суставе. При локализации воспалительного процесса в проксимальном метаэпифизе бедренной кости нижняя конечность была в вынужденном положении, выражающемся в её полусогнутом положении в области тазобедренного и коленного суставов. Данное положение было обусловлено развитием контрактуры сустава, вначале рефлекторного характера как реакции на боль, а затем миогенного, вследствие возникновения внутрисуставной гипертензии, поскольку очаг воспаления располагался близко к суставу и в процесс вовлекался связочный аппарат и параартикулярные ткани.
Из табл. 1 видно, что характерным для МЭО у детей раннего возраста является раннее появление явлений псевдопареза пораженной конечности, характеризующееся свисанием кисти или стопы. В наших наблюдениях у 97 (95,1%) больных. Это объясняется образованием выраженных отеков тканей вокруг очага воспаления, сдавливающих проходящие здесь нервы. По мере уменьшения отеков явления псевдопареза исчезали.
При клиническом осмотре на момент поступления у всех 102 (100%) больных обращало на себя внимание, выраженное в той или иной степени, вынужденное положение конечности, ограничение или полное отсутствие активных движений, реакция плачем и беспокойством на пальпацию или попытку произвести пассивные движения.
Данный симптомокомплекс косвенно указывал на основной симптом МЭО – боль в конечности. Учитывая позднюю обращаемость за хирургической помощью наших больных у 91 (89,2%) из них было выявлено увеличение объема прилежащего сустава за счет отека мягких тканей, при этом отмечалось сглаживание его контуров. При поздно начатом лечении, прорыве гноя из кости в мягкие ткани формируется межмышечная флегмона, отек мягких тканей нарастает, появляется гиперемия кожи, при пальпации определяется флюктуация – у 20 (19,6%) больных. Следует отметить, что гиперемия в области пораженного сустава длительно отсутствует и появляется только в тех случаях, когда развивается выраженная параартикулярная флегмона с воспалением в мягких тканях. Это обусловлено тем, что вначале воспалительный процесс протекает глубоко в тканях, ограничиваясь костью и полостью сустава, и только впоследствии, прорываясь в мягкие ткани, достигает более поверхностных слоев, в результате чего возникает воспалительная реакция в виде гиперемии. При множественных поражениях костей местные изменения были аналогичными.
Оценка локализации очага первичного поражения (табл. 2) показала, что данный очаг выявлялся преимущественно в метаэпифизах длинных трубчатых костей скелета.
Таблица 2. Частота поражения отдельных костей
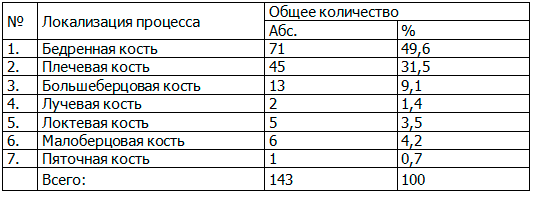
Согласно приведенным данным в табл. 2 у 102 больных отмечалось поражение 143 костей. Чаще всего воспалению подвержены были бедренные кости (49,6% от общего количества). В сумме же с плечевыми и большеберцовыми костями число вовлеченных в воспалительный процесс костей достигло 129 (90,2%).
Локализация и развитие патологического процесса в метаэпифизарных отделах длинных трубчатых костей может вести к возникновению патологического вывиха бедра (при поражении проксимальных отделов бедренных костей), укорочению конечности (при поражении проксимальных отделов плечевых костей, дистальных отделов бедренных, лучевых и локтевых костей) вследствие повреждения ростковых зон. Наиболее часто наблюдалось поражение проксимальных метаэпифизов бедренных и плечевых костей – по 32,3 и 25% соответственно, как более интенсивно растущих. Множественное поражение костей было отмечено у 33 (32,4%) больных.
Образование множественных очагов в костях является особенностью МЭО у детей раннего возраста при септико-пиемической форме заболевания [17], на что указывает высокий процент (70,2%) случаев.
Эффективность лечения детей раннего возраста с МЭО зависит, в первую очередь, от ранней диагностики, своевременно начатого лечения и его адекватного проведения [3, 6, 8, 9, 20, 21]. В первые 3-5 суток болезни было госпитализировано лишь 19 (18,6%) больных, а большую группу (81,4%) составили больные со сроком поступления 6-10 суток и более. В наших исследованиях средними сроками поступления от начала заболевания больных с местно-очаговой формой МЭО стали 11,2±0,88 сутки, а при септико-пиемической – 10,3±0,7 (р<0,001).
Для ранней диагностики МЭО у детей раннего возраста, наряду с клиническим обследованием, нами использовано применение ультразвукового исследования (УЗИ). Данное исследование применено у больных, срок заболевания которых не превышал 10 суток от его начала, преследуя цель выявить ранние ультрасонографические признаки МЭО. Больные, у которых остеомиелитический процесс уже осложнился формированием параартикулярных флегмон на данных сроках заболевания, не были включены в исследование. Исходя из этого, УЗИ было сделано 46 (45,1%) больным при поступлении в стационар, у которых воспалительный процесс локализовался в смежном, пораженному метаэпифизу, суставе. В ходе исследования у 14 (93,3%) больных, поступивших на 3-5 сутки от начала заболевания, были выявлены неоднородность эхоструктуры метаэпифизарных зон пораженных костей с повышением их эхогенности. У всех из них артрит смежного сустава характеризовался умеренным расширением суставной щели за счет реактивного выпота и утолщением суставной капсулы. У 1 больного изменений зарегистрировано не было.
Проведенное сонографическое обследование 31 больному, поступившим на сроках 6-10 суток от начала заболевания, у всех из них выявило различные изменения. Так, у 26 (83,9%) больных была выражена деформация эпифизарного хряща, у 19 (61,3%) – появление периостальной реакции, у 28 (90,3%) – выраженное расширение суставной щели с повышением эхогенности внутрисуставной жидкости, у 23 (74,2%) – нарушение структурности мягких тканей в зоне пораженного сегмента за счёт отёка.
Учитывая то, что использование рентгенологического метода обследования не отвечает требованиям ранней диагностики заболевания [5, 11] данное исследование проводилось с целью топической диагностики области поражения и подтверждения диагноза. Обзорную рентгенографию пораженного сегмента конечности в 2 проекциях проводили больным перед выпиской из стационара. Сроки данного обследования не зависели от сроков начала заболевания и не преследовали цель - определить динамику изменений рентгенологических симптомов.
Согласно полученным данным наиболее частыми рентгенологическими признаками остеомиелитического процесса у детей раннего возраста явились периостальная реакция, явления остеопороза и костной деструкции (табл. 3), причем у многих больных отмечалось сочетание нескольких признаков одновременно. Нужно отметить, что у всех больных, независимо от клинической формы, были выявлены те или иные рентгенологические признаки остеомиелита.
Таблица 3. Рентгенологические признаки МЭО у детей раннего возраста
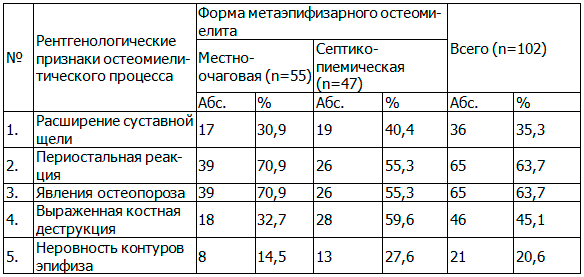
Выраженные костно-деструктивные изменения при МЭО характеризовались вовлечением близлежащего росткового хряща с его последующим разрушением и вовлечением в воспаление всего метаэпифиза. Это вело к развитию артрита прилегающего сустава, который носил гнойный характер. Рентгенологически определялись очаги деструкции в метаэпифизарной зоне, нарушения взаимоотношения костей, образующих сустав, с развитием дистензионных подвывихов и вывихов. Очаги деструкции при этом имели краевое или центральное положение.
При поступлении 94 (92,2%) больным производилось бактериологическое исследование отделяемого из очага воспаления. Забор материала производился путем пункции сустава вовлеченного в воспалительный процесс (внутрисуставной выпот), а также во время оперативного вмешательства из раневого отделяемого.
Согласно нашим данным из произведенных 101 анализа кишечная палочка в монокультуре высеяна в 46 (45,6%) случаях. Общая доля грамотрицательной флоры в монокультуре определена в 52 (51,5%) анализах. На втором месте стоит высеваемость золотистого стафилококка, на долю которого пришлось 19 (18,9%) положительных результатов. Моноинфекция выделена в 74 (73,3%) случаях, а в 4 (3,9%) обнаружена ассоциация возбудителей. Отрицательные результаты посева составили 23 (22,9%) анализа. Отсутствие роста культуры связывали как с недостаточными возможностями бактериологической лаборатории (не определяется анаэробная флора), так и с интенсивным применением антибиотиков до поступления больных в клинику.
Результаты исследования чувствительности микрофлоры к антибиотикам методом стандартных бумажных дисков выявили высокую чувствительность микрофлоры к канамицину (97%), клафорану (96%), таривиду (95%), гентамицину (90%), цефамизину (83%). Определена практически полная устойчивость патогенной микрофлоры к препаратам пенициллинового ряда.
При изучении динамики воспалительного процесса существенными являются качественные и количественные изменения состава периферической крови, позволяющие оценить выраженность его и прогнозировать степень тяжести заболевания в зависимости от его формы.
Из табл. 4 видно, что практически все показатели были достоверно изменены у больных обеими формами МЭО по отношению к нормативным показателям (р<0,001). При этом выявлен достоверный характер изменений показателей гемограмм между самими клиническими формами МЭО, свидетельствующий о более тяжелом течении септико-пиемической формы. Так, снижение содержания эритроцитов у больных с септико-пиемической формой (р<0,001) отразилось на меньшей насыщенности их гемоглобином (96±2,6 г/л против 99,7±2,2 г/л при местно-очаговой форме; р<0,001), увеличение лейкоцитов (р<0,001) сопровождалось увеличением их юных форм (2,8±0,4% против 1,9±0,2% при местно-очаговой форме; р<0,001), снижение уровня моноцитов (6,8±0,5% против 7,9±0,5% при местно-очаговой форме; р<0,001) привело к снижению фагоцитарной активности.
Таблица 4. Гемограмма больных МЭО при поступлении
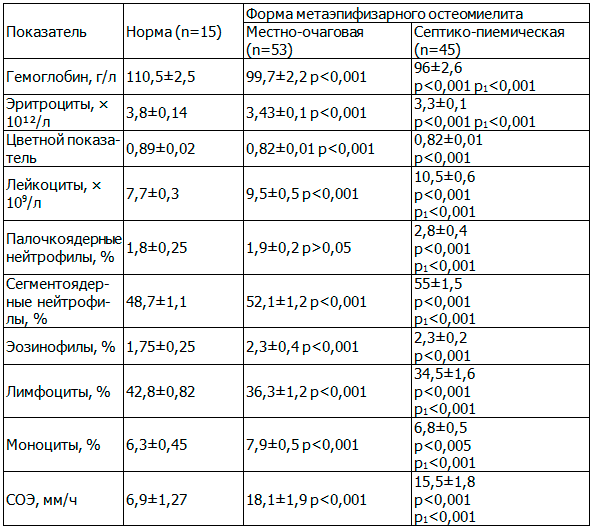
Примечание: р - достоверность различий по сравнению с нормой; р1 - достоверность различий по сравнению с местно-очаговой формой МЭО.
Выводы. Анализ данных клинического обследования больных разными формами МЭО с использованием наиболее распространенных диагностических методов показал, что значительная доля больных МЭО характеризуется поздним поступлением в специализированный хирургический стационар, что связано с разнообразием клинических проявлений МЭО у детей раннего возраста, ошибочной диагностикой патологии на догоспитальном этапе. Остается высокой частота тяжелых и крайне тяжелых форм заболевания с большим количеством септико-пиемических форм МЭО. Ранними ультрасонографическими признаками МЭО являются неоднородность эхоструктуры метаэпифизарных зон с участками повышенной эхогенности. Основным этиологическим фактором в развитии МЭО у детей раннего возраста является кишечная палочка, а на долю грамотрицательной флоры в монокультуре приходится до 51,5% случаев.
