Введение. Вопросы контроля безопасности лекарственной терапии (ЛТ) в широкой клинической практике в последние годы остаются весьма актуальными как для России, так и для всего мирового медицинского сообщества. Сведения Росздравнадзора констатируют, что в нашей стране за 2011 г. было зарегистрировано 12646 сообщений о неблагоприятных побочных реакциях (НПР) лекарственных препаратов (ЛП) [1]. По данным Всемирной Организации Здравоохранения (ВОЗ), НПР являются одной из десяти ведущих причин смерти во многих странах, при этом затраты на госпитализацию и коррекцию их последствий зачастую превышают стоимость самого лечения пациента [2, 3].
С начала 1960-х годов спонтанное сообщение является главным методом уведомления о НПР на лекарства. Традиционно, врачи являются основным источником таких сообщений. Однако, в некоторых странах, фармацевты и медсестры также играют важную роль в предоставлении информации о НПР [4-7]. Несмотря на активную просветительскую работу, ежегодно во всем мире регистрируется не более 10% серьезных НПР и около 4% несерьезных [8].
В последние годы в ряде стран (Австралия, Канада, Дания, Нидерланды, Швеция, Соединенное Королевство и Соединенные Штаты Америки) придается большое значение сообщениям о НПР, полученных непосредственно от пациентов и потребителей ЛП. Так первые отчеты от пациентов начали поступать в Австралии еще с 1964 г., в Норвегии – с 2010 г. [9, 10].
Как показал мировой опыт, пациенты зачастую описывают НПР более подробно, чем медицинские работники, а в 20% случаев по отчетам потребителей регистрируются НПР, которые не были указаны в инструкциях по медицинскому применению (ИМП). Основными мотивами для пациентов, чтобы сообщить о НПР, служат желание поделиться своим опытом (89%), тяжесть НПР (86%), опасения по поводу своего здоровья (63,2%), а также факт, что НПР не упоминается в информационном листке на препарат (57,6%). Кроме того, в 90,7% случаев пациенты считают себя ответственными за предоставление информации о НПР и уверены, что это может предотвратить вред здоровью других людей (93,8%) [11-13].
В нашей стране на протяжении ряда последних лет совершенствуется система фармаконадзора, отмечается повышенное внимание медицинского сообщества к вопросам безопасности фармакотерапии, однако активность специалистов здравоохранения в отношении информирования о НПР остается на низком уровне. Значимость информации о НПР от пациентов и потребителей ЛП в системе фармаконадзора и вовсе недооценивается.
Исходя из вышеизложенного кафедрой клинической фармакологии и фармакотерапии факультета послевузовского профессионального образования врачей Первого МГМУ им. И.М. Сеченова было организовано фармакоэпидемиологическое исследование, целью которого явилось изучение информированности врачей широкой клинической практики, фармацевтических работников, пациентов и потребителей по вопросам безопасности лекарств и фармаконадзора.
Материалы и методы. В исследовании, которое проводилось в 2011-2012 г., приняли участие 1123 респондента: 385 врачей, 187 работников аптек и 551 пациент и/или потребитель лекарств из Северо-Западного, Центрального, Уральского и Сибирского федеральных округов.
Нами было разработано 3 вида анкет: для врачей, фармацевтических работников и пациентов/потребителей ЛП. Анкеты для врачей и фармацевтов содержали по 30 вопросов, позволяющих оценить базовые знания по ключевым вопросам работы системы фармаконадзора, НПР, которые встречаются в повседневной клинической практике, а также необходимости обучения специалистов практического здравоохранения вопросам мониторинга безопасности ЛП.
Анкета для пациентов/потребителей содержала 25 вопросов и варианты ответов к ним, а также поля, для внесения дополнительной информации непосредственно самим участником анкетирования. Опросник позволил оценить мнение потребителей/пациентов относительно отпуска лекарств в аптеках, ИМП, эффективности и безопасности ЛТ.
С целью обработки результатов фармакоэпидемиологического исследования была сформирована электронная база, в которую вносились сведения из анкет. Анализ результатов опроса проводился с использованием методов описательной статистики и применением пакета программ Microsoft Excel 2003, BIOSTAT. Результаты представлены в виде среднего значения и стандартного отклонения (μ±σ), абсолютных значений и процентного соотношения величин.
Полученные результаты. Из врачей, участвующих в анкетировании, большую часть (235 чел, 61%) составили специалисты первичного звена – терапевты (151 чел.), кардиологи (26 чел.), педиатры (42 чел.) и акушеры-гинекологи (16 чел.); остальные респонденты (150 чел., 39%) были узкими специалистами (пульмонологи/фтизиатры, гастроэнтерологи, инфекционисты, урологи, нефрологи, эндокринологи, ревматологи, невропатологи, офтальмологи, оториноларингологии, гематологи, травматологи, анестезиологи, рентгенологи, хирурги, кардиохирурги, клинические фармакологи). Стаж работы респондентов-врачей составлял от одного года (выпускники медицинских ВУЗов, интерны, ординаторы) до 50 лет (средний стаж - 17,28±12,51 г).
Из фармацевтических работников в опросе участвовало 127 провизоров (68%) и 60 фармацевтов (32%) со стажем работы от 0 до 37 лет (в среднем - 6,86±8,18 г).
Анкетирование среди пациентов проводилось в стационарах и поликлиниках, потребители лекарств заполняли анкеты в аптеках. Среди опрошенных было 407 женщин (74%) и 144 мужчины (26%) в возрасте от 18 до 77 лет (средний возраст – 44,03±18,42 г).
Оценка базовых знаний медицинских работников в области фармаконадзора
Один блок вопросов в анкетах для медработников был направлен на оценку базовых знаний в области фармаконадзора. Последний цикл усовершенствования по своей специальности респонденты проходили в 2006-2012 г., при этом только 14% врачей и 57% фармацевтов отметили, что на циклах обсуждались вопросы фармаконадзора.
По данным анкетирования, 81% врачей и 43% фармацевтов регулярно посещают конференции и конгрессы разного уровня, однако, по мнению респондентов, вопросы безопасности ЛТ на них обсуждаются только в 19% случаев, в основном доклады посвящены эффективности терапии по результатам клинических исследований (52%), преимуществам одних препаратов и недостаткам других (33%), а так же схемам и стандартам терапии (27%). При этом 95% врачей и 75% фармацевтов проявляют повышенный интерес к проблеме безопасности фармакотерапии.
Нами установлено, что большинство медработников затрудняется в вопросах терминологии, установлении причинно-следственных связей НПР- ЛП, критериев серьезности НПР.
Опрос показал, что около половины медицинских работников (47% врачей и 51% фармацевтов) относительно верно формулируют термин «фармаконадзор», включая в это понятие деятельность по контролю и надзору за качеством, эффективностью и безопасностью лекарств. Более трети (39% врачей и 31% фармацевтов) считают, что это орган исполнительной власти, контролирующий производство и оборот ЛП, остальные не знают или затрудняются ответить.
Термин «неблагоприятная побочная реакция» верно трактуют только 13% врачей и 46% фармацевтов; 39% врачей и только 8% фармработников считают, что это реакции, не требующие отмены препарата; 34% фармацевтов считают, что это реакции требующие применения других ЛП, а 19% врачей считают, что это аллергическая реакция, сонливость, тошнота, диарея и т.п. Около 30% врачей и только 12% фармработников не знают или затрудняются с ответом.
Мнение медработников и потребителей об эффективности и безопасности ЛП
При выборе лекарств для большинства медработников важны эффективность (93% врачей и 90% фармацевтов) и безопасность (87% врачей и 79% фармацевтов), в меньшей степени качество и стоимость препаратов (рис. 1).
Потребители наиболее важными характеристиками препаратов считают эффективность (64%) и качество (57%), безопасность отмечает каждый второй (49%), каждый третий (37%) - стоимость. По нашему мнению, причиной более пристального внимания пациентов к качеству лекарств является боязнь приобрести фальсифицированный продукт, а заниженное внимание к безопасности препаратов можно объяснить недостатком просветительской работы среди населения.
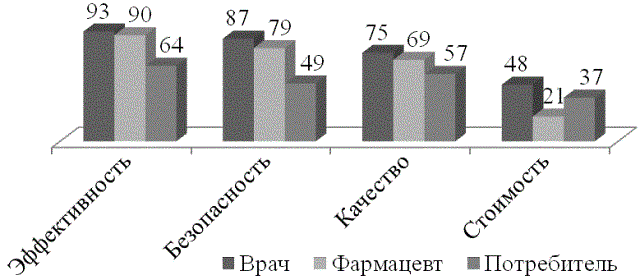
Рис. 1. Значимость основных характеристик ЛП для медицинских работников и потребителей (%)
Из числа опрошенных потребителей и пациентов подавляющее большинство (73%) положительно относится к тому, что в аптеках можно купить практически все лекарства без рецепта врача. Фармацевты, напротив, только в 22% случаев рассматривают этот факт с положительной точки зрения. Основными аргументами со стороны потребителей являются «удобство и экономия времени», «свобода выбора», «доступность любых лекарств вплоть до сильнодействующих» и «сложности с походом в поликлинику и очередями к врачам». Фармацевты считают, что «это бизнес», «экономия времени».
Только 27% потребителей и 78% работников аптек отрицательно относятся к безрецептурному отпуску лекарств. Потребители считают, что «самолечение опасно и может вызвать побочные эффекты», «лекарства могут попасть в руки детей или преступников, что очень опасно» и факт, что «в аптеках часто рекомендуют более дорогие лекарства».
Фармацевты также считают «опасным самолечение», полагают, что «врачи перекладывают ответственность на работников первого стола» и вместе с тем отмечают, что «посетители часто сами склоняют их к свободному отпуску рецептурных лекарств, а отказ часто приводит к конфликту».
При выборе ЛП 87% потребителей прислушиваются к совету врача, каждый третий (31%) - к совету фармацевта и средств массовой информации (передачи о здоровье, интернет, медицинские издания для потребителей), 17% покупают лекарства по совету знакомых и родственников. Однако на практике покупают ЛП, назначенные врачом, только 62% больных, предложенные в аптеке - только 2%, остальные 42% предпочитают самолечение или могут купить только часть назначенных препаратов (рис. 2).
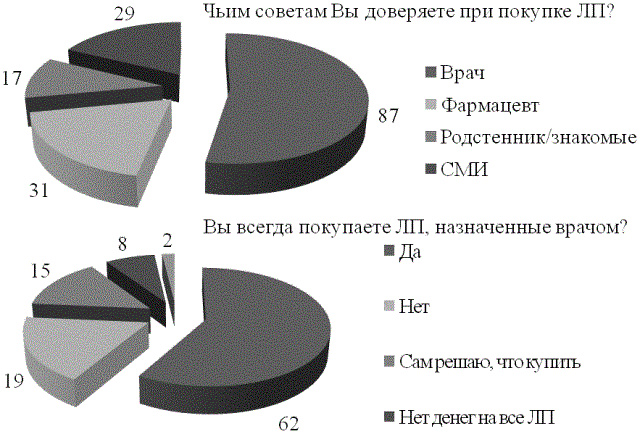
Рис. 2. Предпочтения пациентов при покупке ЛП в аптеке (%)
В широкой клинической практике 68% врачей, 33% фармработников и каждый второй пациент (51%) отмечают случаи развития НПР. При этом пациенты, столкнувшись с НПР, в 72% случаев сообщают об этом врачу и только 2% - фармработникам; 40% больных сразу отменяют препарат, 5% уменьшают дозу и кратность приема, 2% - отдают ЛП родным или знакомым – «мне не подошло, может другому подойдет».
На наш взгляд обращает на себя внимание тот факт, что только четверть (24%) врачей и 5% работников аптек, участвующих в анкетировании, заполняют специальную форму извещение о НПР. Большая часть врачей (78%) ограничивается тем, что делает запись в амбулаторной карте/истории болезни, отменяет препарат (80%), выясняет связь приема ЛП и развившейся НПР (59%). Фармацевты пытаются установить связь НПР-ЛП (47%), отменяют препарат (46%) и сообщают представителю фармкомпании или заведующему аптеки о случае обращения потребителя с НПР (рис.3).
Настораживает, что 4% врачей и 19% фармработников не сообщают о НПР, при этом врачи ссылаются на «нехватку времени», «незнание куда и как отправить форму отчета о НПР», некоторые вовсе считают это «нецелесообразным» и «не задумывались об этом ранее». Относительно фармацевтов важно подчеркнуть имеющее место равнодушие («мне все равно») и мнение, что «побочный эффект одного препарата можно легко снять другим лекарством, поэтому нет необходимости об этом сообщать».
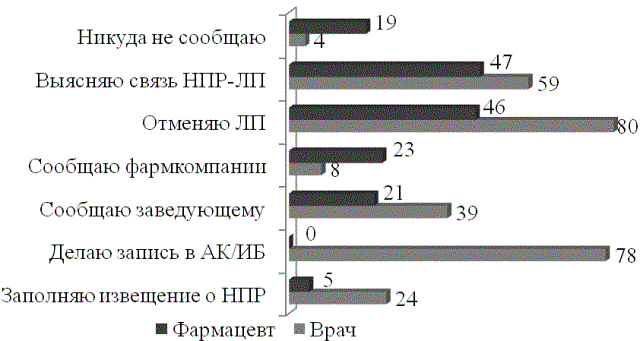
Рис. 3. Действия медицинских работников при выявлении НПР (%)
Абсолютное большинство респондентов (91% медработников и 90% потребителей) отметили необходимость создания единой базы данных об эффективности, безопасности, качестве ЛП и фальсификатах, которая должна находиться в открытом доступе в сети Интернет.
Мнение работников здравоохранения и потребителей о ИМП на ЛП. На наш взгляд было важным оценить мнение работников здравоохранения и пациентов/потребителей относительно ИМП.
Опрос показал, что менее половины врачей и фармацевтов (42% и 39% соответственно) читают медицинские инструкции, вложенные в упаковку к препаратам или приведенные в лекарственных справочниках, при этом 6% медработников изучают эту информацию редко, 16% фармработников и 7% врачей никогда не читают информацию такого рода. Основной необходимостью обращения врача и фармацевта к инструкции служит уточнение дозировок (55% и 48% соответственно), лекарственных взаимодействий (58% и 44%) и побочных эффектов (59% и 39%).
Наше анкетирование показало, что недостаточное внимание к информации, изложенной в инструкциях, ведет к тому, что 54% фармаработников и 23% врачей рекомендуют лекарства с нарушением предписаний к применению (off-label), по несоответствующим показаниям и в неадекватных дозировках, при этом 44% применения ЛП off-label приходится на педиатрическую практику.
В ряде зарубежных исследований сообщается о том, что 36-67% детей получают в стационарах лекарства, запрещенные к применению в детском возрасте [14,15].
Кроме того, назначение препаратов с нарушением предписаний в инструкции приводит к развитию нежелательных реакций [16]. Так по данным Росздравнадзора за 2009-2011 г. число НПР, связанных с применением лекарств off-label составило 18% от общего числа поданных извещений, из них 35,6% сообщений было отнесено к категории серьезных; 67% были связаны с нарушением режима дозирования или кратности введения препарата, 32,4% применялись по незарегистрированному показанию [17].
По данным нашего опроса, респонденты из группы потребителей в 78% случаев всегда читают ИМП, 20% - иногда и только 2% совсем нечитают. Важно отметить факт, что эти данные согласуются с ответами на вопрос «Читаете ли Вы в инструкции раздел «Побочные эффекты?»: всегда – 76%, иногда – 20%, никогда – 4%. Таким образом, для потребителей, изучающих информацию о препарате, важна безопасность терапии.
Менее половины (47%) опрошенных пациентов отметили, что им понятен текст ИМП. Большинство (84%) респондентов сообщили, что нуждаются в доступной информации, так как обилие медицинских терминов и перечисленных в инструкции возможных побочных эффектов вынуждает пациента иногда отказаться от приема препарата.
В Европе, данная проблема решается путем утверждения нового шаблона инструкции по применению ЛС для стран Евросоюза. Согласно положению, принятому в 2011 г. Европейским Медицинским Агентством (European Medicines Agency – EMA), информация в листовках на ЛП должна быть легко читаемой для пациентов и потребителей, содержащей новые сведения о преимуществах лекарств, их пользе и рисках, а также сведения о применении у детей [18]. Аналогичные меры в нашей стране могли бы способствовать большей информированности населения о фармакотерапии.
Обсуждение. Анализ литературных данных и результатов нашего исследования свидетельствует о высокой актуальности проблемы безопасности фармакотерапии в широкой клинической практике.
Врачи и фармацевтические работники являются ключевым звеном системы фармаконадзора, однако активность в выявлении, регистрации и сообщении о НПР в регулирующие инстанции все еще остается на низком уровне. Проведенное в 2004-2005 г. в г. Челябинске анкетирование с участием 131 врача и 148 фармацевтических работников показало, что медработники считают выявление НПР своим профессиональным долгом. При этом 82,4% врачей знают о необходимости регистрации НПР, но подавали извещения только 9,2% опрошенных, а 57,1% фармработников не знали о том, что о НПР следует сообщать в органы фармаконадзора [19].
Наше исследование, проведенное в разных городах России и включающее большую выборку, показало, что за прошедшие 6 лет ситуация с информированием о НПР остается сложной – подают извещения только 24% врачей и 5% фармработников.
Относительно базовых знаний медработников, наши данные согласуются с результатами исследований зарубежных авторов [4, 16]. Так Chopra D. и соавторы (2011) приводят сведения, что из 100 опрошенных врачей, работающих в клиническом госпитале, только 66% знают об отчетности по НПР, меньше половины из них верно трактуют термины фармаконадзор и НПР (38% и 40% соответственно), 74% считают, что репортировать следует только о реакциях на новые препараты, серьезных и необычных реакциях, треть респондентов (30%) никогда не сообщали о НПР [20].
Необходимость специальных обучающих программ и циклов тематического усовершенствования по вопросам безопасности лекарственной терапии в нашем исследовании отметили 91% фармработников и 79% врачей, остальные сочли достаточным прослушивание лекций по фармаконадзору в программах сертификационных циклов постдипломного образования.
Зарубежные авторы подчеркивают [4, 20-22], что непрерывное образование в области фармаконадзора на специализированных обучающих семинарах, курсах подготовки и переподготовки является ведущим фактором улучшения отчетности о НПР среди медицинских работников. При этом было отмечено, что наличие форм отчетности о НПР в общедоступных местах без соответствующего обучения их заполнению малоэффективно.
Потребители, пациенты и их организации становятся все более и более вовлеченными в фармаконадзор. ВОЗ и Еврокомиссия признают роль потребителей в непосредственном сообщении о НПР.Необходимость создания руководства по потребительской отчетности обсуждалась на 31-м совещании Национального Центра фармаконадзора в Упсале 20-23 октября 2008 г, и разработка этой публикации была включена в цели Седьмой рамочной программы Управления Исследований Еврокомиссии и ее проекта по мониторингу лекарств. Немногим позднее (в 2010 г.) Европарламент одобрил новое Законодательство в области фармаконадзора, согласно которому в сети Интернет в свободном доступе должна публиковаться информация о НПР, а потребители лекарств признаны активными участниками системы фармаконадзора [23, 24].
В 2012 г. ВОЗ опубликовала Рекомендации по созданию системы «потребительской отчетности» [25]. ВОЗ подчеркивает, что отчеты потребителей являются дополнительным источником о нежелательных реакциях, особенно о ранее неизвестных и не могут рассматриваться как альтернатива отчетам работников здравоохранения.
Потребительские отчеты являются особенно ценными при выявлении НПР на препараты безрецептурного отпуска и лекарственного растительного сырья, они предоставляют информацию о том, как фактически используются лекарства, о случаях потенциальных взаимодействий лекарств, о комплаенсе терапии. Один недостаток состоит в том, что потребители редко сообщают точный диагноз, однако это может расцениваться и как преимущество, потому что исключает влияние на тот факт, что НПР уже известна, кроме того, потребители могут сообщать о реакциях, которые на первый взгляд кажутся маловероятными с медицинской точки зрения.
Учитывая мировой опыт и результаты нашего исследования, в России также необходимо повышение роли потребителей и пациентов в системе фармаконадзора, крайне важна разработка и внедрение специальных форм-извещений, а также активная просветительская работа среди населения.
Выводы
1. Проведенное нами фармакоэпидемиологическое исследование показало, что вопросы эффективности и безопасности ЛТ актуальны как для медицинских работников, так и для пациентов.
2. Назрела необходимость создания в нашей стране в открытом доступе базы ЛП, содержащей сведения об их качестве, эффективности и безопасности.
3. Потребители ЛП нуждаются в «информационных листах пациентов» на доступном для них языке. Привлечение потребителей к системе отчетности позволит повысить выявление НПР.
4. Активная просветительская работа среди медицинских работников и потребителей будет способствовать повышению безопасности ЛТ и совершенствованию системы фармаконадзора в России.
