Введение. Разработка новых фитоадаптогенов является актуальной задачей. Большинство растений с адаптогенными свойствами произрастают на территории Сибири, Дальнего Востока, в странах Юго-Восточной Азии, их ресурсы истощены. Поэтому оправдан поиск новых, доступных источников фитоадаптогенов. Перспективен в этом отношении экстракт коры осины (ЭКО). Он известен в основном как противовоспалительное, болеутоляющее, противоязвенное средство [3, 14]. На кафедре фармакогнозии Национального фармацевтического университета (г. Харьков) получен сухой ЭКО по технологии, указанной в [12]. Нами показано, что ЭКО содержит значительное количество простых фенолов в пересчете на салидрозид (в среднем 2,71%) и в дозах, превышающих противовоспалительные (порядка 1 г/кг), обладает адаптогенным действием, повышая физическую работоспособность, в том числе в условиях иммобилизационного стресса (ИС), и устойчивость к холоду, стимулируя центральную нервную систему [8-10].
Цель исследования: оценить некоторые биохимические механизмы стресспротекторного действия ЭКО и его влияние на гистоструктуру надпочечников в условиях ИС.
Материалы и методы исследования. Объектом исследования прослужил водный раствор сухого экстракта коры осины обыкновенной (Рopulus tremula L.), семейство ивовых (Salicaceae). Препарат сравнения (экстракт родиолы жидкий (ЭРЖ), лишенный спирта путем упаривания на водяной бане), выбран по фитохимическому признаку (салидрозид является одним из основных действующих веществ) и по наличию стресспротекторных свойств [4, 7, 13, 17].
Опыты проведены на 48 белых нелинейных крысах-самцах массой 180-200 г. В 1-й серии опытов у 18 крыс моделировали острый иммобилизационный стресс (ОИС) путем атравматичной фиксации животных на спине на 3 часа [2, 15] после 2-недельного введения ЭКО (1 г/кг) или ЭРЖ (1 мл/кг) в желудок. Крысы группы контрольной патологии (КП) и интактного контроля (6 животных) получали эквивалентное количество воды. Через 2 часа после иммобилизации животных забивали под пропофоловым наркозом путем дислокации шейных позвонков. В крови определяли содержание глюкозы (глюкозооксидазным методом), пирувата, лактата [5, 11] и соотношение последних. В гомогенате скелетных мышц определяли активность креатинфосфокиназы (КФК) (стандартный набор фирмы «Lachema», Чехия), гликоген после его полного гидролиза по количеству образовавшейся глюкозы [5]. В гомогенате печени определяли гликоген, ТБК-реактанты по реакции с тиобарбитуровой кислотой [1], активность супероксиддисмутазы (СОД) – по торможению окисления кверцетина [6]. Результаты обрабатывали статистически с использованием критерия t Стьюдента.
Во 2-й серии опытов у 18 крыс моделировали хронический иммобилизационный стресс (ХИС) путем 16-часовой иммобилизации в тесных пеналах ежедневно в течение 15 суток [15], в течение которых они получали ЭКО, ЭРЖ в вышеуказанных дозах или воду; 6 животных служили контролем. По окончании опыта животных подвергали эвтаназии, извлекали надпочечники, которые фиксировали в 10% нейтральном формалине, промывали, обезвоживали этиловым спиртом и заливали в парапласт. Готовили серии срезов толщиной 3-5 мкм. Срезы окрашивали гематоксилином-эозином. Использовали световой микроскоп Olympus BH-2. Придерживались требований биоэтики согласно Национальным «Общим этическим принципам экспериментов на животных», соответствующим положениям «Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей» [16].
Результаты и их обсуждение. Под влиянием ОИС у крыс группы КП статистически значимо уменьшалась активность КФК в скелетных мышцах в среднем на 27,0% (р<0,05), что может свидетельствовать о нарушении энергетического обмена (табл.1). На фоне применения ЭКО и ЭРЖ это снижение составило только 7,8% и 11,3% соответственно, не достигая достоверного уровня. Содержание гликогена в мышцах и печени животных группы КП понижалось на 31,8-41,1% (р<0,002), отражая истощение этого энергоемкого субстрата. Оба исследуемых фитопрепарата способствовали нормализации данного показателя, который оставался достоверно пониженным в сравнении с интактным контролем только в печени на 13,7-18,5% (р<0,01).
В группе КП имеет место активация перекисного окисления липидов (ПОЛ), о чем свидетельствует увеличение содержания в печени ТБК-реактантов на 122% на фоне истощения антиоксидантной защиты (активность СОД снизилась на 38,1%, р<0,01), ЭКО и ЭРЖ одинаково эффективно устраняли эти изменения.
Усиление гликогенолиза в скелетных мышцах и печени сопровождалось увеличением концентрации глюкозы в крови крыс группы КП. При этом наблюдалось накопление лактата (его содержание возросло на 193%, р<0,001) на фоне значительно меньшего увеличения пирувата (на 38,2%, р<0,001). Это свидетельствует о неполном окислении глюкозы с развитием ацидоза. Соотношение лактат/пируват увеличилось на 110% (р<0,001). ЭКО и ЭРЖ нормализовали концентрацию глюкозы в крови, что указывает на её усиленную утилизацию тканями, эффективно препятствовали накоплению лактата и пирувата (последний показатель на фоне ЭКО полностью нормализовался), а также способствовали нормализации соотношения лактат/пируват. Оно осталось недостоверно увеличенным в сравнении с интактным контролем на 24,3% в группе ЭРЖ и на 12,5% в группе ЭКО, что свидетельствует об антиацидотическом действии обоих препаратов.
Таблица 1. Сравнительное влияние экстракта коры осины и экстракта родиолы жидкого на биохимические показатели крыс на фоне иммобилизационного стресса, M±m
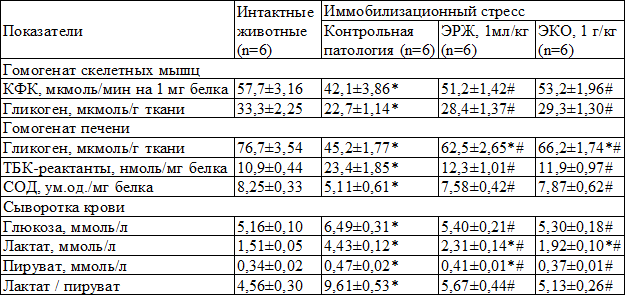
Примечания: ЭКО – экстракт коры осины, ЭРЖ – экстракт родиолы жидкий, КФК – креатинфосфокиназа, СОД – супероксиддисмутаза; * – р<0,05 в сравнении с интактными животными, # – р<0,05 в сравнении с контрольной патологией
Полученные результаты благоприятного влияния ЭКО на биохимические маркеры стресс-реакции обусловили целесообразность дальнейшего изучения стресспротекторных свойств, в качестве критерия которых использовано влияние на гистоструктуру стрессчувствительного органа – надпочечников. Выбор модели ХИС для этих исследований обусловлен тем, что структурные изменения, как правило, требуют большего времени. Как видно из рис.1а,б, надпочечники интактных крыс имеют нормальную гистоструктуру, соответствующую описанной в литературе.
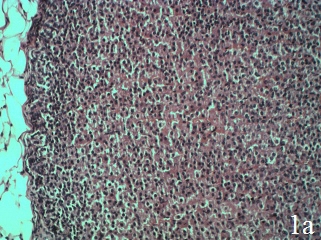
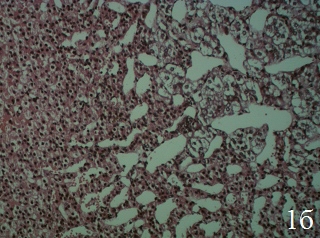
Рис. 1. Надпочечник крысы интактной группы, ×100; окраска гематоксилин-эозин; нормальное строение: а – клубочковой и пучковой зон коры, б – сетчатой зоны коры и мозгового вещества
У крыс группы КП (рис.2а) часто встречаются некротизированные, деструктурированные клетки клубочковой зоны коры с признаками вакуольной дистрофии и темными ядрами. В отличие от надпочечников интактных крыс, между капсулой и клубочковой зоной, а также между клубочковой и пучковой зоной не выявляются малодифференцированные клетки. Пучковая зона расширена, представлена тяжами эндокриноцитов кубической и призматической формы, большинство которых имеет цитоплазму с многочисленными вакуолями. Ядра эндокриноцитов пучковой зоны округлой и овальной формы, нормо- и гиперхромные, увеличены в размерах. Небольшое количество клеток некротизировано. Клетки сетчатой зоны коры надпочечников по форме подобны таковым в пучковой зоне, однако их размеры меньше. Ядра клеток сетчатой зоны нормо- и гиперхромные. На границе коркового и мозгового вещества обнаружены микрокистозные полости, возникшие после деструкции клеток сетчатой зоны коры надпочечников (рис.2б).
В стенках артериол коркового вещества надпочечников эндотелиальная выстилка не сплошная, выявляются участки десквамации и регенерации эндотелиоцитов. В субэндотелиальном слое стенки артериол имеет место выраженный отёк. В среднем слое отмечается гипертрофия и гиперплазия гладких миоцитов. Просвет вен расширен, в них наблюдается агрегация эритроцитов, а также повышенная адгезия и диапедез лейкоцитов через стенки вен. Просветы капилляров коркового вещества расширены, в них выявляется сладж эритроцитов. Базальная мембрана в стенке капилляров неоднородная, местами разрыхлена с признаками отека. Обнаруживаются участки деструкции коллагеновых волокон в базальной мембране. Вокруг капилляров имеют место диапедезные кровоизлияния и отек интерстиция (рис. 2б).
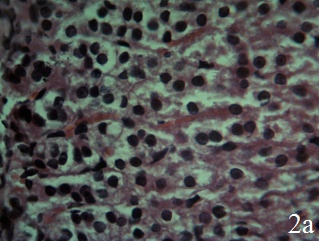
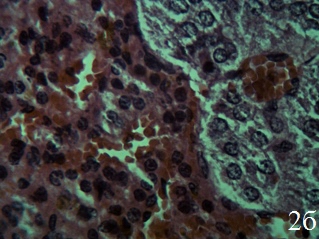
Рис. 2. Надпочечник крысы группы контрольной патологии (хронический иммобилизационный стресс без лечения, 15-й день), ×400; окраска гематоксилин-эозин; а – дистрофические и некробиотические изменения в эндокриноцитах клубочковой зоны и гипертрофия эндокриноцитов пучковой зоны коры надпочечников; б – клетки сетчатой зоны кубической формы, ядра гиперхромные. Просветы кровеносных капилляров сетчатой зоны и мозгового вещества значительно расширены, полнокровны. Вокруг капилляров диапедезные кровоизлияния и отёк интерстиция
Интерстиций мозгового вещества отёчный. Просветы кровеносных капилляров мозгового вещества значительно расширены, полнокровны. Вокруг капилляров имеются диапедезные кровоизлияния. Таким образом, при хронической иммобилизации выявляются дистрофические и некробиотические изменения в эндокриноцитах клубочковой зоны и гипертрофия эндокриноцитов пучковой зоны коры надпочечников, отёк интерстиция мозгового вещества. Развиваются значительные нарушения кровообращения в надпочечниках. Отсутствие малодифференцированных клеток между капсулой и клубочковой зоной, а также между клубочковой и пучковой зоной, а также очаговый некроз эндокриноцитов указывает на истощение адаптационных механизмов.
Гистоструктура надпочечников крыс, получавших ЭРЖ, напоминает таковую интактных животных. В пучковой зоне коркового вещества надпочечников расположены клетки со светлой вакуолизированной цитоплазмой. Их ядра увеличены в размерах, нормохромные (рис.3а). Количество некротизированных эндокриноцитов значительно меньше, чем в группе КП. Между капсулой и клубочковой зоной, а также между клубочковой и пучковой зоной выявляются очаги малодифференцированных клеток с фигурами митоза. Пучковая зона расширена, в ней расположены большие кубической и призматической формы клетки, которые создают радиально направленные тяжи, ориентированные перпендикулярно к поверхности надпочечников. В сетчатой зоне часто встречаются клетки с темной цитоплазмой и нормохромными ядрами. Сосуды микроциркуляторного русла сетчатой зоны умеренно полнокровны, просветы вен и капилляров незначительно расширены, эндотелиальная выстилка сплошная (рис. 3б).
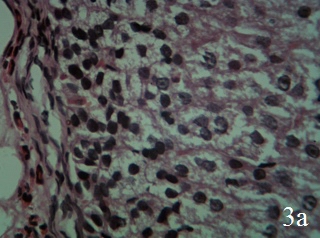
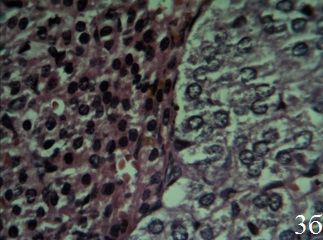
Рис. 3. Надпочечник крысы, получавшей экстракт родиолы жидкий на фоне гипокинезии (15-й день), ×400; окраска гематоксилин-эозин; а – гипертрофия клеток пучковой зоны коры; б – анизохромия клеток и умеренное полнокровие сосудов микроциркуляторного русла сетчатой зоны коры; мозговое вещество отграничено от коркового тонким слоем соединительной ткани, клетки мозгового вещества гипертрофированы капилляры в мозговом вещества расширены, полнокровны
Адгезия и диапедез лейкоцитов через стенки вен слабо выражены. Базальная мембрана в капиллярах однородно окрашена, по структуре подобна такой у интактных крыс, отёк интерстиция не выражен. В периваскулярных пространствах расположены одиночные лимфоциты. Мозговое вещество отделено от коркового вещества несплошной прослойкой соединительной ткани, построено из больших гипертрофированных клеток округлой и полигональной формы. Просветы капилляров в мозговом веществе расширены, полнокровны. Отёк интерстиция в периваскулярных пространствах не выражен. Отсутствуют диапедезные кровоизлияния.
Итак, на фоне применения ЭРЖ деструктивные изменения в эндокриноцитах клубочковой и пучковой зон надпочечников меньше выражены по сравнению с таковыми в группе КП. В условиях гипокинезии его применение вызывает гипертрофию эндокриноцитов вышеуказанных зон. Кроме того, ЭРЖ при гипокинезии уменьшает адгезию и диапедез лейкоцитов через стенки вен.
При применении ЭКО изменения в надпочечниках существенно не отличаются от таковых в группе ЭРЖ. В структуре коркового вещества надпочечников прослеживается четкая архитектоника всех зон. Соединительная капсула истончена, но без признаков отёка. Цитоплазма клеток клубочковой зоны содержит многочисленные вакуоли, ядра нормохромные, с хорошо выраженными ядрышками (рис. 4а). Участки некроза отсутствуют, изредка встречаются клетки с признаками вакуольной дистрофии и мелкими темными ядрами. В отличие от надпочечников крыс, получавших ЭРЖ, участки с повышенной пролиферацией клеток между капсулой и клубочковой зоной, а также между клубочковой и пучковой зоной встречаются чаще (рис. 4а).
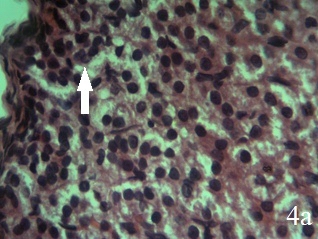
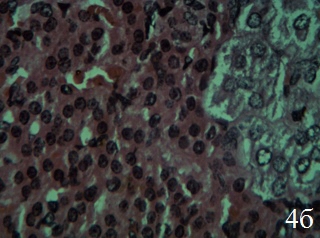
Рис. 4. Надпочечник крысы, получавшей экстракт коры осины на фоне гипокинезии (15-й день), ×400; окраска гематоксилин-эозин; а – клетки пучковой зон коры гипертрофированы, со светлой цитоплазмой и многочисленными вакуолями, ядра увеличены, нормохромные. Малодифференцированные клетки между клубочковой и пучковой зонами (стрелка); б – гипертрофия эндокриноцитов сетчатой зоны коры, норэпинефроцитов и эпинефроцитов в мозговом веществе, умеренное полнокровие капилляров
Эндокриноциты пучковой зоны гипертрофированы, имеют призматическую и кубическую формы. Цитоплазма большей части клеток темная с множеством мелких вакуолей, ядра гипертрофированные, нормохромные. Увеличено количество двуядерных клеток в сравнении с надпочечниками крыс группы ЭРЖ. Отсутствуют деструктивные изменения в эндотелиоцитах стенки сосудов микроциркуляторного русла. В сетчатой зоне клетки преимущественно со светлой цитоплазмой и большими светлыми ядрами. Клетки с темной цитоплазмой и гиперхромными ядрами встречаются значительно реже, чем в группе ЭРЖ. Просветы кровеносных сосудов умеренно расширены, полнокровны. Отсутствуют участки десквамации эндотелиоцитов, отёк интерстиция в периваскулярных пространствах не выражен (рис.4б). Эндокриноциты сетчатой зоны увеличены в размерах, но гипертрофия выражена меньше, чем в пучковой зоне. Изменения в мозговом веществе надпочечников и в сосудах микроциркуляторного русла схожи с таковыми на фоне ЭРЖ. Имеет место Имеет место гипертрофия норэпинефроцитов и эпинефроцитов, в цитоплазме большое количество мелких вакуолей. Просветы кровеносных капилляров расширены, умеренно полнокровны, эндотелиоциты и базальная мембрана по строению близки к таковым у интактных животных (рис.4б).
Следует подчеркнуть, что ЭКО на фоне хронической гипокинезии уменьшает деструктивные изменения в эндокриноцитах клубочковой и пучковой зоны коры надпочечников, снижает диапедез лейкоцитов и просачивание плазмы сквозь стенки сосудов. Эти результаты, как и уменьшение биохимических нарушений в условиях ОИС, а также описанные ранее повышение физической работоспособности в обычных и осложненных условиях, фригопротекторная активность, антидепрессивные и положительные мнемотропные свойства, повышение исследовательской активности (в отличие от ЭРЖ, в сочетании с мягким седативным эффектом) в условиях эмоционального стресса (тест открытого поля) [8-10] доказывают наличие у ЭКО адаптогенных свойств и обосновывают целесообразность создания на его основе нового адаптогенного препарата.
Выводы
1. Экстракт коры осины (1 г/кг) обладает стресс-протекторным действием на модели острого иммобилизационного стресса у крыс, не уступая экстракту родиолы жидкому (1 мл/кг). В биохимическом механизме стресс-протекторного эффекта принимают участие улучшение энергетического обмена и антиоксидантные свойства.
2. В условиях хронического иммобилизационного стресса экстракт коры осины, как и экстракт родиолы жидкий, способствует сохранению гистоструктуры коры и мозгового слоя надпочечников, что проявляется в уменьшении деструктивных изменений в эндокриноцитах коры надпочечников, уменьшении диапедеза лейкоцитов и просачивания плазмы крови через стенки сосудов.
3. Наличие стресс-протекторной активности у экстракта коры осины подтверждает его адаптогенные свойства и обосновывает целесообразность создания на его основе нового фитоадаптогена.
