Гипоксия представляет собой универсальный патологический процесс, сопровождающий и определяющий развитие самой разнообразной патологии, в том числе и хирургической [1,19]. В литературе имеются разрозненные сведения об иммунодефиците, возникающем при гипоксических состояниях, при этом механизмы развивающихся иммунометаболических расстройств, остаются еще не до конца изученными [7,13]. Практически не исследованным является вопрос об участии эритроцитов, тромбоцитов, гепатоцитов, оксида азота в иммуносупрессорных механизмах при гипоксии. Сложность схем фармакологической коррекции метаболических нарушений при гипоксических состояниях определяется тем, что в эти процессы вовлечены функциональные системы транспорта и потребления кислорода на разных уровнях организации – от дыхательного центра и внешнего дыхания до митохондрий в клетках жизненно важных органов [4,14]. В связи с этим очевидно, что, несмотря на широкие возможности применения разнообразных по месту приложения действия антиоксидантов и антигипоксантов, до настоящего момента отсутствует систематизация данных относительно патогенетического обоснования эффективности и целесообразности применения тех или иных способов медикаментозной коррекции иммунометаболических расстройств при гипоксии различного генеза.
Цель работы – изучить возможности фармакологической коррекции иммунных и метаболических нарушений при основных видах системной гипоксии в эксперименте.
Материалы и методы. Эксперименты выполнены на крысах Вистар массой 180–210 г. с соблюдением принципов, изложенных в «Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей».
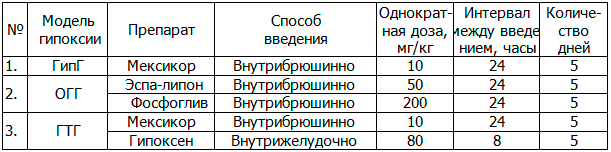
Интервальную гипоксическую гипоксию (ГипГ) вызывали путем помещения крыс в гермокамеры одинакового объема до появления признаков терминальной стадии гипоксии 1 раз в сутки в течение 5 дней с интервалом в 24 часа. Острую гемическую гипоксию (ОГГ) моделировали одномоментной кровопотерей из бедренной вены из расчета 10 мл/кг веса. Гистотоксическую гипоксию (ГТГ) моделировали путем пятикратного через 24 часа внутрибрюшинного введения нитропруссида натрия в дозе 1 мг/кг веса.
У экспериментальных животных оценивали показатели, характеризующие адаптивный и врожденный иммунитет. О выраженности гуморального иммунного ответа (ГИО) на эритроциты барана (ЭБ) судили по количеству антителообразующих клеток (АОК) в селезенке [21]. Клеточный иммунитет оценивали в реакции гиперчувствительности замедленного типа (ГЗТ), индуцированной ЭБ, по разнице масс регионарного и контрлатерального лимфоузлов (РМЛ) [20]. Функционально-метаболическая активность (ФМА) нейтрофилов определялась по фагоцитарному индексу и числу (ФИ и ФЧ) [9], реакции восстановления нитросинего тетразолия в спонтанной (НСТ-сп.) и стимулированной опсонизированным (НСТ-инд. оз) или неопсонизированным зимозаном (НСТ-инд. нз) [5].
Интенсивность перекисного окисления липидов (ПОЛ) и антиоксидантный баланс оценивали по концентрации в сыворотке крови малонового диальдегида (МДА), диеновых конъюгатов (ДК) [15], активности каталазы [11] и супероксиддисмутазы эритроцитов (СОД) [8].
Иммуносупрессорный потенциал крови оценивали по концентрации в сыворотке липопротеидов низкой плотности (ЛНП) [10] и гликозаминогликанов (ГАГ) [12], α-1-ингибитора протеаз (ААП) и α-2-макроглобулина (АМГ) [16].
Концентрацию стабильных метаболитов оксида азота (смNO) в сыворотке крови определяли с использованием реактива Грисса [3].
Энергообеспечение эритроцитов оценивали по содержанию в них аденозинтрифосфата (АТФ) и 2,3-бисфосфоглицерата (БФГ) [2]. Также определяли сорбционные свойства эритроцитов: сорбционную способность и емкость их гликокаликса (ССЭ и СЕГ) [17,18].
О метаболической активности лимфоцитов судили по содержанию в них фруктозо-2,6-дифосфата (ФДФ) [6].
В работе использовались следующие препараты: мексикор (ООО «ЭкоФармИнвест», Россия); фосфоглив (НИИ «Биомедхимии» РАМН, Россия), гипоксен (ЗАО «Корпорация Олифен», Россия); эспа-липон (Esparma GmbH, Германия). Способ введения препаратов соответствовал рекомендациям, приведенным в аннотациях по использованию препаратов. Перерасчет доз с человека (средний вес 70 кг) на животных – белых крыс производился в сторону увеличения в 5,9 раза. Первое введение препаратов выполнялось за 1 час до моделирования гипоксии, последующие – по схеме.
Таблица 1. Схемы применения препаратов
Достоверность статистических различий средних арифметических величин оценивалась с использованием критериев Стьюдента с поправкой Бонферрони и Крускала-Уоллиса. Нормальность распределения проверялась критерием Шапиро-Уилка. Статистически значимыми считали различия с p<0,05.
Результаты и обсуждение. Исследованные три вида системной гипоксии характеризовались развитием разной степени выраженности супрессии гуморального и клеточного иммунного ответа. ОГГ и ГТГ сопровождались значительным снижением уровня ФДФ в лимфоцитах (маркер метаболической активности). При ГТГ эти изменения были наиболее выраженными. ГипГ характеризовалась недостоверным уменьшением уровня ФДФ в лимфоцитах. Поэтому, вероятно, в условиях ГипГ супрессия ГИО и ГЗТ на ЭБ обусловлена в большей степени не нарушением метаболизма иммуноцита, а воздействием на него иммуносупрессирующих субстанций (табл. 2).
Снижение показателей НСТ-теста с неопсонизированным зимозаном (более энергоемкий процесс) при параллельном увеличении с опсонизированным в ряду ГипГ-ОГГ-ГТГ, свидетельствовало о том, что при ГипГ роль в угнетении метаболической активности нейтрофилов принадлежит ингибирующему влиянию на их рецепторный аппарат иммуносупрессирующих субстанций, при ГТГ – энергетической составляющей, при ОГГ – сбалансированному влиянию этих факторов. Угнетение фагоцитарной активности нейтрофилов было наиболее выраженным при ГТГ и менее выраженным при ОГГ и ГипГ (табл. 2).
Таблица 2. Иммунометаболические нарушения при основных видах системной гипоксии (5-е сутки) (М±m)
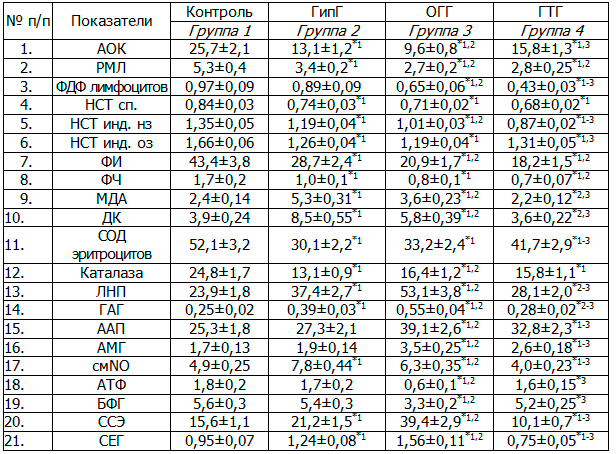
Примечания: * - достоверность различий средних арифметических величин, р<0,05; цифры рядом со звездочкой обозначают по отношению к показателю какой группы эти различия достоверны; ААП - мкмоль/л; АМГ - мкмоль/л; АОК – 103/селезенку; АТФ – мкмоль/мл эритроцитов; БФГ - мкмоль/мл эритроцитов; ГАГ – г/л; ДК - DD233 на 1 мл; ИАФ - абс.; Каталаза - мКат/л; ЛНП– условные единицы; МДА - мкмоль/л; НСТ инд. нз, НСТ инд. оз, НСТ-сп. – единицы оптической плотности; РМЛ - мг; СОД – ЕД на мл эритроцитов; ССЭ - %; СЕГ - 10-12 г/эритроцит; ФДФ - пМ/106 лимфоцитов; ФИ – %; ФЧ - асб.; смNO - мкмоль/л.
При всех видах гипоксий наблюдалось уменьшение активности антиоксидантных ферментов. Статистически достоверное повышение концентрации продуктов ПОЛ и смNO отмечалось только при ГипГ и ОГГ. При ГТГ уровень последних наоборот снижался. Доказанной иммуносупрессорной активностью обладают ЛНП, ГАГ и антипротеазы. Каждая форма системной гипоксии характеризовалась своим иммуносупрессорным профилем (табл. 2).
Учитывая существенную роль эритроцитов в развитии иммуносупрессии и реализации иммунотропных эффектов фармакологических препаратов, были исследованы их физико-химические и метаболические свойства при изучаемых видах гипоксии. При ОГГ отмечалось уменьшение в эритроцитах содержания макроэргических соединений. ГипГ и ОГГ характеризовались увеличением сорбционной способности эритроцитов, а ГТГ, наоборот, снижением (табл. 2).
С учетом установленных нами иммунометаболических нарушений при различных видах системной гипоксии для коррекции при ГипГ был использован мексикор, при ОГГ – эспа-липон, фосфоглив и их комбинация, при ГТГ – гипоксен, мексикор, а также их сочетание.
При ГипГ использование мексикора приводило к нормализации практически всех исследуемых показателей, за исключением активности СОД и каталазы. При ОГГ фосфоглив корригировал показатели иммунного ответа, уменьшал продукцию смNO, ЛНП, ГАГ, снижал сорбционные свойства эритроцитов. Эспа-липон нормализовал метаболическую активность лимфоцитов, эритроцитов и уровень смNO, уменьшал сорбционные свойства эритроцитов и концентрацию большей части иммуносупрессирующих метаболитов. При сочетанном использовании фосфоглив оказывал протективное влияние на эспа-липон в отношении функции иммуноцитов, гепатоцитов и эритроцитов, что позволяло предотвратить развитие иммунометаболических нарушении при ОГГ. В условиях ГТГ мексикор, и в большей степени гипоксен, корригировали измененные показатели, но их нормализация достигалась только при сочетанном использовании этих препаратов (табл. 3).
Таблица 3. Фармакологическая коррекция иммунных и метаболических нарушений при основных видах системной гипоксии
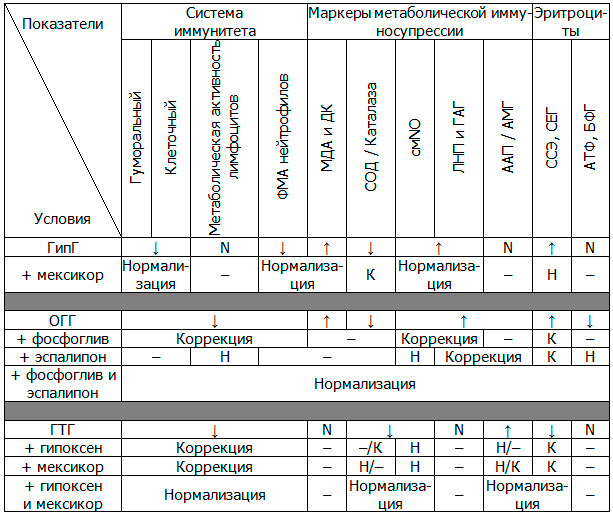
Примечания: векторы исходных изменений показателей - ↑ – статистически достоверное повышение показателей; ↓ – статистически достоверное снижение показателей; N – показатели статистически достоверно не изменялись; влияние фармакологической коррекции на изучаемые показатели – - статистически достоверно не влияет; К – достоверная коррекция по отношению к исходным значениям; Н – нормализация.
Заключение. Сопоставляя данные литературы и результаты собственных исследований, можно прийти к заключению о том, что различные виды гипоксии характеризуются возникновением состояния, которое можно условно назвать энергозависисимым иммунодефицитом. Основанием для такого заключения служит возможность эффективной коррекции иммунологических функций путём применения соединений, превалирующей функцией которых является регуляция энергетического обмена: гликолиза, цикла трикарбоновых кислот, работы окислительной цепи митохондрий и дополнительно обладающих антиоксидантными и мембраностабилизирующими свойствами. Это свидетельствует о взаимосвязанности и взаимокомпенсации энергодонорных процессов на уровне отдельных клеток и организма в целом [7, 13].
Основной точкой приложения в реализации иммунотропных эффектов исследованных препаратов было предотвращение активации перекисного окисления липидов в органах мишенях гипоксии и выделения ими субстанций, способных не только самостоятельно угнетать функцию иммуноцитов, но индуцировать появление таких же свойств у эритроцитов. Мексикор, эспа-липон, фосфоглив и сочетание эспа-липона с фосфогливом уменьшали сорбционные свойства эритроцитов. Последняя комбинация также нормализовала их энергетический статус. Эти изменения, по-видимому, препятствовали модификации эритроцитов иммуносупрессирующими метаболитами и приобретению ими аналогичных свойств. Кроме того, исследуемые препараты препятствовали гиперпродукции NO, способного оказывать прямое цитотоксическое действие на иммуноциты, а также улучшали метаболический статус лимфоцитов.
