Актуальность. Функциональное состояние сетчатки при васкулярных заболеваниях, в первую очередь речь идет об артериальной гипертензии и сахарном диабете (СД), имеет тесную связь с метаболическими изменениями в клетках ее нейрональных слоев. Нейроны сетчатки по особенностям формирования ишемического каскада тождественны с нейронами головного мозга [15]. В частности, глутаматная эксайтотоксичность, которая связана с избыточной активацией NMDA-рецепторов, дисбаланс в системе энергообеспечения, оксидантно-антиоксидантного равновесия, регуляции кислотно-щелочного баланса, обмена оксида азота, имеют место и в сетчатке, представляя собой перспективный вектор, в направлении которого целесообразно осуществлять фармакологическую разработку первичной нейроретинопротекторной терапии [12].
В литературе идут многочисленные дискуссии о возможной эффективности производных адамантана, обладающих антагонистическим действием на NMDA-рецепторы при ишемических поражениях сетчатки, однако опубликованные данные не обобщены и содержат существенные противоречия [9]. К разряду перспективных ретинопротекторов из класса адамантановых производных, теоретически можно отнести модулятор полиаминового сайта NMDA-рецепторов 1-адамантилэтилокси-3-морфолино-2-пропанола гидрохлорид - адемол, который является агонистом/антагонистом полиаминового сайта NMDA-рецепторов [10]. За счет этого он тормозит развитие нейродеструктивных процессов, опосредованных глутаматной эксайтотоксичностью. Учитывая рецепторные особенности фармакологической активности производных адамантана: амантадина сульфата и адемола, перспективным является доклиническая оценка их эффективности по новому назначению, а именно для терапии постреперфузионных поражений сетчатки.
В плане разработки и внедрения ретинопротекторной программы, особое место отводится антиоксидантам [1]. Поэтому было интересным сравнить эффективность блокаторов NMDA-рецепторов и мексидола, как представителя группы препаратов, влияющих на развитие оксидативного стресса. В наших предыдущих работах мы на примере мексидола доказали наличие и силу корреляционной связи между сохранением кровотока в бассейне внутренней сонной артерии в острый постреперфузионный период с изменениями клеточного метаболизма в головном мозге (энергетический, оксидантно-антиоксидантный баланс и обмен монооксида азота) [11]. Однако в литературе не освещены данные о подобной синхронной оценке гемодинамических и метаболических изменений в сетчатке на фоне применения амантадина сульфата, адемола и мексидола. В качестве объекта исследования мы выбрали ишемию-реперфузию (ИР) общей СА у монгольских песчанок (гербел). Эти представители грызунов, в отличие от других лабораторных животных, имеют разобщенный Виллизиев круг, что в эксерименте, при перевязке у них общей сонной артерии, позволяет создать адекватную модель односторонней ишемии глаза и, соответственно, сетчатки [13, 14].
Цель работы. Провести сравнительную оценку влияния растворов амантадина сульфата, адемола и мексидола на кровоснабжение глаза, энергетический, оксидантно-антиоксидантный баланс и обмен монооксида азота в сетчатке на фоне модельной ИР у гербел, как возможные составляющие механизмов их нейроцитопротекторного действия.
Материалы и методы. Изучение влияния блокаторов NMDA-рецепторов и мексидола на кровоснабжение и течение метаболических процессов в сетчатке проведено на 40 монгольских песчанках обоего пола массой 60-90 г. Во время работы с лабораторными животными придерживались требований биоэтики, которые соответствуют положениям «Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей» [16]. Соблюдение биоэтических норм засвидетельствовано комиссией по биоэтике ВНМУ имени М.И. Пирогова (протокол № 2 от 05.02.2015).
ИР в бассейне общей СА моделировали путем наложения односторонней лигатуры. Через 40 мин. ишемии лигатуры осторожно распускали и снимали. Кровообращение восстанавливалось самостоятельно. Состояние глазного дна и полноценность реперфузии контролировали с помощью прямой офтальмоскопии. Предварительно за 10 дней до моделирования ИР у гербел вызвали модель аллоксанового СД по методике, описанной ниже. После 24-часовой депривации пищи гербелам вводили аллоксана моногидрат (Sigma, США) однократно подкожно в дозе 150 мг/кг в виде 5,0% раствора в ацетатном буфере с рН 4,5 (Можейко Л.А. 2013). Через 14 суток, когда содержание глюкозы в крови животных превышало 11 ммоль/л (уровень глюкозы в крови контролировали в пробах капиллярной крови, с помощью глюкометра Accu-Check performa фирмы «Roche» (Швейцария)), животным моделировали ИР.
В виде предмета исследований в качестве модуляторов активности NMDA-рецепторов мы выбрали раствор амантадина сульфата для внутривенных инфузий («ПК-Мерц», Merz Pharmaceuticals, Швейцария), мексидол (НПК «Фармасофт», Россия) и промышленный образец ампулированного 1,0% раствора адамантилэтилокси-3-морфолино-2-пропанол гидрохлорида («Адемол», Дарница, Украина) для внутривенных инъекций.
Оценку влияния растворов амантадина сульфата, адемола и мексидола на кровоток во внутренней СА на стороне окклюзии у монгольских песчанок проводили в динамике первых суток реперфузии. Данные объемной скорости кровотока (ОСК) в мл/мин. фиксировали в начале эксперимента (исходное состояние), через 30; 60; 120 мин. и на 8 и 24 ч после реканализации общей СА. Исследуемые вещества вводили внутривенно (в/в) в предварительно катетеризированную (катетер, ERG 22 G, Польша) бедренную вену с помощью инфузоматной системы в течение первых 2 ч с момента наложения лигатуры по методике, разработанной А. А. Ходаковский [11]. Все препараты применяли в условно-эффективных цитопротекторных дозах. Для адемола и амантадина сульфата - это соответственно 2 и 5 мг/кг, а для мексидола - 100 мг/кг. Для приготовления инфузионной среды препараты разводили в 0,9% растворе NаСl из расчета объема последнего 2 мл/кг. Животные контрольной патологии (гербелы с ИP без цитопротекторной терапии) получали чистый 0,9% раствор NаСl по аналогичной схеме. Группе ложнооперированных гербел с моделью СД, лигатуры на общие СА накладывали без последующего затягивания. Эффективность (в%) производных адамантана и мексидола оценивали по динамике ОСК относительно начального уровня, принятого за 100%. Любые травматические манипуляции (в т. ч. измерение ОСК) и эвтаназию животных путем декапитации выполняли в условиях пропофолового наркоза (60 мг/кг внутрибрюшинно, «Fresenius Kabi», Австрия). Изменения метаболических показателей в сетчатке песчанок оценивали через 24 ч ИР. Сетчатку промывали холодным 1,15% раствором КCl и гомогенизировали в его среде (соотношение 1:3). Постядерную фракцию получали из гомогенатов путем центрифугирования (30 мин., 1500g при + 4° С). Состояние энергетического и углеводного обмена в сетчатке оценивали по содержанию аденозинтрифосфорной кислоты (АТФ). Содержание АТФ определяли в безбелковом трихлоруксусном экстракте сетчатки глаза (10% раствор трихлоруксусной кислоты при соотношении 1:5) хроматографическим методом [8]. Содержание общего белка - микробиуретовым методом с реактивом Бенедикта [6]. Интенсивность оксидативного стресса в сетчатке - по конечным продуктам этого процесса: уровню малонового диальдегида (МДА) и показателям окислительной модификации белка (ОМБ) карбонильным группам протеинов (КГП). О количестве монооксида азота в сетчатке судили по уровню стабильных метаболитов нитритов и нитратов. Состояние системы антиоксидантной защиты в сетчатке оценивали по активности глутатионпероксидазы (ГПО). Содержание МДА определяли по реакции с тиобарбитуровой кислотой [2], КГП - по взаимодействию с 2,4-динитрофенилгидразином [4]. Суммарное содержание нитритов и нитратов определяли по реакции с реактивом Грисса после восстановления нитратов взвесью цинкового порошка в растворе аммиака [5]. Активность ГПО изучали при помощи спектрофотометриии по накоплению окисленного глутатиона [3].
Количественные данные обрабатывали с помощью программы статистической обработки StatPlus 2009. Использовали параметрический критерий t Стьюдента в случаях нормального распределения вариационного ряда, непараметрический критерий W Уайта при его отсутствии. Различия считали статистически значимыми при p<0,05.
Результаты и их обсуждение. Как видно из табл. 1, в группе контрольной патологии на фоне предварительно сформированного аллоксанового СД, ИР в бассейне общей СА сопровождалась существенным ухудшением артериального кровотока во внутренней СА с аутентичной стороны. Уже на 30 мин. наблюдения ОСК снизилась в среднем на 62,9% (р<0,05).
Таблица 1. Динамика кровотока во внутренней сонной артерии гербел с аллоксановым сахарным диабетом при ишемии-реперфузии у гербел на фоне внутривенной инфузии адемола, амантадина сульфата или мексидола (М±m, n=8)
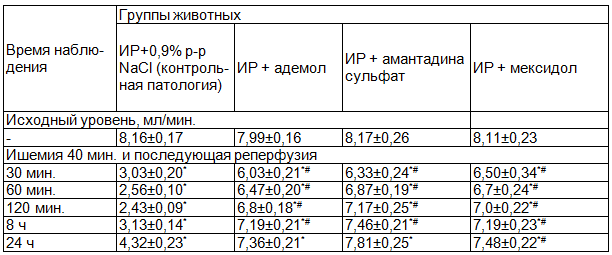
Примечания: ИР - ишемия-реперфузия; * - р<0,05 относительно начального показателя; # - р<0,05 относительно группы контрольной патологии в соответствующий срок
В последующем, в течение первых двух часов реперфузии (60 и 120 мин.), отмечалось еще большее снижение уровня исследуемого показателя, который был достоверно ниже относительно исходных значений в среднем соответственно на 68,6% и 70,2%. В конце первых суток каротидный кровоток несколько улучшился, однако все равно был почти вдвое ниже начальных показателей. За счет раскрытия коллатералей и формирования адаптационных реакций к воздействию ишемического фактора, в конце наблюдения ОСК была в среднем на 42,6% выше, чем в самом начале эксперимента (30 мин.).
Это можно объяснить формированием синдрома невосстановленного кровотока (no-reflow). Уже в начале инфузии растворов адемола, амантадина сульфата или мексидола уровень ОСК во внутренней СА был достоверно выше относительно показателей у животных контрольной патологии соответственно на 99,0; 108,9 и 114,5% - 30-я мин., на 152,7; 68,4 и 161,7% - 60-я мин. и на 179,8; 195,1 и 188,1% - 120-я мин. эксперимента.
В дальнейшем, в течение первых суток реперфузии кровообращение во внутренней СА на фоне адемола уменьшилось только на 10,0% (8 час, р<0,05) и 7,8% (24 час, р>0,05), на фоне амантадина сульфата соответственно в среднем на 8,6% (р<0,05) и 4,4% (р>0,05), а на фоне мексидола на 11,7% (р<0,05) и 7,8% (р<0,05) по сравнению с исходным значением, что значительно лучше, чем в группе контрольной патологии. Следует отметить, что при инфузии растворов адемола или амантадина сульфата, в отличие от применения мексидола, уровень ОСК в конце первых суток ИР достоверно не отличался от исходных значений, при этом достоверные различия кровоснабжения между исследуемыми препаратами отсутствуют.
Таким образом, терапевтическое введение гербелам с аллоксановым СД адемола, амантадина сульфата или мексидола в постреперфузионный период способствует восстановлении кровотока в бассейне внутренней СА и может быть одним из ведущих механизмов их нейроцитопротекторного действия.
В сетчатке гербел с ИP глаза, смоделированной на фоне предварительно сформированного СД, отмечается активация процессов свободнорадикального окисления липидов и протеинов (табл. 2). Об этом факте свидетельствовал рост маркеров этого явления - МДА и КГП относительно ложнооперированных животных в среднем в 2 раза (р<0,05). Введение адемола в дозе 2 мг/кг в/в производит более выразительный антиоксидантный эффект на гербел с ИР на фоне СД, чем применение раствора амантадина сульфата (5 мг/кг в/в) или мексидола (100 мг/кг в/в). Так, в группе животных, получавших адемол, содержание МДА и КГП в сетчатке было в среднем на 36,0% меньше, чем у монгольских песчанок группы контрольной патологии. Но, в случае аналогичного применения амантадина сульфата или мексидола, снижение уровня указанных метаболитов было достоверно меньше, чем на фоне адемола и составило в среднем соответственно 24,0 и 20,0% относительно контроля.
Таблица 2. Влияние адемола, амантадина сульфата и мексидола на содержание продуктов пероксидации липидов и протеинов в сетчатке гербел с сахарным диабетом после модельной ишемии-реперфузии у гербел (конец первых суток); М±m, n=7
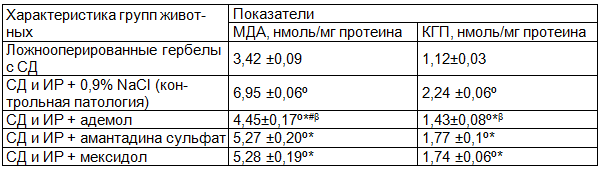
Примечания: здесь и далее СД - сахарный диабет; ИР - ишемия-реперфузия; МДА - малоновий диальдегид; КГП - карбонильные группы протеинов; º - р<0,05 относительно ложнооперированных гербел с СД; * - р<0,05 относительно контрольной патологии; # - р<0,05 относительно амантадина сульфата; β - р<0,05 относительно мексидола.
Гиперактивация окислительной модификации липидов и протеинов у животных с ИP происходит на фоне депрессии глутатионовой ферментной антиоксидантной системы (табл. 3). У гербел с ИP при СД (группа контрольной патологии) в сетчатке регистрируется достоверное уменьшение активности ГПО относительно аналогичного показателя у ложнооперированных животных с модельной гипергликемией в среднем на 47,5%.
Терапия гербел адемолом или амантадином сульфатом сопровождается достоверным (р<0,05) увеличением активности ГПО (в среднем соответственно на 49,3 и 38,7%) относительно животных c CД, которые в постреперфузионный период получали только 0,9% NаСl (табл. 3). В противоположность этому, при применении мексидола, повышение активности этого фермента составило всего 9,6% (по указанному эффекту референс-препарат достоверно (р<0,05) уступает как адемолу, так и амантадину сульфату в среднем соответственно на 36,2 и 26,4%). В условиях ИР глаза в сетчатке животных с СД, наряду с развитием оксидативного стресса развивается и нитрозативный стресс, доказательством чего является достоверное (р<0,05) повышение содержания стабильных метаболитов азота оксида - нитритов и нитратов в среднем в 3,4 раза (табл. 3).
Таблица 3. Влияние адемола, амантадина сульфата и мексидола на энергетический баланс, обмен монооксида азота и антиоксидантную защиту в сетчатке на фоне ишемии-реперфузии глаза у гербел (конец первых суток); М±m, n=7
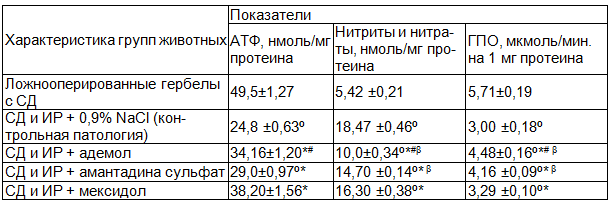
Накопление радикала азота оксида и супероксидного анион-радикала - достаточно неблагоприятный фактор, т.к. сопровождается образованием реакционноспособного пероксинитрита, обладающего цитотоксичностью. Он вызывает ковалентную модификацию редокс-чувствительных протеинов, что сопровождается изменением активности различных ферментативных систем нейронов [11].
Профилактически-лечебное применение в условиях ИР на фоне предварительно смоделированного аллоксанового СД адемола или амантадина сульфата, достоверно лучше препарата сравнения мексидола сдерживает формирование нитрозативного стресса (в среднем соответственно на 38,7 и 9,8%). В группе животных с ИP глаза, которые получали адемол или раствор амантадина сульфата, суммарное содержание нитритов и нитратов в сетчатке было в среднем соответственно на 5,9 и 20,4% меньше по сравнению с гербелами группы контрольной патологии (табл. 3).
В сетчатке животных с ИP глаза на фоне СД регистрируется гипоэнергетическое состояние, о чем свидетельствует достоверное по сравнению с показателем у ложнооперированных животных с гипергликемией, уменьшение запасов основного макроэрга АТФ, в сетчатке в среднем на 49,6% (табл. 3). Вероятно, в этих условиях дефицит АТФ является следствием неэффективного сопряжение тканевого дыхания и окислительного фосфорилирования. Этот феномен формируется на фоне нарушения целостности внутренней мембраны митохондрий под влиянием оксидативного, нитрозативного стресса и других дестабилизирующих факторов. Терапевтическое применение адемола в условиях ИР глаза, смоделированной на фоне СД, так же, как и амантадина сульфата, по сравнению с мексидолом имеет гораздо меньшее корригирующее воздействие на пул АТФ. Так, в группе животных, получавших референс-препарат, прирост уровня АТФ относительно контрольной патологии был в среднем 54,0%. На фоне амантадина сульфата и адемола этот показатель составлял соответственно 37,7 и 16,9%.
Таким образом, у гербел после ИР глаза, смоделированной на фоне СД, в сетчатке формируется ряд метаболических нарушений. Во-первых, активируются процессы окислительной модификации липидов и протеинов на фоне снижения активности антиоксидантного энзима ГПО. Во-вторых, имеет место развитие нитрозативного стресса и гипоэнергетического состояния. Использование в этих условиях адемола и амантадина сульфата сопровождается пополнением запасов пула АТФ, угнетением активности процессов липопероксидации и окислительной модификации протеинов, увеличением активности ГПО, а также уменьшением выраженности нитрозативного стресса. По антиоксидантным и антинитроксидэргическим эффектами исследуемые производные адамантана статистически достоверно превосходят или сопоставляются с препаратом-сравнения мексидолом, уступая ему по способности сохранять пул АТФ.
Выводы:
- Инфузия гербелам с аллоксановым сахарным диабетом растворов адемола (2 мг/кг) или амантадина сульфата (5 мг/кг), в отличие от применения мексидола (100 мг/кг), способствует восстановлению к концу первых суток после 40 мин. ишемии-реперфузии в бассейне общей сонной артерии уровней кровотока, которые близки к исходным числовым значениям. При этом достоверные различия кровоснабжение головы между группами, которые получали исследуемые производные адамантана, отсутствуют.
- Использование в условиях ИР адемола и амантадина сульфата сопровождается пополнением запасов пула АТФ, угнетением активности процессов липопероксидации и окислительной модификации протеинов, увеличением активности глутатионпероксидазы, а также уменьшением проявлений нитрозативного стресса. По величине антиоксидантных и антинитроксидэргичных эффектов, исследуемые производные адамантана статистически достоверно превосходят или сопоставляются с мексидолом, уступая ему по способности сохранять пул АТФ.
- Восстановление кровотока в бассейне внутренней сонной артерии, энергомодулирующее, антирадикальное и антиоксидантное действия адемола (2 мг/кг) или амантадина сульфата (5 мг/кг), а также их позитивное влияние на обмен монооксида азота являются ведущими механизмами их нейроцитопротекторного действия.
