Введение. Патология желудочно-кишечного тракта, связанная с приемом нестероидных противовоспалительных препаратов (НПВП), является актуальной и серьезной проблемой современной медицины. Эндоскопически подтвержденные язвы желудка или двенадцатиперстной кишки выявляются по разным данным у 15-30% больных, регулярно принимающих неселективные НПВП [5, 6, 11].
Ульцерогенное действие НПВП связанно преимущественно с основным механизмом их действия - тормозящим влиянием на активность фермента циклооксигеназы (ЦОГ) [8] и отражает неизбирательность действия большинства существующих НПВП в отношении изоформ этого фермента - конститутивной (ЦОГ-1) и индуцируемой (ЦОГ-2). Именно подавление НПВП активности ЦОГ-1 рассматривают как основной механизм, лежащий в основе ульцерогенного эффекта. В связи с этим изучение ульцерогенного эффекта у потенциальных НПВП дает возможность выявить наличие и выраженность этого неблагоприятного эффекта, а с другой - косвенно судить о влиянии изучаемого вещества на биосинтез простагландинов.
Известно, что свойствами НПВП обладают различные производные тиадиазола, имеющие в своем составе фрагменты органических кислот (янтарной, бензолуксусной, пропионовой) [3,4]. Наличие свободной карбоксильной группы в составе потенциальных НПВП является одной из причин их ульцерогенности. Учитывая этот факт, актуальным является поиск веществ с противоспал+ительной активностью среди кислотных производных тиадиазола, не имеющих в своем составе открытой карбоксильной группы. Одним из таких соединений является новое производное тиадиазола ЛХТ7-09 в виде амида аминокислоты.
Целью исследования явилась оценка ульцерогенности нового аминокислотного производного тиадиазола при внутрижелудочном введении крысам.
Материалы и методы. Объектом исследования явилось новое производное тиадиазола в виде амида аминокислоты с лабораторным шифром ЛХТ7-09, синтезированное в ОАО «ВНЦ БАВ» (г. Старая Купавна) проф. С.Я. Скачиловой [7].
Ульцерогенность соединения ЛХТ7-09 оценивали на крысах (n = 80) при однократном и субхроническом внутрижелудочном введении. Острую НПВП-индуцированную гастропатию вызывали путем однократного внутрижелудочного введения стабилизированной твином 80 суспензии препарата крысам, лишенным пищи за 16 часов до исследования. Через 3 часа животных подвергали эвтаназии передозировкой эфира для наркоза, извлекали желудки, рассекали их по малой кривизне и промывали в физиологическом растворе для удаления содержимого. Проводили визуальную оценку состояния слизистой оболочки желудка с использованием лупы при ярком освещении. Определяли число и площадь деструкций, которые дифференцировали на точечные кровоизлияния, эрозии и язвы. Ульцерогенность нового аминокислотного производного тиадиазола оценивали по значению индекса Паулса (ИП) [13], представляющего собой интегральный показатель масштабов деструкции в желудке и определяемого по формуле
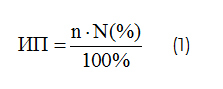
где n - среднее число деструкций на одно животное в группе, N - количество крыс с поражениями (%).
Ульцерогенность оценивали при однократном внутрижелудочном введении крысам (n=20) в дозе 0,2 DL50 (86,1 мг/кг) и при субхроническом внутрижелудочном введении (ежедневном в течение 4-х дней) крысам (n=20) в дозе 0,05 DL50 (21,5 мг/кг). В качестве препарата сравнения использовали НПВП неселективного действия с известной ульцерогенностью [2, 8]. Ульцерогенность индометацина оценивали в остром эксперименте при однократном внутрижелудочном введении крысам (n=20) в дозе 0,2 DL50 (10 мг/кг) и при субхроническом внутрижелудочном введении (ежедневном в течение 4-х дней) крысам (n=20) в дозе 0,05 DL50 (2,5 мг/кг).
Результаты исследований были обработаны статистически с применением программного обеспечения «AnalystSoft Inc., BioStat - программа статистического анализа. Версия 2009». Для ряда выборок вычисляли среднюю арифметическую и среднюю квадратическую ошибку. Определение нормальности распределения переменных проводили на основании гистограмм распределения, величины асимметрии и эксцессы. Для оценки достоверности различий выборок, имеющих нормальное распределение, применяли параметрический t-критерий Стьюдента. За достоверное принимали различие при уровне вероятности 95% и более (p<0,05).
Результаты и обсуждение. Анализ морфологических изменений слизистой оболочки желудков крыс, получавших внутрижелудочно индометацин, подтвердил наличие у последнего выраженных ульцерогенных свойств. Так, при однократном введении индометацина в дозе 10 мг/кг (0,2 DL50) через 3 часа у всех подопытных крыс были выявлены деструктивные изменения слизистой и серозной оболочек желудка. Установлено, что индометацин вызывал ярко выраженную гиперемию, отечность слизистой оболочки, гипертрофию желудочных складок, множественные точечные кровоизлияния и геморрагии, единичные глубокие дефекты, заполненные детритом. Кроме того, выявили множественные пристеночные сгустки крови, а также петехиальные кровоизлияния диаметром от 0,1 до 0,3 см (рис. 1).
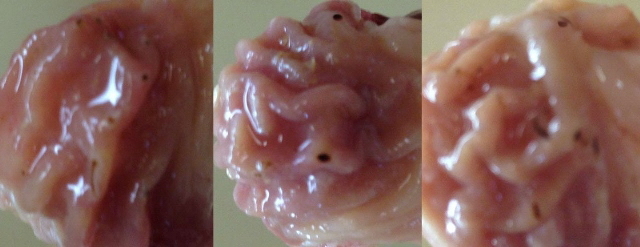
Рис. 1. Слизистая оболочка желудков крыс через 3 часа после однократного внутрижелудочного введения индометацина в дозе 10 мг/кг.
Отмечали значительное количество точечных кровоизлияний (в среднем (p<0,05) 8,31 на одно животное), в то время как среднее количество эрозий и язв составило соответственно 1,21 и 2,16. Индекс Паулса составил 11,68 (табл. 1).
Анализ морфологических изменений слизистой и серозной оболочек желудков крыс, получавших однократно внутрижелудочно соединение ЛХТ7-09 в дозе 86,1 мг/кг (0,2 DL50), показал, что слизистая оболочка желудков была серо-розовой с незначительной очаговой гиперемией, складки хорошо контурировались, отмечено полное отсутствие грубых язвенных повреждений и обширных кровотечений. Со стороны серозной оболочки отклонений от нормы обнаружено не было (рис. 2). Вместе с тем, у 35% подопытных животных было выявлено наличие незначительных деструктивных изменений.
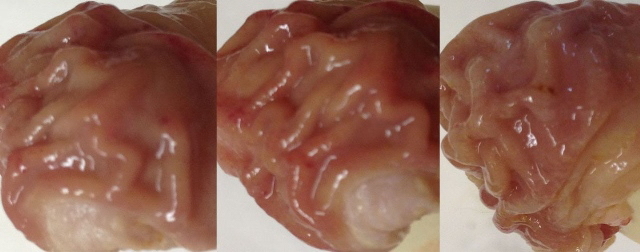
Рисунок 2. Слизистая оболочка желудков крыс через 3 часа после однократного внутрижелудочного введения соединения ЛХТ7-09 в дозе 86,1 мг/кг.
Так, среднее количество незначительных точечных кровоизлияний на одно животное составило 2,12, что в среднем (p<0,05) в 3,9 раза меньше, чем у животных, получавших внутрижелудочно индометацин. Также было отмечено, что количество эрозий на слизистой оболочке желудков крыс опытной группы было в среднем (p<0,05) в 4,8 раз меньше, чем в группе сравнения, и составило в среднем (p<0,05) 0,25 на одно животное. Индекс Паулса у крыс, получавших однократно новое аминокислотное производное тиадиазола ЛХТ7-09, составил 0,83, что в 14 раз меньше, чем в группе сравнения (табл. 1).
Таблица 1. Характер повреждений слизистой оболочки желудка крыс при однократном внутрижелудочном введении индометацина и ЛХТ7-09
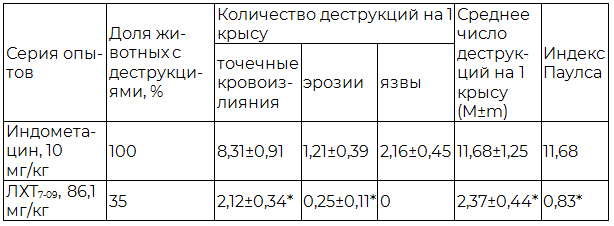
Примечание: * - различия с эталоном достоверны (p<0,05).
При субхроническом внутрижелудочном введении индометацина в дозе 2,5 мг/кг (0,05 DL50) на 5-й день исследования у всех подопытных крыс отмечали выраженные деструктивные изменения слизистой оболочки желудка. При морфологическом исследовании было выявлено язвообразование, сопровождающееся выраженной гиперемией, отеком и нарушением складчатости слизистой оболочки желудка. Кроме того, отмечали наличие большого количества точечных кровоизлияний и сливных геморрагий (рис. 3).
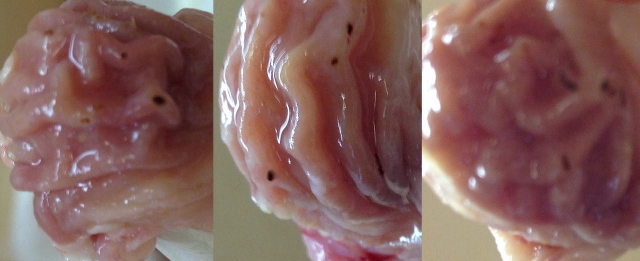
Рис. 3. Слизистая оболочка желудков крыс после субхронического внутрижелудочного введения индометацина в дозе 2,5 мг/кг.
Количество кровоизлияний, эрозий и язв у животных, получавших в течение 4-х дней индометацин, составило в среднем (p<0,05) 6,41, 2,11 и 3,24 соответственно. что в 1,3 раза меньше, чем при однократном введении в ульцерогенной дозе. Индекс Паулса у животных, получавших индометацин в субхроническом эксперименте, был равен 11,76 (табл. 2).
В сериях опытов с субхроническим введением ЛХТ7-09 в дозе 21,6 мг/кг (0,05 DL50), наличие деструктивных изменений было выявлено у 15% подопытных животных. Было установлено, что слизистая оболочка желудков подопытных крыс была серо-розовой без выраженной гиперемии. Отмечено полное отсутствие эрозий, язв и обширных кровотечений (рис. 4).
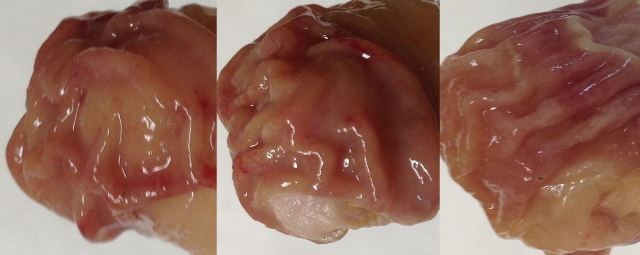
Рисунок 4. Слизистая оболочка желудков крыс после субхронического внутрижелудочного введения ЛХТ7-09 в дозе 21,6 мг/кг.
Обнаруженные деструкции имели характер незначительных точечных кровоизлияний, среднее количество которых на одно животное составило 1,33 (p<0,05), что в 4,82 раза меньше, чем у животных, получавших внутрижелудочно индометацин. Макроскопический анализ серозной оболочки отклонений от нормы не выявил. Индекс Паулса по критерию общего количества деструкций составил 0,19 в опытной группе, что в 61,9 раза (p<0,05) меньше, чем в группе сравнения (табл. 2).
Таблица 2. Характер повреждений слизистой оболочки желудка крыс при субхроническом внутрижелудочном введении индометацина и ЛХТ7-09
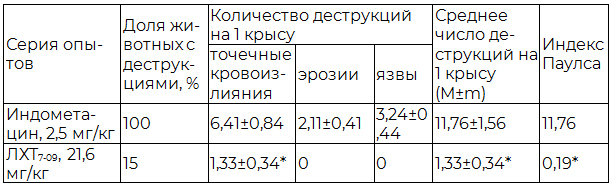
Примечание: * - различия с эталоном достоверны (p<0,05).
По результатам проведенных исследований было установлено, что влияние индометацина на ульцерогенез имеет дозозависимых характер. Так, при субхроническом введении индометацина в дозе 0,05 DL50 отмечали достоверное уменьшение количества точечных кровоизлияний по сравнению с однократным применением в дозе 0,2 DL50. Число кровоизлияний у животных, получавших в течение 4-х дней индометацин, составило в среднем (p<0,05) 6,41, что в 1,3 раза меньше, чем при однократном введении в ульцерогенной дозе. В то же время среднее количество грубых нарушений слизистой оболочки желудка (эрозий и язв) на одно животное по сравнению с однократным введением индометацина было достоверно больше в 1,7 и 1,5 раза, и составило в среднем (p<0,05) 2,11 и 3,24 соответственно. Индекс Паулса в группе животных, получавших индометацин в субхроническом эксперименте, достоверно не отличался от соответствующего значения при однократном введении и составил 11,76.
Выявленное в результате применения ЛХТ7-09 отсутствие грубых нарушений СОЖ, достоверно меньшее количество точечных кровоизлияний и малая доля животных с данными повреждениями, по сравнению с применением индометацина, позволяют судить о низкой ульцерогенной активности исследуемого соединения при однократном и субхроническом введении подопытным крысам.
Помимо основного механизма ульцерогенного действия НПВП, связанного с ингибированием фермента ЦОГ-1, существуют и другие причины повреждающего действия этих препаратов на слизистую оболочку желудочно-кишечного тракта. Одной из них является прямой цитотоксический эффект на клетки слизистой [9]. По данным исследований Lichtenberger LM. [12] прямая цитотоксичность не зависит от ингибирования ЦОГ. Такое местное повреждение наблюдалось при применении кислотных НПВП, что приводило к накоплению в слизистой оболочке ионизированных (“ионная ловушка») форм [10]. Способность НПВП (большинство из которых являются слабыми органическими кислотами) вызывать локальные повреждения слизистой ЖКТ зависит от их растворимости и константы ионизации. Проникая посредством диффузии через фосфолипидную мембрану в цитоплазму эпителиальных клеток, НПВП ионизируются (под влиянием высокой внутриклеточной рН) и накапливаются в относительно высокой концентрации, что само по себе может приводить к повреждению слизистой желудка [1]. Наличие в составе молекулы ЛХТ7-09 4-х атомов азота, отсутствие свободной карбоксильной группы в сочетании с низкой растворимостью позволяют предположить о низком прямом цитотоксическом эффекте данного соединения.
Выводы
1. При однократном внутрижелудочном введении ульцерогенность ЛХТ7-09 в дозе 0,2 DL50 (86,1 мг/кг) была в 14 раз (p<0,05) ниже, чем у индометацина в дозе 0,2 DL50 (86,1 мг/кг).
2. При субхроническом введении значение индекса Паулса, характеризующего ульцерогенность, для ЛХТ7-09 в дозе 0,05 DL50 (21,5 мг/кг) составило 0,19, что было в 61,9 раза (p<0,05) меньше, чем для индометацина в дозе 0,05 DL50 (2,5 мг/кг).
