Введение. Циркадианные (околосуточные) биологические часы млекопитающих, задающие многочисленные физиологические, биохимические и поведенческие ритмы органам и тканям, располагаются в супрахиазматическом ядре гипоталамуса [10]. В условиях изоляции от внешних воздействий in vitro нейроны осциллятора супрахиазматического ядра, генерируют собственный суточный ритм, период которого не равен в точности 24-часам [14]. По этой причине для своего адекватного функционирования в условиях целостного организма циркадианные биологические часы получают по многочисленным афферентным путям информацию, синхронизирующую ритм активности осциллятора с ежесуточно повторяющимися биологически значимыми событиями в окружающей среде. В этом плане наиболее важную физиологическую роль играет циклическая афферентация от фоторецепторов сетчатки, поступающая по ретиногипоталамическому пути и синхронизирующая ритм осциллятора с суточным ритмом изменения освещённости [9]. Большое значение в механизме синхронизирующего влияния света на функцию циркадианных биологических часов ядра также играет гормон эпифиза мелотонин, продукция которого резко возрастает в ночное время суток [1]. Ранее в экспериментах in vitro было показано, что непосредственное воздействие мелатонина на нейроны супрахиазматического ядра приводит к снижению их электрической активности, повышению степени нерегулярности генерации потенциалов действия и уровня кодирования спайковой информации. Использование техники пэтч-клэмп позволило продемонстрировать гиперполяризующее влияние мелатонина на мембрану значительной популяции нейронов супрахиазматического ядра, а также способность данного гормона вызывать рост амплитуды следовой деполяризации и укорачивать следовую гиперполяризацию, что и лежало в основе эффектов мелатонина на уровне электрической активности и спайковго кода исследуемых клеток [13].
Кроме света существует множество других факторов синхронизации циркадианного осциллятора, в частности, суточный режим питания, ритм колебаний температуры и метаболизма, ежесуточные повторяющиеся поведенческие реакции и социально-значимые события. В механизмах действия этих т. наз. нефотических факторов синхронизации биологических часов большую роль играют регуляторные пептиды центрального и периферического происхождения: лептин, нейропептид Y, орексин, грелин и др. В целом ряде публикаций, включая наши собственные, было продемонстрировано непосредственное влияние этих веществ на уровне нейронов супрахиазматического ядра [2, 7, 12, 14].
Одним из практически неизученных потенциальных модуляторов функции циркадианного осциллятора является недавно открытый эндогенный нейрохимический регулятор кисспептин. Физиологические исследования, выполненные на грызунах с нокаутом гена кисспептинового рецептора KISS1R позволило выявить ключевую роль этого рецептора и его лиганда кисспептина для репродуктивной эндокринологии [8]. На сегодняшний день считается доказанной ведущее значение кисспептина в регуляции начала полового созревания, секреции гонадотропинов, вызванной половыми гормонами, и в контроле фертильности [16]. Основной механизм репродуктивной активности кисспептина обясняется мощным стимулирующим влиянием этого регулятора на гипоталамическую секрецию гонадотропин-рилизинг-гормона. Нейроны, продуцирующие кисспептин, расположены в ростральной преоптической области и ядре воронки гипоталамуса [11]. Аксоны этих клеток следуют в направлении нейроэндокринных клеток срединного возвышения, осуществляющих секрецию гонадотропин-рилизинг-гормона в портальный кровоток.
Накопленные экспериментальные данные позволяют предполагать существование функциональной связи между системой кисспептиновых нейронов и циркадианными биологическими часами супрахиазматического ядра. Недавние исследования показали, что осциллятор супрахиазматического ядра гипоталамуса может задавать ритм высвобождения важнейшего полипептидного регулятора фертильности кисспептина [17]. Помимо этого было сделано предположение о том, что кисспептин способен регулировать активность нейронов циркадианных часов по принципу обратной связи, однако эта гипотеза до сих пор не подтверждена экспериментально. Между тем, с помощью иммуногистохимической техники было продемонстрировано присутствие большого количества волокон, содержащих кисспептин, и экспрессия кисспептиновых рецепторов в супрахиазматическом ядре [6, 17], что свидетельствует в пользу возможности непосредственного действия кисспептина на уровне нейронов циркадианного осциллятора.
Целью настоящей работы in vitro было изучение влияния аппликаций кисспептина на показатели спайковой активности нейронов супрахиазматического ядра.
Материал и методы исследования. Эксперименты выполнены на крысах-самцах Вистар массой тела 70 - 160 г. Экспериментальный протокол был одобрен комиссией по биологической этике Самарского национального исследовательского университета им. академика С.П. Королёва. Крыс анестезировали уретаном (1.2 г/кг массы тела внутрибрюшинно) и декапитировали. Головной мозг извлекали из полости черепа, охлаждали в искусственной цереброспинальной жидкости при температуре 1-3 °С, а затем с помощью вибратома (Vibroslice NVSL, WPI, США) готовили срезы гипоталамуса толщиной 300 мкм, включающие супрахиазматическое ядро. Срезы, по меньшей мере, в течение часа инкубировали в насыщенной кислородом искусственной цереброспинальной жидкости при температуре 37 °С вплоть до начала регистрации. Искусственная цереброспинальная жидкость содержала 124 мМ NaCl, 25 мМ NaHCO3, 3 мМ KCl, 1,5 мМ CaCl2, 1 мМ MgSO4, 0,5 мМ NaH2PO4, 30 мМ глюкозы. Исследование выполнено на 27 срезах гипоталамуса. Для регистрации срезы переносили в камеру из органического стекла, смонтированную на антивибрационном столике (Vibraplane, США) для повышения степени стабильности регистрации. Срезы перфузировали с постоянной скоростью 1,5 мл/мин. с помощью перистальтической помпы (Minipuls 3, Gilson, Франция). Регистрацию производили при температуре 27-30 °С.
Спайковую активность нейронов супрахиазматического ядра регистрировали внеклеточно, с помощью стеклянных микроэлектродов с диаметром кончика около 1 мкм, заполненных искусственной цереброспинальной жидкостью для перфузии среза. Сигнал от микроэлектрода усиливали (2400 A, Dagan, США), устраняли шум частотой 50 Гц (Hum Bug; Quest Scientific, Канада), отцифровывали (Micro 1401, CED, Великобритания) и подавали на персональный компьютер. Визуализацию сигнала, хранение и первичную обработку данных осуществляли с помощью программного пакета Spike 2 (CED, Великобритания).
После появления спайковой активности наблюдали за ней в исходном состоянии не менее 10 минут, чтобы убедиться в стабильности частоты генерации потенциалов действия. При отсутствии заметного тренда к нарушению постоянства этого показателя, перфузию меняли на раствор того же состава с добавлением 50 нМ кисспептина на 10 минут, а затем возвращались к исходному раствору для «отмывания» среза от пептида. С целью исключения возможной десенситизации, на каждый срез производили однократную аппликацию кисспептина. Продолжительность «отмывания» составляла 15 минут.
Первым этапом обработки данных было тщательное выделение всех зарегистрированных спайков из шума и артефактов. Далее, наряду с расчётом «традиционного» параметра электрической активности нейронов - средней частоты генерации спайков, вычисляли два параметра, характеризующих спайковое кодирование информации: энтропию распределения межспайковых интервалов и обоюдную информацию между сопряжёнными межспайковыми интервалами, отражающую паттернирование спайковой информации [3-5, 12, 13].
Для выяснения эффектов кисспептина сравнивали значение параметров спайковой активности в течение двух пятиминутных интервалов времени: в исходном состоянии (непосредственно перед аппликацией пептида), и в конце периода аппликации. Нейронами, реагирующими на воздействие кисспептина, считались лишь те, у которых частота генерации спайков изменялась под влиянием этого вещества не менее, чем на 20% от исходной [7]. После этого анализировали исследуемые параметры в течение заключительного пятиминутного периода «отмывания» среза и делали заключение о степени восстановления исходной активности нейрона.
Полученные экспериментальные данные подвергали статистической обработке. Для сравнения значений исследуемых показателей в ходе экспериментальных воздействий с исходным состоянием использовали парный t-тест. Нормальность распределения данных в выборках проверяли с помощью теста Шапиро-Уилка, однородность дисперсий - с помощью теста Левена. Статистические данные о параметрах спайковой активности нейронов представлены как средние арифметические±стандартные ошибки среднего. Изменения исследуемых параметров считались статистически значимыми при р<0.05.
Результаты и обсуждение. Всего была зарегистрирована активность 24 нейронов супрахиазматического ядра. В целом для всей группы нейронов частота генерации потенциалов действия составила 1,99±0,36 имп./с. Энтропия распределения межспайковых интервалов для этих нейронов равнялась 6,82±0,18 бит, а обоюдная информация между сопряжёнными межспайковыми интервалами составила 0,060±0,022 бит.
Аппликации 50 нМ кисспептина в перфузионный раствор вызвали снижение средней частоты генерации спайков у 15 из 24 (62,5%) зарегистрированных нейронов супрахиазматического ядра; в 2 случаях (8,3%) наблюдался рост активности, уровень активности остальных 7 нейронов (29,2%) не изменялся под влиянием кисспептина. В целом для всей группы зарегистрированных нейронов средняя частота генерации потенциалов действия после аппликации кисспептина возросла на 0,73±0,24 имп./с (Р=0.006). Другой характерной особенностью реакций было снижение энтропии распределения межспайковых интервалов, величина которой под влиянием кисспептина уменьшилась на 0,19±0,08 бит (Р=0.029). Вместе с тем, статистически значимых изменений обоюдной информации между сопряжёнными межспайковыми интервалами не обнаружено, несмотря на отчётливую тенденцию к снижению (0,060±0,022 бит в исходном состоянии и 0,032±0,023 бит на фоне действия кисспептина; Р=0.179).
Статистические данные о влиянии 50 нМ кисспептина на исследуемые параметры спайковой активности нейронов супрахиазматического ядра (n=24) представлены на рис. 1.
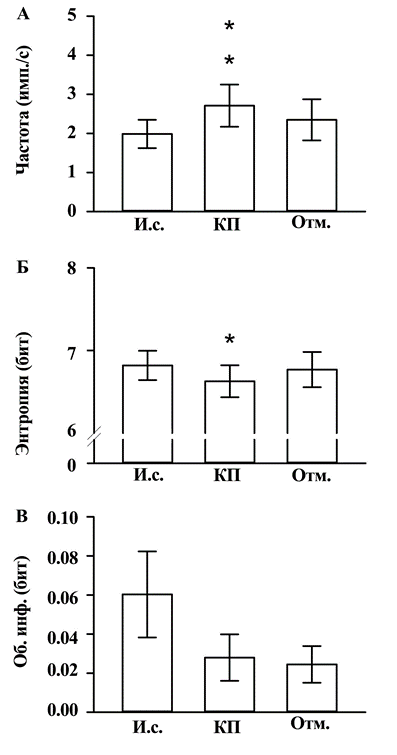
Рис. 1. Влияние 50 нМ кисспептина на частоту генерации потенциалов действия (А), энтропию распределения межспайковых интервалов (Б) и обоюдную информацию между сопряжёнными межспайковыми интервалами (В). И.с. - исходное состояние; КП - на фоне действия кисспептина; Отм. - после «отмывания» среза искусственной цереброспинальной жидкостью. Звёздочками отмечены статистически значимые различия с исходным состоянием: *p<0,05; **p<0,01 (парный t-тест).
Наблюдавшиеся реакции показателей электрической активности исследуемых нейронов характеризовались полной или частичной обратимостью. После 15-минутного «отмывания» среза ни один из параметров активности не отличался от своей исходной величины. В этот момент средняя частота генерации потенциалов действия составила 2,31±0,52 имп/с (различие с исходным значением не значимо: Р=0.289), энтропия распределения межспайковых интервалов - 6,77±0,21 бит, (Р=0.644), а обоюдная информация между сопряжёнными межспайковыми интервалами - 0,036±0,021 бит (Р=0.099).
Полученные результаты свидетельствуют о том, что регуляторный пептид кисспептин при непосредственном воздействии на супрахиазматическое ядро вызывает реакции спайковой активности большинства нейронов. Характер реакций свидетельствует о стимуляции активности клеток циркадианного осциллятора с одновременным изменением спайкового кодирования информации, заключающимся в снижении степени нерегулярности генерации потенциалов действия под влиянием кисспептина. В то же время, признаков изменения уровня паттернирования спайковой информации не обнаружено, что выразилось в отсутствии значимых изменений обоюдной информации между сопряжёнными межспайковыми интервалами.
В совокупности с данными о присутствии в супрахиазматическом ядре большого количества нервных волокон, содержащих кисспептин и специфических кисспептиновых рецепторов [6, 17] полученные данные являются экспериментальным подтверждением гипотезы о способности эндогенного кисспептина регулировать активность нейронов циркадианных часов по принципу обратной связи. Клеточные механизмы, опосредующие стимулирующее влияние кисспептина на уровне нейронов супрахиазматического ядра пока остаются неисследованными. В этом плане перспективным представляется изучение влияния данного пептида на некоторые виды калиевых токов, прежде всего быстрый инактивируемый калиевый ток, ток входящеговыпрямления и активируемый кальцием медленный постгиперполяризационный ток [15, 18].
Заключение. Результаты исследования подтверждают непосредственную способность кисспептина оказывать влияние на параметры спайковой активности нейронов циркадианного осциллятора супрахиазматического ядра. Выявлено стимулирующее влияние кисспептина на уровень электрической активности клеток, а также снижение степени нерегулярности генерации спайков в нейронном коде. В целом полученные данные являются экспериментальным подтверждением гипотезы о способности эндогенного кисспептина регулировать активность нейронов циркадианных часов по принципу обратной связи; они свидетельствуют о непосредственном участии кисспептина в механизмах нефотической синхронизации циркадианного осциллятора с соответствии с функциональным состоянием репродуктивной системы.
