Введение. В настоящий момент туберкулез остается одним из наиболее широко распространенных в мире инфекционных заболеваний, приводящих к высокой смертности. Заболевание развивается преимущественно у людей с ослабленной иммунной системой при неблагоприятных условиях жизни и снижении сопротивляемости организма. Так, у более 70% больных, госпитализируемых в туберкулезные отделения, наблюдаются признаки белково-энергетической недостаточности. Доказано, что в условиях голодания и, даже при несбалансированном питании, особенно при недостаточном содержании в рационе белков и витаминов, нередко возникает реактивация туберкулеза [3].
У больных туберкулезом целями нутритивной поддержки (НП) можно считать повышение переносимости антибактериальной терапии, профилактику и лечение иммунодепрессии, снятие симптомов интоксикационной анорексии, коррекцию нарушений функции ЖКТ и повышение уровня качества жизни [4]. Современная ранняя адекватная нутритивная поддержка, проводимая с помощью качественных адаптированных сред для энтерального питания пациентов, позволяет добиться снижения длительности пребывания в многопрофильном стационаре, частоты инфекционных осложнений и уровня летальности, снижения сроков искусственной вентиляции легких (ИВЛ), частоты нозокомиальных пневмоний, длительности пребывания в отделениях интенсивной терапии [8, 9].
Обычное усредненное количество энергетических и пластических субстратов в случаях несоответствия калоража и состава питания индивидуальным энергетическим потребностям больного приводит к усилению процессов гиперкатаболизма (как при недостаточном, так и при избыточном питании). Синдром гиперметаболизма-гиперкатаболизма - это неспецифическая системная ответная реакция организма на повреждение различной этиологии, характеризующаяся дисрегуляторными изменениями в системе «анаболизм-катаболизм», резким увеличением потребности в донаторах энергии и пластического материала, росте реальной энергопотребности и параллельным развитием патологической толерантности тканей организма к обычным нутриентам [5].
Кроме того, потребность в питательных веществах значительно варьирует в зависимости от характера и стадии болезни, исходного состояния метаболизма, сопутствующей патологии, используемых видов химиотерапии и хирургического лечения. В условиях стационара измерение основного обмена по потреблению кислорода и выделению углекислоты (непрямая калориметрия) - наиболее точный метод определения суточной энергетической потребности для выработки индивидуальной программы нутритивной поддержки, соответствующей изменениям в клиническом статусе [6, 8]. Несмотря на то, что метод непрямой калориметрии сложнее и затратнее, чем использование известных расчетных уравнений Харрис-Бенедикта, Клейбера, Айртона-Джонса, Ли, есть и клинические преимущества данного метода: индивидуальная точность определения суточной энергопотребности, оптимизация поддержки питания, отслеживание пациентов с нарушениями метаболизма [1].
Энергообеспечение, неадекватное метаболическим потребностям организма является одним из ведущих звеньев в патофизиологической цепи развития гиперкатаболизма, в т.ч. у больных с распространенным фиброзно-кавернозным туберкулезом (ФКТ). Именно данная категория пациентов представляет самую высокую эпидемиологическую опасность, и поиск новых лечебных возможностей является актуальной задачей. Научно-обоснованная система лечебного питания, направленная на нормализацию обменных процессов и повышение иммунорезистентности организма, должна положительно повлиять на эффективность схем химиотерапии, способствовать усилению репаративных процессов и ускорению восстановления нарушенных структур и функций организма [2].
Несмотря на то, что в настоящее время имеется достаточное количество сведений о нарушении обмена веществ у больных туберкулезом, остается весьма актуальной и не изученной проблема исследования нутритивного статуса у наиболее сложной группы пациентов - больных распространенным ФКТ, отсутствие как комплексной схемы его оценки, так и программ нутритивной поддержки, в том числе в схеме периоперационной подготовки.
Цель работы. Изучить влияние дополнительного энтерального питания на нутритивный статус и биохимические показатели крови больных ФКТ легких в обеспечении периоперационного периода.
Материал и методы исследования. Дизайн - рандомизированное одноцентровое исследование. Рандомизация осуществлялась методом случайных чисел в соотношении 1:1. Сроки исследования 2012-2013 гг. на базе легочно-хирургического отделения Новосибирского НИИ туберкулеза. Включен в исследование 81 пациент с распространенным ФКТ в возрасте от 19 до 67 лет (средний возраст 36,66±1,84). Распространенность процесса, коморбидный статус, низкие функциональные показатели, наличие специфического поражения трахеобронхиального дерева не позволяли этим пациентам произвести резекционное хирургическое вмешательство на легких, поэтому, после обследования, всем больным были выполнены коллапсохирургические операции (остеопластическая торакопластика).
Пациентам осуществлялась стандартная противотуберкулезная терапия, сопоставимая послеоперационная интенсивная терапия. Все операции выполнялись в условиях комбинированной анестезии с ИВЛ и эпидуральной аналгезии в интра- и послеоперационном периоде. Методом слепой рандомизации пациенты разделены на две равные группы: основную (I группа) и группу сравнения (II группа). В основную группу включено 40 человек, в комплексном лечении туберкулеза получавших дополнительное изокалорическое энтеральное питание методом сипинга (препарат «Нутриэн Фтизио» ЗАО «Компания Нутритек», Россия) в предоперационном (10 дней) и послеоперационном (10 дней) периодах. Во второй группе наблюдался 41 пациент, получавший лечение без коррекции нутритивного статуса. Группы схожи по своим клинико-морфологическим признакам.
Регистрировались клинико-биохимические показатели, непрямая калориметрия. Энергопотребность определяли при помощи метаболографа MEDGRAPHICS CCM Express (Medical Graphics Corporation, США) методом непрямой калориметрии. Измерение осуществляли в течение 15 мин через полуоткрытый контур (Canopy Kit) в нормальных условиях в утренние часы в положении полусидя после периода отдыха в течение 60 минут. До начала исследования пациенты воздерживались от приема пищи и курения в течение двух часов. Полученные данные экстраполировали на суточную энергопотребность.
В основной группе мужчин - 29 (72,5%±7,06%), женщин - 11 (27,5±7,06%), в группе сравнения мужчин - 28 (68,3%±7,27%), женщин - 13 (31,7±7,27%) (p=0,68, χ2). Масса тела в основной группе при поступлении составила 59,13±11,19 кг, в группе сравнения - 61,63±10,3 кг (p>0,05). Средняя интраоперационная кровопотеря при выполнении остеопластической торакопластики была 331,00±224,783 мл в основной группе и 362,44±236,345 мл в группе сравнения (p>0,05).
Обследование пациентов проводилось при поступлении в стационар, через десять дней перед операцией, в первые и на десятые сутки после операции, применялись соматометрические, лабораторные и инструментальные методы исследования.
Статистическую обработку результатов исследования проводили по стандартным методикам с использованием программного обеспечения Statistica 6.0 и SPSS 19.0. При этом определяли такие статистические показатели средних арифметических величин (М) и среднеквадратического отклонения (σ). При выполнении условия нормальности распределения (тест Колмогорова-Смирнова) статистическую значимость различий (р) определяли с помощью t критерия Стьюдента, χ2 Пирсона. Если в таблице 2х2 хотя бы одна из сравниваемых частот была менее 5, использовали точный тест Фишера для получения значения достигнутого уровня значимости р. Различия считали статистически значимыми при p<0,05.
Результаты исследования. При первичном осмотре пациентов обеих групп обязательным было определение индекса массы тела (ИМТ). По результатам вычислений (табл. 1) в обеих группах нормальная масса тела наблюдалась у 39 пациентов (48,15%), недостаточность питания различной степени у 39 (48,15%), повышенное питание отмечено у 3 пациентов (3,7%). При этом статистически значимых значений между группами не выявлено (p<0,05).
Таблица 1. Показатели ИМТ в группах наблюдений (n %)
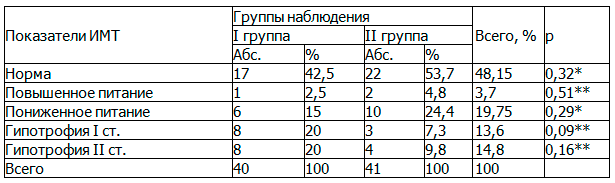
Примечание: * - χ2 Пирсона, ** - ТТФ
На основании полученных результатов при проведении непрямой калориметрии перед операцией пациенты основной группы получали дополнительно к общему столу №11 изокалорическое энтеральное питание («Нутриэн Фтизио») в количестве 871,25±280,44 ккал/сут. В послеоперационном периоде, учитывая возросшие потребности в энергетическом и пластическом материале, требовалось увеличение количества питательной смеси на 25% (1150±448,65 ккал/сутки). Препараты энтерального питания хорошо переносились и не вызывали негативных эффектов.
Достоверных различий в клинико-биохимических показателях белкового статуса при поступлении между группами не выявлено. Через 10 дней (перед операцией) в I группе увеличивались показатели от исходных: абсолютное число лимфоцитов (АЧЛ) на 5%, трансферрина на 12% (p<0,05), преальбумина на 10% (p<0,05), азота мочи на 12% (p<0,05), что соответствует постепенной ликвидации метаболических нарушений в белковом обмене и эффективности нутритивной поддержки. Во II группе динамики в показателях белкового статуса не отмечено.
В первые сутки после операции в обеих группах наблюдалось развитие катаболической реакции со снижением всех основных показателей белкового статуса (p<0,05): АЧЛ на 32% - I группа, 38% - II группа; общего белка на 12% - I группа, 18% - II группа; альбумина на 10% - I группа, 20% - II группа; трансферрина на 10% - I группа, 20% - II группа; преальбумина на 1% - I группа, 45% - II группа; азота мочи на 11% - I группа, 35% - II группа.
К 10 суткам после операции в I группе на фоне нутритивной поддержки висцеральный пул белка восстанавливался до нормальных значений, тогда как во II группе показатели белкового статуса сохранялись сниженными с достоверными различиями между группами по преальбумину и азоту мочи.
Таблица 2. Сравнительный анализ белкового статуса у исследуемых больных (M±σ)
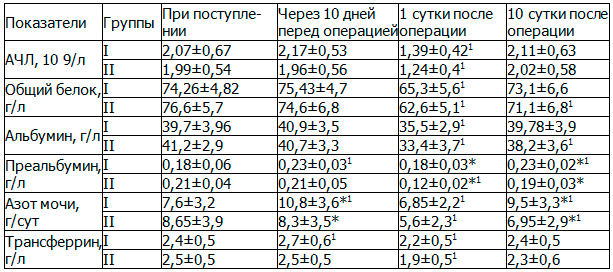
Примечание: 1p<0,05 - по сравнению с первым этапом (при поступлении), *p<0,05 - между группами.
Основной обмен (REE) в среднем составила 1340,25±414,54 ккал, в группе сравнения - 1295,21±415,96 ккал. В первые сутки после операции у всех пациентов произошло возрастание величины основного обмена в среднем на 11,5% (в I группе REE составила 1514,8±387,8 ккал, во II группе - 1460,1±375,5 ккал), что свидетельствует о гиперкатаболизме-гиперметаболизме. Стоит отметить, что интерпретация метаболического состояния зависит от точности определения респираторного коэффициента (RQ), который широко используется в клинической практике [4]. RQ — это отношение количества производимой углекислоты к количеству потребленного кислорода (RQ = VCO2/VO2). Поскольку в организме все питательные вещества одновременно подвергаются окислению, то, определив величину RQ с помощью непрямой калориметрии, можно условно судить о преимущественном окислении в организме белков, жиров и углеводов. Так, например, повышение RQ более 1,0 указывает на преобладание углеводного обмена и/или избыточное питание, менее 0,7 - преобладание жирового обмена и/или недостаточное питание. Цель режима питания - покрыть энергозатраты, поддерживая RQ в нормальных физиолических пределах 0,74-0,85 [9].
Таблица 3. Динамика дыхательного коэффициента в группах наблюдений (n(%))
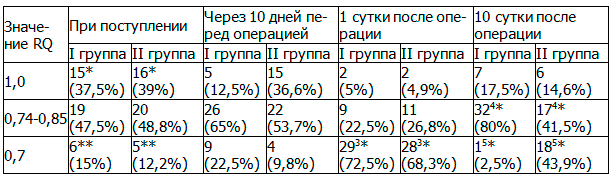
Примечание: *p=0,89, χ2; **p=0,76, ТТФ; 3*p=0,68, χ2; 4*p=0,0004, χ2; 5*p=0,00001, ТТФ.
В исследуемых группах статистически значимых значений при поступлении по RQ не выявлено (табл. 3) (p>0,05). Пациентов с преобладанием углеводного обмена было 38,75% (в I группе 15 (37,5±7,7%) и 16 (39±7,6%) во II группе (p=0,89, χ2)), с преобладанием жирового обмена 13,6% (в I группе 6 (15,0±5,7%) и 5 (12,2±5,1%) во II группе (p=0,76, ТТФ)). В основной группе после проведения десятидневной нутритивной поддержки у 26 пациентов (65±7,5%) отмечалась нормализация обмена веществ. Однако, у 9 (22,5±6,6%) пациентов I группы RQ при исследовании составил 0,7, что скорее всего связано с отказом от избытка углеводов в привычном рационе питания (RQ = 1,0 отмечено у 5 (12,5±5,2%), что в 3 раза меньше от исходных данных).
В первые сутки после операции при исследовании метаболизма в обеих группах RQ менее 0,7 наблюдался у 70,4% (в I группе 29 (72,5±7,1%) и 28 (68,3±7,3%) во II группе (p=0,68, χ2)), что связано с реакцией организма на хирургический стресс, недостатком поступления энергетического субстрата. Это результат истощения гликогенового депо (гликогенолиз) с запуском глюконеогенеза и дальнейшей активацией окисления запасов липидов в качестве источника энергии (липолиз) [6]. При своевременном, адекватном, метаболически обоснованном назначении нутритивной поддержки в первой группе нормализация основного обмена к 10 суткам была отмечена у 32 (80,0±6,3%) пациентов, тогда как во II группе физиологические значения RQ были у 17 (41,5±7,7%) (p=0,0004, χ2). Следует отметить, что 18 (43,9±7,8%) пациентов группы сравнения в послеоперационном периоде оставались в гиперкатаболизме и недостаточном поступлении калорий для покрытия возросших энергетических затрат. Несмотря на проводимую нутритивную поддержку, в основной группе аналогичное состояние наблюдалось у одного (2,5±2,5%) больного (p=0,00001, ТТФ).
Выводы
- Для своевременной диагностики нарушений метаболизма с последующей адекватной коррекцией необходимо определение суточной энергопотребности методом непрямой калориметрии всем пациентам, независимо от исходного статуса питания.
- В схему периоперационного ведения пациентов с ФКТ легких необходимо включать нутритивную поддержку в течение 10 дней до и 10 дней после проведения хирургического лечения.
- Проведение нутритивной поддержки больным ФКТ легких к 10 суткам после операции способствует более быстрой нормализации клинико-биохимических показателей висцерального пула белка.
- У 70,4% больных обеих групп независимо от предоперационной подготовки в раннем послеоперационном периоде наблюдалось развитие катаболической реакции, связанной с резким усилением основного обмена.
- Назначение нутритивной поддержки в послеоперационном периоде приводит к нормализации метаболизма у 80% больных ФКТ легких.
