Кашель является симптомом широкого круга заболеваний, представляет собой одну из самых частых жалоб, предъявляемых больным на приеме у врача общей практики [4]. Хронический кашель, порой серьезно нарушающий качество жизни больного, в силу разнообразия причин своего появления нередко оказывается поводом для обращения к пульмонологам и врачам других специальностей – фтизиатрам, гастроэнтерологам, оториноларингологам, кардиологам [3, 5].
С физиологической точки зрения кашель является вторым защитным барьером дыхательных путей при попадании в них инородных частиц. Первым этапом очищения бронхиальной системы, как известно, является мукоцилиарный клиренс, осуществляемый клетками реснитчатого эпителия и клетками желез, продуцирующих бронхиальный секрет – подслизистые железы, бокаловидные клетки и клетки Клара [7]. Кашлевой рефлекс закономерно включается и в процесс защиты нижних дыхательных путей при аспирации желудочного содержимого, хроническом бронхите, бронхоэктазах [4, 8]. В то же время известно большое количество заболеваний, при которых кашель не выполняет свойственную ему защитную функцию. Так, нередко в основе хронического кашля лежит раздражение кашлевых рецепторов, находящихся вне пределов трахео-бронхиального дерева, как например, при гастроэзофагеальной рефлюксной болезни, синдроме постназального затека [4].
Хроническая обструктивная болезнь легких (ХОБЛ) как одно из наиболее распространенных заболеваний бронхо-легочной системы является и одной из самых частых причин хронического кашля [4]. У больных ХОБЛ кашель в большинстве случаев является продуктивным, так как хроническое воспаление нижних дыхательных путей сопровождается избыточным образованием бронхиального секрета, соответственно экспекторацией значительного количества мокроты. При обострении ХОБЛ это явление становится особенно выраженным. С клинической точки зрения установление факта продуктивности/непродуктивности кашля очень важно, так как оказывается решающим при выборе препаратов для его лечения. Так, при лечении продуктивного кашля возможно назначение мукоактивных препаратов (муколитиков, мукорегуляторов, мукокинетиков) и, наоборот, противопоказано применение противокашлевых препаратов [2].
В то же время гиперпродукция бронхиальной слизи не всегда проявляется отделением мокроты. Это свидетельствует о неэффективности продуктивного кашля, не выполняющего присущую ему дренажную функцию. В литературе рассматривается несколько возможных причин данного явления: недостаточно выраженный кашлевой рефлекс, недостаточная моторика бронхов и недостаточная «подача» мокроты в зону кашлевого рефлекса; снижение возбудимости кашлевого центра, что зависит от возраста (грудные дети, старики) или может быть связано с интоксикацией (гиперкапния, токсическое угнетение центральной нервной системы при инфекциях), а также наблюдаться во время наркоза, глубокого сна; снижение чувствительности рецепторов в бронхах - местная анестезия (например, парами ментола), дегенерация нервных окончаний в результате хронического воспаления. Слишком большая вязкость мокроты также ассоциируется с неэффективным кашлем. Кроме того, большое значение имеет малая мощность воздушной струи во время кашлевого толчка, обусловленная ригидностью грудной клетки, малой податливостью легких или, чаще всего, нарушениями проходимости бронхов, а также недостаточно глубокое дыхание (продвижение секрета в бронхах пропорционально глубине дыхания) [1].
Больные ХОБЛ с сопутствующими грыжами передней брюшной стенки в периоперационном периоде представляют собой особую когорту пациентов. Дело в том, что кашель, причины появления или усиления которого в послеоперационном периоде бывают различными (обострение или ухудшение течения хронического заболевания дыхательной системы или раздражающее влияние интубационной трубки и др.) с одной стороны может рассматриваться в качестве провоцирующего и поддерживающего процесс грыжеобразования фактора, а с другой – как нередко наблюдаемый негативный симптом в послеоперационном периоде, способствующий длительному и не всегда качественному заживлению послеоперационной раны, что создает предпосылки для дальнейшего рецидива грыжи.
Учитывая вышеизложенное, кашель у больных ХОБЛ и грыжами передней брюшной стенки требует всесторонней оценки с целью своевременной адекватной коррекции, а при необходимости - профилактического подхода с позиции минимизации риска его появления или усиления.
Целью исследования была оценка эффективности продуктивного кашля у больных ХОБЛ и вентральными грыжами в периоперационном периоде.
Материалы и методы. Нами были обследованы 38 больных ХОБЛ 1-2 стадии с абдоминальными грыжами в возрасте 19–77 лет (20 мужчин, 18 женщин), находившихся на лечении в общехирургических отделениях Городской клинической больницы скорой и медицинской помощи №1 г. Воронежа.
Принимая во внимание возможное ухудшение функции дыхательной системы из-за развития в раннем послеоперационном периоде синдрома абдоминальной компрессии, в исследование включались больные с достаточно большими размерами грыжевого дефекта, а именно от 6 до 8 см.
Таким образом, в исследовании приняли участие 14 больных с грыжами белой линии и сопутствующим диастазом прямых мышц живота, и 24 пациента с послеоперационными срединными грыжами. Критериями исключения из исследования были наличие острой или декомпенсированной патологии сердечно-сосудистой системы, печени, почек, эндокринной системы, а также наличие патологии бронхо-легочной системы помимо ХОБЛ.
Все больные были разделены на 2 группы в зависимости от варианта анестезиологического пособия. Выбор данного критерия разделения пациентов на группы определялся описанным в литературе фактом возможного влияния препаратов, применяющихся при проведении эндотрахеального наркоза, на эффективность продуктивного кашля [1]. Вариант анестезиологического пособия определялся в каждом случае с учетом возможного операционного риска, анамнестических данных, возможной продолжительности оперативного вмешательства. Первую группу составил 21 пациент, у которых герниопластику планировали проводить под эндотрахеальным наркозом, из них 7 больных с грыжами белой линии и сопутствующим диастазом прямых мышц живота, и 14 пациентов с послеоперационными срединными грыжами. Во вторую группу вошли 17 пациентов, оперировавшихся с использованием спинальной анестезии, из них 7 больных с грыжами белой линии и сопутствующим диастазом прямых мышц живота, и 10 пациентов с послеоперационными срединными грыжами. В независимости топографического расположения грыжевого выпячивания у всех больных проводили натяжную герниопластику с использованием аллопротезирования.
По дизайну проводимое исследование являлось проспективным открытым последовательным. Все участники исследования предоставили информированное согласие.
Помимо общепринятых рутинных лабораторных методов обследования, таких как общий и биохимический анализы крови, общий анализ мочи, электрокардиография, всем больным до и на 2-й день после операции проводилась спирометрия, субъективная оценка выраженности кашля, а также определение суточного количества мокроты. Для оценки параметров функции внешнего дыхания (ФВД) применялся портативный спирометр «Vitalograph». Анализировались следующие показатели: объем форсированного выдоха за 1 секунду (ОФВ1), форсированная жизненная емкость легких (ФЖЕЛ), индекс Тиффно.
Субъективная оценка кашля проводилась с помощью визуальной аналоговой шкалы (ВАШ) в сантиметрах (0 – отсутствие кашля, 10 см – нестерпимый кашель).
Процедура сбора мокроты с последующим определением ее количества осуществлялась следующим образом. Испытуемого просили прочистить нос, прополоскать рот водой и сделать глоток воды для снижения загрязнения мокроты глоточным секретом или слюной. Затем пациент в течение суток откашливал мокроту в специальную емкость. Мокроту выливали в чашку Петри, наименее прозрачные желатиноподобные компоненты мокроты, которые по внешнему виду отличались от слюны, выбирали тупоконечными щипцами и помещали в другую чашку. Выбранную часть центрифугировали для удаления оставшейся слюны, а затем помещали в предварительно взвешенную трубку. Для определения веса порции мокроты трубку с мокротой взвешивали снова.
Статистический анализ полученных данных осуществляли с использованием непараметрических методов модуля статистического анализа пакета прикладных программ Microsoft Office 2007. Численные значения параметров представлены в виде медианы, в скобках указаны 25% и 75% перцентили. Различия считали достоверными при уровне значимости р<0,05.
Результаты и их обсуждение. По результатам проведенного обследования перед операцией группы не отличались ни по выраженности кашля, ни по количеству мокроты, собранной за сутки, ни по спирометрическим показателям.
На 2-е сутки после герниопластики у больных как первой так и второй группы наблюдалось снижение оцениваемых показателей функции внешнего дыхания, а именно ОФВ1 и индекса Тиффно (табл. 1). Возможно, это обусловлено тем, что после пластики грыжевого дефекта вследствие уменьшения объема брюшной полости повышается внутрибрюшное давление. В свою очередь это ведёт к повышению внутригрудного и внутриплеврального давления, уменьшению трансторакального давления, что нарушает вентиляционо-перфузионное соотношение, снижает эффективность дыхания [6]. Кроме того, надо учитывать выраженность болевых ощущений в области послеоперационной раны в раннем послеоперационном периоде, что ведет к ограничению подвижности брюшной стенки при выполнении дыхательного маневра в процессе проведения спирометрической пробы, и соответственно снижению значений получаемых показателей.
Таблица 1. Динамика оцениваемых показателей до и на 2-е сутки после герниопластики у больных в исследуемых группах
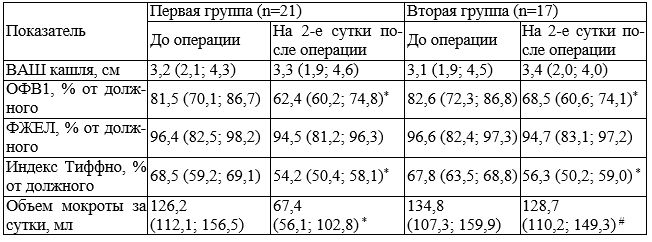
Примечание: * - достоверные различия исследуемых показателей у больных до и на 2-е сутки после операции при р<0,05; # - достоверные различия исследуемых показателей у больных первой и второй группы на 2-е сутки после герниопластики при р<0,05
Что касается выраженности кашля и его эффективности, оцениваемой по суточному объему мокроты, были получены следующие результаты. Вне зависимости от принадлежности пациентов к той или иной группе, соответственно независимо от варианта анестезиологического пособия, применявшегося при оперативном лечении, у большей части больных по данным ВАШ оценки кашля изменений его выраженности на 2-е сутки после герниопластики не отмечалось. У пациентов первой группы это может объясняться взаимной компенсацией двух явлений. С одной стороны, использование эндотрахеального наркоза сопровождается раздражением кашлевых рецепторов при непосредственном контакте интубационной трубки со слизистой дыхательных путей, что может приводить к появлению кашля, а у больных ХОБЛ к его усилению в раннем послеоперационном периоде. Однако, принимая во внимание, описанное ранее возможное угнетение кашлевого рефлекса за счет подавления активности кашлевого центра при воздействии применяющихся в процессе наркоза лекарственных препаратов центрального действия, возможно, этот процесс уравновешивает первый, что мы и наблюдали у больных первой группы в виде отсутствия изменения выраженности кашля после операции.
Следует отметить, что на 2-е сутки после герниопластики у пациентов первой группы отмечался достоверно меньший суточный объем мокроты по сравнению с больными второй группы. Это свидетельствует о неэффективности кашля у больных после применения эндотрахеального наркоза. Значительное снижение количества экспекторируемой мокроты на фоне продолжающейся гиперпродукции бронхиального секрета может негативно сказываться на течении ХОБЛ, вызывать ухудшение состояния больных, усиливая бронхиальную обструкцию. Это в свою очередь требует своевременной и адекватной коррекции противокашлевой терапии больных ХОБЛ в периоперационном периоде с назначением препаратов, влияющих на вязкость мокроты, облегчающих ее отхождение, что будет способствовать улучшению течения послеоперационного периода, снижения сроков госпитализации.
