В последнее время внимание исследователей все больше привлекает феномен повреждения легочной ткани продуктами жизнедеятельности бактерий (прежде всего – липополисахаридов, ЛПС), способных к образованию водных или водно-масляных дисперсий в воздушной среде. Такое ингаляционное повреждение может иметь острый характер или становиться основой хронической легочной патологии [8, 11, 12].
В литературе приведены доказательства взаимосвязи хронических ингаляций бактериальных токсинов в развитии легочной патологии у людей определенных профессий – заготовщиков сена, работников мясокомбинатов, парниковых хозяйств и ряда подобных предприятий [9, 10]. Ингаляция ЛПС возможна не только за счет поступления его из атмосферы (включая нестерильные воздухоносные контуры), но и при массовой гибели микроорганизмов в верхних дыхательных путях или ротовой полости [9].
Специфика токсического повреждения легких обусловлена их структурно-функциональными особенностями, значительными объемами транзита атмосферного воздуха и крови, а также высоким представительством клеток, секретирующих биологически активные вещества в ответ на контакт с токсинами [3, 6, 12]. Именно выброс цитокинов и других медиаторов воспалительного ответа определяет ключевые события в легочной ткани при действии ЛПС. Интенсивность тканевых изменений в легких значительно варьирует в зависимости от количества и кратности ингаляций ЛПС. В остром процессе доминирует цитокин-зависимое повреждение эндотелия и эпителиальной выстилки межальвеолярных перегородок, повышение сосудистой проницаемости и накопление экссудата, в том числе и полиморфно-ядерных лейкоцитов, в альвеолярных пространствах. Эта картина морфологически соответствует острому респираторному дистресс-синдрому взрослых, или «шоковому легкому» [1, 5, 9]. Лейкоциты и слущенный эпителий попадают и в альвеолярный экссудат, в связи, с чем могут быть выявлены в бронхоальвеолярных смывах (БАС) [3]. При ингаляции малых доз бактериального ЛПС развивается повреждение по типу субхронического бронхоальвеолита, сопровождающееся частичной деструкцией бронхиального эпителия и альвеолоцитов, реакцией альвеолярных и бронхиальных макрофагов, снижением воздушности легких при умеренно выраженной бронхиальной экссудации [7, 9].
К настоящему времени, нерешенной задачей остается эффективное отслеживание таких форм легочного повреждения. При этом тенденции диагностики в данной области – это уход от традиционных и инвазивных процедур (забор крови, биоптаты, исследование ротовой жидкости мокроты и БАС) к анализу выдыхаемого воздуха (экспирата). В отношении ингаляционного повреждения ЛПС сделано еще очень немного шагов, что обусловливает необходимость поэтапного изучения этих процессов в эксперименте.
Цель работы - выявить взаимосвязь между морфологическими изменениями в легких и цитологическим составом лаважной жидкости у лабораторных животных при моделировании острого ингаляционного повреждения при помощи мелкодисперсного аэрозоля ЛПС.
Материалы и методы. Исследование носило экспериментальный характер, и было выполнено на 18 половозрелых нелинейных белых крысах самцах массой 250-350 г. Испытуемые животные были разделены на три группы: первую группу выводили через 3 часа, вторую через 8 часов после ингаляции ЛПС и группа контроля, в каждой группе было по 6 животных. Протокол экспериментов в разделах выбора, содержания животных, моделирования патологических процессов и выведения их из опыта был составлен в соответствии с принципами биоэтики, правилами лабораторной практики [2].
Животные подвергались воздействию аэрозольного ЛПС E. coli О128:B12 (Sigma, USA), диспергированного в 0,85% растворе хлорида натрия, в атмосфере герметичной ингаляционной камеры объемом 100 л в течение 1 часа. Микроаэрозольные частицы получали с помощью компрессорного ингалятора CN-231 (Japan), согласно техническим характеристикам которого средний размер распыляемых частиц составляет 4 мкм. Таким образом, получаемые микроаэрозольные частицы были способны проникать не только в верхние дыхательные пути, но и в альвеолярный аппарат легких. После ингаляции крысы находились в течение 3 или 8 часов в обычных клетках, что необходимо для развития полноценной острой реакции на воздействие ЛПС [7], и выведены из эксперимента передозировкой Золетила (200 мг/кг массы).
Непосредственно после эвтаназии одно легкое у каждой крысы использовали для получения БАС путем двукратной инстилляции в бронхиальное дерево 1,5 мл 0,85% раствора хлорида натрия. Клеточный осадок получали на микроцентрифуге ScanSpeed mini BLUE (Denmark), (10 мин 3 тыс. об/мин), равномерно распределяли по обезжиренному предметному стеклу и давали высохнуть. Затем готовили микропрепараты и окрашивали их азур-эозином. Из второго лёгкого каждой крысы приготавливали гистологические препараты. Использовали общепринятые методики фиксации и получения срезов, которые окрашивали гематоксилином и эозином [4].
Иммуногистохимическое выявление макрофагов проводили с использованием моноклональных антител против маркера CD-68 (DakoCytomation, Дания). Исследование и оцифровку типичных участков на препаратах проводили на микроскопе БИМАМ Р-13 (Ломо, Россия) с фотокамерой TK-C620E JVC (Japan). Для количественной оценки изменений в легких рассчитывали объемную долю воздуха альвеол (%), поверхностную плотность альвеолоцитов (1/мм2) и численную плотность альвеолярных макрофагов (1/мм3). В БАС раздельно подсчитывали количество гранулоцитов, лимфоцитов, моноцитов и макрофагов, а также эпителиальных клеток (1/мл) и их соотношение в БАС в процентах. Количество неклеточных элементов оценивали по наличию волокнистых (эластические и фиброзные волокна) и кристаллических образований.
Для накопления, хранения и статистической обработки экспериментальных данных использовались пакеты программ и программные продукты Office XP (Excel, Word) из пакета (Microsoft, США), Statistica 6.0 (StatSoft Inc., США) и Photoshop CC (Adobe Systems Software Ireland Ltd, Ireland).
Результаты и обсуждение. После ингаляции ЛПС в легких животных морфологически регистрировали признаки острого токсического повреждения. Просветы бронхов были большей частью свободными с небольшим количеством слущенного эпителия, слизисто-белкового экссудата и лейкоцитов, среди которых преобладали лимфоциты и макрофагов. Со стенок бронхов местами эпителий был слущен на протяжении, сосуды их стенки были расширены, наблюдались скопления макрофагов и лимфоцитов. Часть альвеол была эмфизематозно расширена до разрывов со слиянием соседних альвеол, часть - с уменьшенным просветом за счет увеличения объема межальвеолярных перегородок. Просвет большинства альвеол был чист, но сужен за счет резкого утолщения межальвеолярных перегородок в результате их отека и лейкоцитарной (преимущественно – лимфоцитарной) инфильтрации, полнокровия микроциркуляторного русла. Наблюдалась выраженная реакция альвеолярных макрофагов в виде увеличения их размеров и появления скоплений в межальвеолярной перегородке. Обнаруживалось множество крупных макрофагов с пенистой цитоплазмой. Кровеносные капилляры были частью спавшимися, частью - резко расширенными за счет скопления агрегатов эритроцитов. Между 3 и 8 часами с момента действия ЛПС на качественном уровне различий в морфологии легочной ткани не выявили.
Показатели морфометрии легких отражены в табл. 1.
Воздействие ЛПС сопровождалось снижением воздушности легочной ткани к 3 часам в 1,3 раза, к 8 часам – 1,7 раза (оба P<0,05). Уменьшение поверхностной плотности эпителиальной выстилки альвеол уменьшалось к 8 часу после ингаляции ЛПС в 1,4 раза (P<0,05), а численная плотность альвеолярных макрофагов – возрастала более, чем в 2,5 раза (P<0,001). Полученные данные свидетельствуют о том, что морфометрия является высокоинформативным методом для оценки состояния легочной ткани при ингаляционном повреждении, когда речь идет об экспериментальных исследованиях или летальных случаях для человека.
Tаблица 1. Показатели морфометрии легочной ткани крыс при ингаляции бактериального липополисахарида (M ± m)
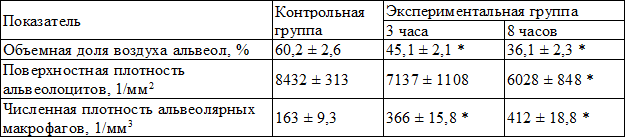
Примечание: здесь и далее *- достоверные различия с величиной показателя в контрольной группе (сравнение по Манну-Уитни Р<0,05)
Иммуногистохимический анализ подтвердил высокую интенсивность макрофагальных реакций в легких при ингаляционном повреждении ЛПС. Уже с первых часов эксперимента в межальвеолярных перегородках наблюдались скопления макрофагов с гиперэкспрессией CD-68, которые располагались периваскулярно, обычно группами по две-пять клеток (рис. 1).
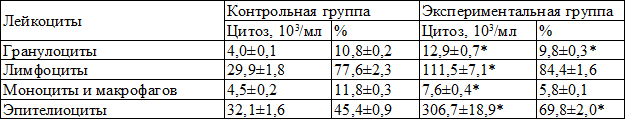
В ходе исследования микропрепаратов БАС эластических, фиброзных волокон и кристаллических образований ни в одном случае обнаружено не было. Результаты цитологического исследования представлены в табл. 2.
Ингаляция ЛПС сопровождалась значительным увеличением клеточного материала в БАС. Число макрофагов и моноцитов увеличивалось к 3 часу от начала эксперимента в 1,7 раза (P<0,05), число гранулоцитов – в 3,1 раза (P<0,01), гранулоцитов – в 3,7 раза (P<0,01), а эпителеоцитов – почти в 10 раз (P<0,001). Как видим, прирост лимфоцитов, гранулоцитов и слущенного эпителия в БАС весьма информативен в отношении повреждения легких ЛПС.
Полученные данные свидетельствуют о том, что ингаляция ЛПС сопровождается значительными изменениями со стороны паренхимы легких, основу которых составляют сосудистые и клеточные реакции.
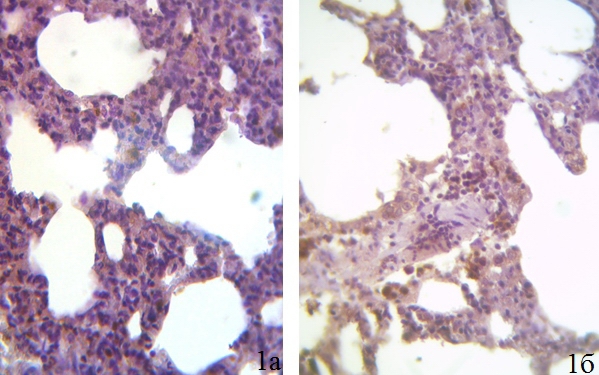
Рис. 1. Альвеолярные макрофаги в легких крысы. А. Интактные животные. Единичные клетки и небольшие скопления макрофагов в межальвеолярных перегородка. Б. 3 часа после ингаляции ЛПС. Множественные скопления макрофагов, реакция активации. Окр. – моноклональные антитела к CD-68, иммунопероксиадзный метод, докраска гематоксилином. Ув. 400
Таблица 2. Клеточный состав бронхоальвеолярного лаважа крыс через 3 часа после ингаляции бактериального липополисахарида (M±m)
Поступление ЛПС в межальвеолярные перегородки приводит к неизбежной активации находящихся там макрофагов, а также к массивной миграции гранулоцитов и лимфоцитов из кровотока. Они усугубляют картину сосудистых нарушений и вызывают дополнительное повреждение эпителия и эндотелиальных клеток [1, 5]. В наших опытах подтверждается слабое проникновение лейкоцитов и поврежденного альвеолярного эпителия в просвет альвеол и воздухоносных путей. Но и этого, сравнительно небольшого, количества клеток вполне достаточно для существенного изменения клеточного состава БАС.
Заключение. Полученные данные свидетельствуют о том, что однократная инспирация бактериального ЛПС сопровождается развитием типичного острого токсического повреждения легких. Наиболее выраженными проявлениями этого повреждения в респираторных отделах легких являются сосудистые реакции и реакция альвеолярных макрофагов, в несколько меньшей степени – повреждение собственно альвеолярного эпителия. Тем не менее, именно многократное увеличение эпителиальных клеток, при несколько меньшем приросте числа лимфоцитов и гранулоцитов, является наиболее выраженным изменением при исследовании клеточного состава БАС. Следовательно, подобный диагностический подход эффективен, и достаточно точно отражает морфологические изменения в межальвеолярных перегородках при ингаляционном повреждении легких бактериальным ЛПС.
