Бронхиальная астма, в настоящее время, является одной из наиболее актуальных проблем современной респираторной медицины. Для контроля симптомов данного заболевания и поддержания должного уровня показателя контроля симптомов астмы, этим пациентам требуется постоянная медикаментозная терапия. Но, не смотря на то, что возможности современной фармакотерапии бронхиальной астмы, позволяют обеспечить у большинства больных страдающих данной респираторной патологией, оптимальный контроль симптомов астмы и адекватное качество жизни, результаты многочисленных крупномасштабных исследований указывают на неудовлетворительное состояние данного вопроса в условиях реальной клинической практики [1].
В официальном тексте GINA, наряду с медикаментозными и не медикаментозными вмешательствами по первичной и вторичной профилактике бронхиальной астмы, подчеркивается необходимость, в целях повышения эффективности контроля симптомов заболевания, уделять внимание третичной профилактике [2]. Третичная профилактика бронхиальной астмы представляет собой мероприятия, направленные на нивелирование воздействия аллергенов и/или неаллергенных триггеров на показатели контроля симптомов респираторной патологии у пациентов с уже развившейся астмой. К такого рода триггерам относят пищевые агенты, поллютанты, бытовые аллергены, лекарственные препараты и пр. [2]. Одним из факторов, влияние которого на частоту обострений, степень тяжести, контроль симптомов и качество жизни пациентов бронхиальной астмой доказано, является микогенная аллергия [3]. Последняя, может быть связана либо с ингаляцией грибкового аэрозоля (чаще у пациентов с сенсибилизанией к плесневых грибам) [4], либо с персистированием микотической инфекции кожи (чаще у пациентов с дерматофитийной аллергией) [5].
Распространенность одной из клинико-этиологических форм дерматофитийной инфекции - микоза гладкой кожи и ногтей стоп, на территории нашей страны, по данным исследования «Ахиллес», достигает в общей популяции 15% [6]. Этот факт создает предпосылки для высокой распространенности грибковой инфекции стопы, среди пациентов бронхиальной астмой и формирования соответствующей дерматореспираторной коморбидности. В настоящее время, большое количество опубликованных работ подтверждают значение микогенной сенсибилизации у пациентов с грибковой патологией в иммунопатогенезе бронхиальной астмы. Так, в своем исследовании Woodfolk J.A., изучая различные аспекты сенсибилизации к грибам рода Trichophyton, в группе пациентов страдающих дерматофитным онихомикозом подчеркивает немаловажную роль Trichophyton spp. в формировании немедленного IgE - зависимого иммунного ответа у пациентов астмой [7]. В работе Palmo-Carlos A.G. и Palmo-Carlos M.L. среди коморбидных пациентов персистирующей бронхиальной астмой и онихомикозом стоп, обнаружили специфические IgE - антитела к Trichophyton spp. у 69,3% пациентов [8]. В наших исследования была так же подтверждена роль дерматофитийной сенсибилизации среди коморбидных пациентов астмой, а так же выявлены клинические маркеры микогенной сенсибилизации у данной категории больных, позволяющие, не прибегая к лабораторному исследованию, определить степень значимости сопутствующей грибковой инфекции в иммунопатогенезе бронхиальной астмы [9].
Целями нашего исследования было изучение эффективности системной антимикотической терапии у коморбидных пациентов бронхиальной астмой и онихомикозом стоп в отношении улучшения показателей контроля симптомов респираторного заболевания, а так же выявление клинических предикторов противогрибковой медикаментозной терапии у данной категории больных.
Материалы и методы. Все включенные в исследование больные были условно разделены на несколько групп. Первую группу составили 108 коморбидных пациентов страдающих бронхиальной астмы и различными клиническими вариантами микотической патологии стопы, ассоциированной с Tr.rubrum у которых лабораторно была выявлена трихофитийная сенсибилизация (обнаружение в плазме крови специфических IgE к Tr.rubrum). Вторую группу составили 110 коморбидных больных, страдающих астмой и руброфитией стопы, но не имеющих трихофитийной сенсибилизации (в плазме крови не было обнаружено специфических IgE). Третью группу составили 24 коморбидных пациента с БА и микотической патологией стопы не ассоциированной с Tr.rubrum. Самостоятельное выделение третьей группы было вызвано двумя обстоятельствами, во-первых, чрезвычайной редкостью неруброфитийного микоза стоп и онихомикоза, а во вторых, большей по сравнению с руброфитийным микозом, клинической значимостью сенсибилизации больных к таким возбудителям как Tr.mentagrophytes var. interdigitale и C.albicans у больных с персистирующей бронхиальной астмой. Четвертая группа состояла из 101 пациента с диагнозом бронхиальная астма, у которых при тщательном клиническом исследовании не было выявлено признаков грибковой патологии кожи, ее придатков и слизистых оболочек. Отсутствие грибковой патологии у больных четвертой (контрольной) группы было подтверждено с помощью поэтапно проведенных лабораторных исследований: микроскопического, культурального и амплификационного. Пятая группа анализируемых больных была сформирована фактически «случайно». Из запланированных 270 коморбидных пациентов 28 по тем или иным причинам не стали получать антифунгальную терапию и анализировались в исследовании отдельно. Причины формирования данной группы пациентов были весьма гетерогенны и, учитывая их важность представлены в данной статье. У первого пациента в исследовании после третьего месяца «пульс-терапии» пероральным итраконазолом началось нарастание клинико-лабораторных показателей гепато-цитолитического синдрома, сопровождавшегося умеренной клинической симптоматикой и значительным нарастание аминотрансфераз в венозной плазме. После троекратного увеличения маркеров гепатоцитолиза пациент был включен в данную группу. Четыре пациента после начала приема назначенной антимикотической терапии демонстрировали крайне низкую приверженность к лечению онихомикоза стоп, постоянно нарушая режим медикаментозной терапии и наблюдения. В дальнейшем с их добровольного информированного согласия их лекарственная терапия была прекращена. Остальные 23 коморбидных пациента бронхиальной астмой сразу отказались от приема пероральных антимикотиков в рамках их участия в данной исследовательской программе. Отказ от специфической дерматологической терапии эти пациенты объясняли, прежде всего, двумя обстоятельствами: полипрагмазией с одной стороны и отсутствием каких либо клинически значимых проявлений грибковой патологии стопы, с другой. Стоит отметить, что некоторые пациенты в исследовании (n=2), несмотря на проводимое превентивное консультирование, игнорировали сам факт наличия у них грибкового заболевания, считая имеющиеся изменения цвета и структуры ногтевых пластин последствиями «травмы» или «ношения тесной обуви». Таким образом, именно эти 23 коморбидных пациента составили т.н. «вторую контрольную группу». Средний возраст больных составил 57,2+4,6 лет. Среди всех включенных в исследование пациентов мужчины составляли 43,5% (n=149), а женщины 56,5 % (n=194).
Больные первой и второй групп (n=218), подписавшие информированное согласие на медикаментозную терапию онихомикоза были случайным образом (методом «конвертов») разделены на две подгруппы.
Пациенты подгруппы № 1 (n=109) получали антифунгальный препарат тербинафин (оригинальный). Тербинафин пациентам назначался в стандартной терапевтической дозировке по 250 мг 1 раз в сутки. Данный антимикотик является производным N-метилнафталенметенамина. Механизм действия последнего связан с ингибированием фермента сквален - эпоксидазы и подавление синтеза эргостерола клеточной стенки гриба. Отсутствие эргостерола в мембране гриба-возбудителя, делает невозможным его дальнейшее функционирование.
Пациенты, составившие подгруппу № 2 (n=109), получали в качестве противогрибкового агента оригинальный официнальный итраконазол в режиме «пульс-терапии», т.е. по 200 мг 2 раза в сутки, первую неделю каждого последовательного месяца. Итраконазол является антифунгальным препаратом из группы азолов. Его механизм действия связан с ингибированием фермента 14-диметилазы. Последствия ингибирования приводят к невозможности образования эргостерола из его предшественника ланостерола клеточной стенки гриба. Пациенты с астмой и сопутствующим не руброфитийным микозом получали только итраконазол, по той же схеме, что и пациенты во второй подгруппе, в виду не эффективности тербинафина в данной этиологической группе.
Перед началом противогрибковой терапии всем пациентам в исследовании был проведен биохимический анализ крови для определения активности трансаминаз печени (аланинаминотрансферазы и аспартатаминотрансферразы). Соответствующие параметры находились в пределах значений концентраций допустимых для назначения системной антимикотической терапии.
В качестве метода оценки тяжести онихомикоза использовался индекс КИОТОС (клинический индекс оценки тяжести онихомикоза Сергеева). При расчетных значениях КИОТОС больше 16 баллов у коморбидных пациентов в исследовании назначалась местная противогрибковая терапия. Все пациенты, подписавшие информированное согласие на проведение антимикотической терапии (n=242), получили первую дозу антимикотика в течение первых 4-5 дней со дня поступления в стационарное отделение, на базе которого проводилось исследование. Всем коморбидным больным, поступавшим в стационар проводилась стандартная терапия обострения астмы, включавшая системные и/или ингаляционные глюкокортикостероиды, коротко и длительнодействующие бета-2-агонисты, холинолитические лекарственные препараты.
Динамическое наблюдение пациентов осуществлялось ежемесячно на протяжении всего срока исследования: проводилась оценка контроля симптомов бронхиальной астмы (с помощью валидизированного опросника ACT (Asthma Control Test)), оценка пиковой скорости выдоха (ПСВ) и исследование суточной вариабельности ПСВ, определение параметров функции внешнего дыхания с помощью спирометрического исследования (с помощью спирографа «Spirovit SP-1» («Schiller», Швейцария)). Расчетная длительность системной антимикотической терапии основывалась на значении индекса КИОТОС, но у большинства больных зависела от индивидуальной скорости отрастания ногтевых пластин.
Результаты. После завершения двухлетнего периода наблюдении, были получены следующие результаты: у коморбидных пациентов в динамике системной антифунгальной терапии, было выявлено более существенное нарастание (улучшение) среднего значения АСТ в группах получавших системные антимикотики, по сравнению с пациентами астмой и онихомикозом не получавшими эту терапию; применялись стандартные методы непараметрической статистики.
Таблица 1. Значения показателя контроля симптомов астмы в динамике медикаментозной терапии (p<0,05)
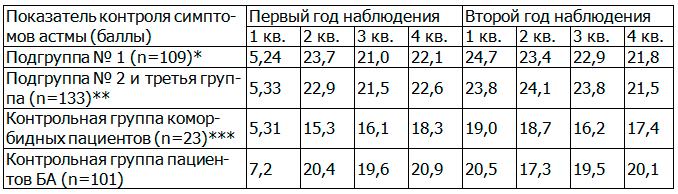
Примечания:
* - пациенты первой подгруппы, получавшие системный тербинафин (пациенты первой и второй групп);
** - пациенты второй подгруппы, получавшие системный итраконазол (n=109) и пациенты третьей группы с не руброфитийными онихомикозами (n=24);
*** - коморбидные пациенты бронхиальной астмой и онихомикозом, отказавшиеся, по тем или иным причинам, от системной антимикотической терапии (n=23).
Идентичные тенденции в динамике антимикотической терапии у пациентов астмой, были выявлены в отношении большинства «скоростных» показателей функции внешнего дыхания (ОФВ1, ПСВ, ФЖЕЛ, МОС).
Два года наблюдения за пациентами в исследовании статистически достоверно продемонстрировали значительное улучшения показателей контроля симптомов астмы в случае устранения у таких коморбидных пациентов грибкового резервуара, а значит и источника микогенной сенсибилизации.
Существенные различия в средних значениях респираторных показателей, между контрольной группой больных имеющих онихомикоз, но отказавшихся от антимикотической терапии и группами комбинированного лечения (особенно на втором году наблюдения) подтверждает большое клиническое значение микогенной сенсибилизации у больных персистирующей бронхиальной астмой. Отсутствие статистически достоверных различий между подгруппами коморбидных больных с астмой, получавших разные антифунгальные препараты подтверждает важность элиминации грибкового резервуара в ногте и отсутствие различий в «способах достижения» этой цели для потребностей терапии респираторной патологии.
Для достижения второй цели нашего исследования предпринята попытка проанализировать наличие т.н. «клинических предикторов эффективности антимикотической терапии» у коморбидных пациентов бронхиальной астмой и онихомикозом, среди «маркеров» микогенной сенсибилизации у данной категории больных, выявленных в наших ранних исследованиях [9].
То есть тех «клинических критериев», наличие которых у коморбидных больных бронхиальной астмой определяло бы «наилучший» клинико-функциональный ответ респираторной патологии на антифунгальную терапию.
Среди таких «факторов» в нашем исследовании анализировались следующие «маркеры микогенной сенсибилизации», выявленные нами ранее, значения которых коррелировали со степенью (оцениваемой полуколичественно) микогенной сенсибилизации: величина показателя индекса КИОТОС, показатель длительности анамнеза грибковой патологии стопы, наличие анамнестических указаний на наличие у пациента аллергической/параалергической реакции в ответ на прием бета-лактамных антибактериальных препаратах, определяемое анамнестически количество эпизодов интертригинозного микоза стоп, выявление в анамнезе различных id-реакции.
В соответствии с дизайном нашего исследования, подгруппы коморбидных пациентов астмой, с различными величинами полуколичественных параметров отражающих каждый из пяти предполагаемых «маркеров» грибковой сенсибилизации, оценивались в динамике антифунгальной терапии отдельно и сравнивались со значениями второй группы больных (коморбидные пациенты астмой и руброфитией стоп без обнаружения в плазме крови специфических IgE). Статус «клинического предиктора» эффективности антифунгальной терапии присваивался только тем «маркерам» в подгруппах коморбидных больных, которых имела место положительная корреляция между величиной (значением) «маркера» и максимальным объемом «прироста» показателей контроля симптомов бронхиальной астмы и тяжести данной респираторной патологии в динамике респираторной и противогрибковой терапии. Для потребностей нашего исследования анализировались только больные астмой у которых грибковая сенсибилизация была подтверждена лабораторно. Так называемый коэффициент прироста показателя контроля симптомов астмы (АСТ) и некоторых спирометрических «скоростных» параметров функции внешнего дыхания у пациентов персистирующей БА рассчитывался следующим образом: КП=((П2-П1)/П2)100%, где КП - коэффициент «прироста» параметра (под «параметром» для настоящего исследования понимались следующие величины отражающие степень контроля и тяжести БА: показатель контроля симптомов астмы (АСТ), ОФВ1, ФЖЕЛ, ПСВ); П1 - оцениваемый параметр в начале наблюдения пациента первой/второй группы, до начала антифунгальной терапии; П2 - оцениваемый параметр после клинико - лабораторного выздоровления в отношении грибковой патологии стопы.
По уровню показателя индекса КИОТОС пациенты первой группы были разделены на несколько подгрупп в каждой из которых проводился анализ указанного выше «коэффициента прироста», того или иного респираторного параметра.
Таблица 2. «Коэффициент прироста» респираторных параметров в динамике лечения у коморбидных пациентов в подгруппах с различной величиной КИОТОС (p<0,01)
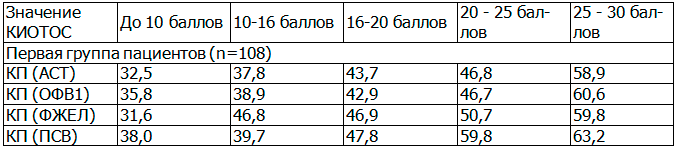
Из представленной табл. 2 видно, что величина прироста спирометрических параметров и интегрального показателя контроля симптомов астмы, имеет статистически достоверную положительную корреляционную связь с величиной индекса КИОТОС. Это подчеркивает важность КИОТОС, как «клинического предиктора» микогенной сенсибилизации и показателя эффективности антимикотической терапии в отношении влияния данной терапии на течение бронхиальной астмы.
При дальнейшем проведении исследования было выявлено, что между величинами прироста спирометрических показателей и интегрального показателя контроля симптомов астмы (на фоне системной антимикотической терапии в динамике лечения руброфитии ногтей), с одной стороны и такими «маркерами грибковой сенсибилизации» как длительность анамнеза микотической патологии стопы и анамнестическое указание на наличие у пациента аллергической реакции в ответ на прием бета-лактамных антибактериальных препаратах, с другой стороны, отсутствовала статистически достоверная корреляционная связь.
Напротив, при анализе степени клинической значимости оставшихся двух «маркеров» были выявлены статистически достоверные корреляционные связи. Так между величинами прироста спирометрических параметров и интегрального показателя контроля симптомов астмы (на фоне системной антифунгальной терапии в динамике лечения руброфитии стоп у коморбидных больных астмой), с одной стороны и частотой эпизодов интертригинозного микоза стоп, с другой стороны, была выявлена определенная корреляционная связь (см. табл. 3).
Таблица 3. «Коэффициент прироста» респираторных параметров в динамике лечения у коморбидных пациентов в подгруппах с различной частотой эпизодов интертригинозного микоза стоп (p<0,01)
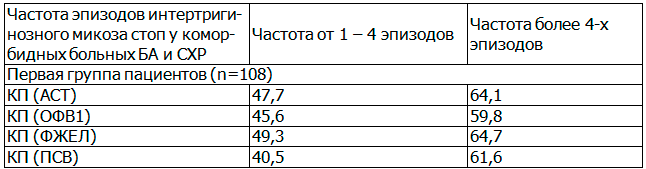
Учитывая крайне малое число коморбидных пациентов персистирующей бронхиальной астмой и синдромом хронической руброфитии имеющих в анамнезе эпизод(ы) id - реакции в первой группе исследования, специального дополнительного анализа в отношении данной, крайне малой группы больных (n=4) не проводилось. Но, нельзя не отметить, что именно в данной группе больных коэффициенты прироста спирометрических параметров и интегрального показателя контроля симптомов астмы (на фоне системной антифунгальной терапии в динамике лечения руброфитии) были максимальными (КП более 65 %, при p<0,01). Именно эти четыре пациента продемонстрировали «наилучший клинический ответ» на комбинированную противоастматическую и противогрибковую терапию персистирующей бронхиальной астмы.
Выводы. В результате исследования было выявлена эффективность и безопасность антимикотической терапии у коморбидных пациентов с онихомикозом стоп и бронхиальной астмой. В нашем исследовании впервые были выявлены и изучены «клинические предикторы» прироста респираторных параметров, отражающих тяжесть течения бронхиальной астмы у данной категории коморбидных пациентов с клинически значимой микогенной сенсибилизацией.
