Согласно современным представлениям остеоартроз (ОА) является результатом действия механических и биологических факторов, которые нарушают синхронные процессы биодеградации и образования клеток суставного хряща, а также субхондральной кости. Заболевание поражает все ткани синовиальных суставов. Клинически ОА проявляется артралгиями, болезненностью и ограниченностью движений, крепитациями, периодическим появлением выпота в суставной полости, воспалительным процессом разной степени выраженности без системных проявлений [11].
В последние годы значительно расширились знания о патогенезе ОА. Выделен ряд генов, отвечающих за «предрасположенность» к его развитию: COL2A1 – ген коллагена второго типа, гены интерлейкина (ИЛ)-1-β и ИЛ-1, VDR – ген рецептора витамина D. В результате чрезмерной нагрузки, прямого или косвенного повреждения суставных структур (гиалинового хряща, субхондральной кости, связочного аппарата), запускается механизм репарации, в результате которого в ряде случаев суставными тканями в избыточном количестве синтезируются цитокины, протеазы и другие активные вещества, необходимые для разрушения поврежденного хряща. Нарушения в каскаде саморегулирующихся реакций приводят к персистирующему воспалению в суставе. Вторичный воспалительный процесс способствует дальнейшему прогрессирующему разрушению сустава и в первую очередь – суставного хряща. Главная опасность синовита при ОА состоит в его деструктивном влиянии на хрящ за счет действия протеолитических ферментов на фоне активации фагоцитарных, воспалительных, иммунных и ферментоклеточных реакций, которые усиливают катаболические процессы в структурах сустава [7].
Продукты деградации хряща могут выполнять роль аутоантигенов, стимулирующих локальные воспалительные реакции, приводящие к разрушению не только гиалинового хряща, но и субхондральной кости.
Остеоартроз - наиболее распространенная патология суставов. Заболеваемость им растет по мере старения населения. Считается, что в значительной степени это связано с эпидемией ожирения населения индустриально развитых стран. В связи с этим актуальными представляются исследования о роли веществ, продуцируемых жировой тканью в прогрессировании ОА, инсулинорезистентности, кардиоваскулярных и аутоиммунных воспалительных заболеваний. Эта группа веществ получила название адипокинов. К ним относят адипонектин, лептин, резистин, висфатин. Последние исследования продемонстрировали наличие у адипонектина противовоспалительных свойств. Его нормальный уровень в полости сустава способствует большей устойчивости гиалинового хряща к нагрузкам [6].
Лептин, влияя на активность Т-клеток, играет важную роль в патогенезе ряда воспалительных ревматических заболеваний и ОА [3]. Резистин является связующим звеном между иммунными и воспалительными процессами, обладает провоспалительными свойствами [2].
Неизученной в патогенезе ОА остается роль висфатина. Висфатин был выделен в 2004 году группой японских ученых как гормон, продуцируемый преимущественно висцеральной жировой тканью и обладающий инсулиномиметическими свойствами [13]. Позже было доказано, что он идентичен цитокину, известному, как фактор роста пре-В клеток. Висфатин синтезируется не только в клетках жировой ткани, но и в лимфоцитах, клетках печени, мышечной ткани. Не исключено, что синтез висфатина может осуществляться не только в адипоцитах, но и в макрофагах, инфильтрирующих жировую ткань и индуцирующих вялотекущий воспалительный процесс [13].
В настоящее время нет единого представления о роли висфатина в патогенезе заболеваний суставов, но данные последних исследований позволяют предположить вовлеченность этого адипокина в индукцию и поддержание воспалительного процесса при ОА.
Целью нашего исследования было повышение качества диагностики, уточнение отдельных звеньев патогенеза ОА путем исследования концентрации висфатина сыворотки крови.
Материалы и методы исследования. Под нашим наблюдением находилось 80 пациентов с различными формами ОА в возрасте от 36 до 78 лет, из которых было 52 (65%) женщины (средний возраст составил 54,07±1,16 лет) и 28 (35%) мужчин (средний возраст - 58,71±2,02 года), и был сопоставим с группой здоровых лиц (t=1,87 р>0,05). Контрольная группа состояла из 25 женщин и 20 мужчин в возрасте от 30 до 68 лет без клинических проявлений ОА. Для постановки диагноза ОА использовались диагностические критерии Беневоленской Л.И. с соавторами [4], критерии диагноза по Althman R.D. [5].
Наличие синовита оценивалось по клиническим критериям, разработанным в НИИР РАМН: боль в покое и при движении, изменение ритма болей, болезненность при пальпации в проекции суставной щели, местное повышение температуры кожи над пораженным суставом, дефигурация, появление или нарастание утренней скованности в суставе, а так же данных ультразвукового исследования суставов. Ренгенологическая стадия ОА устанавливалась по Kellgren-Lawrense [5]. Уровень висфатина в сыворотке крови определялся непрямым твердофазным иммуноферментным методом с использованием коммерческих тест систем (RaiBiotech, cat № EIA-VIS-1). Исследование уровня С-реактивного белка (СРБ) в сыворотке крови проводилось с помощью наборов ООО «Хема-Медика» (Санкт-Петербург).
Результаты исследования и их обсуждение. Средний уровень висфатина в сыворотке крови у здоровых лиц составил 2,30±0,21 нг/мл (М±м). Уровень нормальных значений висфатина у здоровых лиц, определяемый как М ± 2σ, составил от 0 до 5,24 нг/мл. Высокий уровень висфатина (выше 5,24 нг/мл) был обнаружен в сыворотке крови у 23 пациентов (29%) из 80 больных ОА. Для выяснения клинико-патогенетического значения определения уровня висфатина у пациентов с ОА, мы разделили больных на две группы, в каждой из которых изучались клинические проявления ОА. Первая группа (n = 23) – пациенты с повышенным уровнем висфатина (более 5,24 нг/мл), вторая (n = 57) – с показателями соответствующими границе нормы (менее 5,24 нг/мл). Результаты представлены в табл. 1, 2.
Таблица 1. Клинические проявления ОА в зависимости от уровня висфатина в сыворотке крови
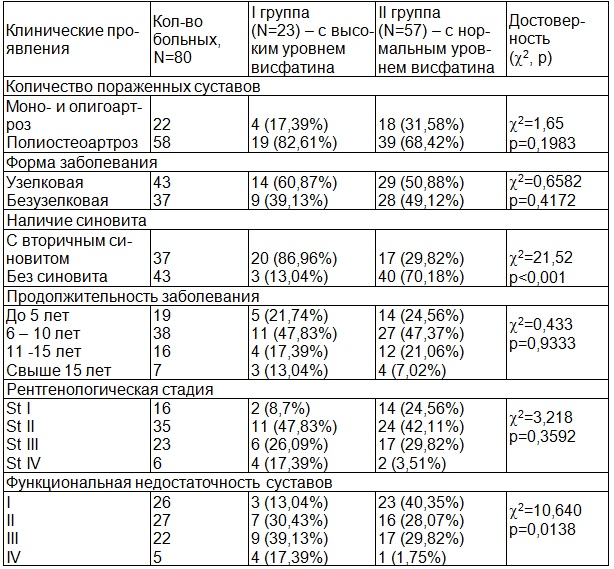
Таблица 2. Лабораторные показатели у больных с ОА в зависимости от уровня висфатина в сыворотке крови

Таблица 3. Функциональные индексы у больных с ОА в зависимости от уровня висфатина в сыворотке крови
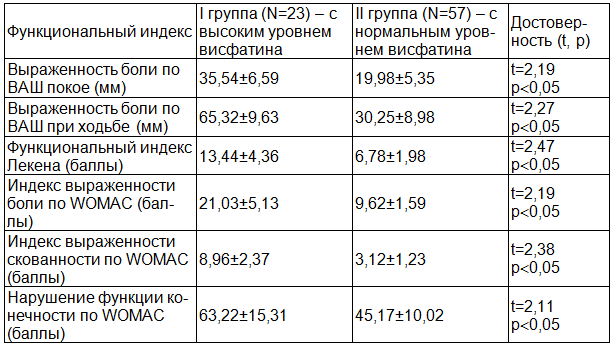
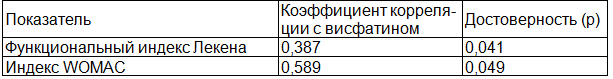
Таблица 4. Корреляционные связи между уровнем висфатина и функциональными индексами, отражающими выраженность суставного синдрома при ОА
Пациенты с повышенным уровнем висфатина чаще имели вторичный синовит. У этих же больных в сыворотке крови отмечались более высокие показатели СОЭ и СРБ (табл. 2). При изучении характера болевого синдрома пациенты с жалобами на постоянные боли достоверно чаще имели повышенный уровень висфатина в отличие от больных, испытывающих боли в суставах только при нагрузке (табл. 3).
Полученные результаты можно объяснить следующим образом. В последнее время в литературе появились сведения о том, что под воздействием висфатина повышается выработка ИЛ-1 β, фактора некроза опухоли (ФНО)-α, и особенно ИЛ-6 в человеческой культуре хондроцитов [14]. Рекомбинантный висфатин увеличивает поверхностную экспрессию молекул CD54, CD40, CD80 висфатинстимулированных моноцитов, имеющих ведущее значение в инициировании или поддержании активности воспалительного процесса. В естественных условиях висфатин индуцирует выработку циркулирующего ИЛ-6 у мышей [16]. В хондроцитах, обработанных висфатином, увеличивается содержание уровня металлопротеиназ (ММР) ММР-3, ММР-13 и снижается количество аггрекана (протеогликана) [14].
Данные исследования говорят о влиянии висфатина на выработку цитокинов, ответственных за поддержание воспалительного процесса в синовиальной оболочке и, как следствие, разрушение хрящевой ткани. При исследовании инфрапателлярной жировой ткани пациентов с ОА было обнаружено высокое содержание висфатина [15]. При лечении пациентов с избыточными жировыми отложениями в области коленных суставов врач часто сталкивается с определёнными трудностями долгосрочного купирования болевого синдрома при отсутствии явных признаков воспаления. Возможно, данный феномен связан не только с нарушениями микроциркуляции в периартикулярных тканях за счет локального лимфостаза, но и с выработкой большого количества цитокинов непосредственно в зоне сустава.
Изучение патогенетических механизмов ОА в последние годы мало повлияло на результаты лечения ОА. Денегеративные заболевания суставов устойчиво сохраняют свои позиции среди причин временной и стойкой потери трудоспособности в обществе [8]. Изучение иммунных механизмов прогрессирования ОА позволяет надеяться на выявление новых звеньев патогенеза и в перспективе способствовать разработке новых методов терапии. В последние годы все чаще ведется речь о таргетной терапии ОА, связанной с воздействием на ключевые молекулы, принимающие участие в патогенезе этого заболевания и, прежде всего, на конкретные энзимы и цитокины [1].
В эксперименте ингибирование висфатина эффективно снижает активность коллаген-индуцированного артрита у мышей [10], не приводя к каким-либо серьезным побочным эффектам со стороны органов и систем. Значительные успехи молекулярной биологии позволяют надеяться на разработку высокоэффективных препаратов, способных задержать прогрессирование остеоартроза и изменить его течение [1]. В настоящее время биологические препараты широко используются в терапии онкологических заболеваний, ревматоидного артрита, анкилозирующего спондилита, болезни Крона и ряда других. Проводимые исследования по изучению влияния висфатина на процессы разрушения хряща при ОА позволяют надеяться на открытие новых лекарственных средств, имеющих в качестве точки приложения адипокины, для эффективного лечения ОА.
Таким образом, в результате нашего исследования повышенный уровень висфатина был выявлен у 29% больных ОА. Его повышение ассоциируется с вторичным синовитом, повышенными показателями СОЭ, СРБ и большей выраженностью суставного синдрома. Полученные данные говорят о вероятной роли висфатина в патогенезе ОА. Изучение роли висфатина в патогенезе ОА может создать теоретические предпосылки создания новых эффективных препаратов для лечения ОА.
