Введение. Ревматоидный артрит (РА) - аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов [1]. Распространенность РА составляет около 0,7%. Ежегодная заболеваемость - приблизительно 0,02% населения. Частота поражения почек при РА по данным различных авторов колеблется от 35 до 73% [2,3], а лекарственное воздействие вносит основной вклад в его структуру. С изменением терапии РА меняется и характер патологии. Наблюдается тенденция по снижению мембранозной нефропатии при РА в следствии редкого использования пенициламиа и солей золота в настоящее время. С внедрением биологической терапии в широкую клиническую практику увеличилось число сообщений о развитии гломерулонефритов с быстропрогрессирующим течением. [4-9].
Неоднозначное отношение к болезньмодифицирующим препаратам при РА. По данным некоторых авторов выраженные побочные эффекты со стороны почек зарегистрированы у циклоспорина, солей золота и Д-пенициламина, в то время как метотрексат, азатиоприн, противомолярийные препараты, сульфасалазин, лефлуномид, этанерсепт и инфликсимаб не обладали значимой нефротоксичностью [10.].
Безусловно, наибольшее количество исследований, посвященных развитию лекарственной нефропатии накоплен в отношении нестероидных противовоспалительных препаратов (НПВП), от применения которых в ближайшем будущем вряд ли удастся отказаться. К фармакодинамическим особенностям НПВП, влияющим на токсичность, прежде всего, относится их селективность. Считается, что изоформа циклооксигеназы-1 (ЦОГ1), являясь «конститутивным» ферментом, регулирует физиологические эффекты простагландинов. Напротив, увеличение циклооксигеназы-2 (ЦОГ2) в тканях происходит при воспалительных процессах. Все это послужило основой для создания новой генерации НПВП – селективных ингибиторов ЦОГ2, обладающих всеми положительными сторонами неселективных НПВП, но меньшей токсичностью. Однако в дальнейшем было показано, что ЦОГ2 постоянно синтезируется в различных отделах нефрона, и его метаболиты играют существенную роль в функционировании, как клубочка, так и канальцевого аппарата почки [11,12], а основной причиной нефротоксичности является снижение простагландинов (ПГ), которые синтезируется обеими изоформами ЦОГ [11,12].
Так в эксперементах на животных и исследованиях на здоровых добровольцах показано, что в условиях сниженного потребления натрия ингибиторы ЦОГ2 повышают артериальное давление, снижают почечный кровоток и скорость клубочковой фильтрации [13,14].
Для оценки риска развития острой почечной недостаточности (ОПН) у пожилых пациентов в зависимости от селективности НПВП были проанализированы данные крупномаштабных фармакоэпидемиологических исследований (включивших 183 446 пациентов). Ученые сделали вывод, что наибольший риск развития ОПН у пожилых больных связан с индометацином, ибупрофеном и рофекоксибом [15].
К фармакокинетическим особенностям влияющим на токсичность НПВП относится и период их полувыведения (Т1/2). В зависимости от Т1/2 все НПВП делятся на «короткоживущие» с Т1/2<6 ч. и «длительноживущие» с Т1/2>6 ч. Так у препаратов с коротким Т1/2 (ибупрофен, диклофенак) отмечается лучшая переносимость, чем у длительноживущих НПВП (индометацин, пироксикам, напроксен) [16]. Таким образом, имеющиеся данные о влиянии селективности и Т1/2 НПВП на нефротоксичность (особенно хроническую) являются неоднозначными и требуют дальнейшего изучения.
Целью настоящего исследования была оценка выраженности канальцевого поражения почек у больных РА, в зависимости от особенностей используемых НПВП.
Материалы и методы. В исследование были включены 80 пациентов с верифицированным диагнозом РА, согласно критериям американской ревматологической ассоциации (АРА, 2010) [18], проходившие лечение в ревматологическом отделении ГБУЗ Ярославской области «Областная клиническая больница». Из исследования были исключены пациенты, имеющие сопутствующие заболевания почек, артериальную гипертензию II-III степени, сахарный диабет (СД), а также другие состояния, сопровождающиеся развитием вторичных нефропатий. Пациенты заполняли специально разработанную анкету, содержащую вопросы, которые позволили изучить лекарственный анамнез. Анкета включала анамнестические данные об употреблении НПВП (вид препарата, кратность и продолжительность приема), а также сведения о приеме других лекарственных веществ (антибиотики, рентгеноконтрастные препараты).
Проводилось стандартное общеклиническое исследование, принятое в нефрологической практике, включавшее анамнез, физикальное обследование, клинический анализ крови, мочи, суточную протеинурию. По показаниям было проведено ультразвуковое исследование почек и дуплексное исследование почечных сосудов. Функция почек оценивалась по показателям удельного веса мочи (УВ) по пробе Зимницкого. Гипостенурию фиксировали если максимальное значение УВ не превышало 1020, изостенурию если разница между максимальным и минимальным значением не превышала 10. Скорость клубочковой фильтрации регистрировали по формуле MDRD (Modification of Diet in Renal Disease Study).
Рентгенологическая стадия заболевания определялась по Steinbrocker. Для оценки активности использовался индекс DAS 28.
В качестве маркеров субклинического поражения почек (СПП) фиксировали микроальбуминурию (МАУ), альфа-1-микроглобулин (альфа-1-МГ) и ферментурию (ФУ).
Оценка мочевой экскреции альбумина определялась полуколичественным способом с помощью диагностических полосок Micral Test фирмы Roche.
Количественная оценка экскреции альфа-1-МГ проводилась иммунотурбидиметрическим методом на полуавтоматическом биохимическом анализаторе Clima 15 MC c использованием реактивов фирмы «Диакон - ДС». Результат пересчитывался на мкмоль креатнина мочи.
Активность цитоплазматического фермента аланинаминотрансферазаы (АЛТ) и фермента щеточной каемки тубулоэпителия - щелочной фосфотазы (ЩФ) определялась в утренней порции мочи, собранной с 6 до 9 часов, кинетическим методом. Для удаления низкомолекулярных ингибиторов исследуемых ферментов из мочи, образцы подвергались диализу. Активность ферментов выражали в нмоль/с.л. которая была отнесена к 1 ммоль креатинина мочи (мМ.кр).
Ревматоидный фактор (IgM РФ) определялся с помощью непрямого твердофазного иммуноферментного анализа (Elisa), С-реактивный белок (СРБ) в сыворотке крови - методом латекс агглютинации полуколичественным способом (Ольвекс Диагностикс). Для циркулирующих иммунных комплексов (ЦИК) использовалась методика осаждения полиэтиленгликолем.
Контрольную группу составили 20 практически здоровых людей, репрезентативных по возрасту и полу.
Статистический анализ полученных данных проводился с помощью программы STATISTICA версия 6.0. Анализ соответствия вида распределения признака закону нормального распределения проводился с использованием критериев Колмогорова-Смирнова и Шапиро-Уилка. Для описания нормально распределенных количественных признаков было использовано среднее значение признака и среднеквадратичное отклонение. Для описания признаков, распределение которых отличалось от нормального указаны медиана, нижний и верхний квартили. Сравнение нескольких независимых групп по количественному признаку отличному от нормального распределения проводилось непараметрическим методом Краскела-Уоллиса, а при установлении различий между группами - дальнейшее попарное сравнение с использованием теста Манна-Уитни.
Корреляционный анализ проводился с помощью метода Спирмена. Сравнения относительных частот в двух группах проведено при анализе различий между двумя пропорциями. Различия и взаимосвязи между признаками считали достоверными при p<0,05.
Результаты. Лекарственную терапию получали все 80 больных РА. Базисные препараты принимали 82,5% (66/80), в подавляющем большинстве случаев-метотрексат (63/80 человек). Трое пациентов в качестве базисной терапиии использовали лефлуномид (по 10 мг/сут), а глюкокортикостероиды (ГКС) 51,25% (41/80) обследованных основной группы. Гидроксихлорохин получали 8,75% (7/80).
За весь период болезни в постоянном приеме НПВП (не менее 5 раз в неделю) нуждались 87,5% (70/80) из них 63,8% (51/80) в одном из следующих препаратов – ацеклофенак 6/80, диклофенак 27/80, кетопрофен 4/80, нимесулид 8/80, мелоксикам 5/80, ибупрофен 1/80. Необходимость приема двух препаратов была зафиксирована у 23,7% (19/80) из них диклофенка и ацеклофенака - 2/80, ацеклофенака и целекоксиба 1/80, ацеклофенака и нимесулида 1/80, диклофенака и пироксикама 1/80, диклофенака и мовалиса-3/80, диклофенак и индометоцина 2/80, диклофенака и анальгина 2/80, диклофенака и нимисулида 4/80, диклофенака и кетопрофена 1/80, ацеклофенака и ибупрофена 1/80, диклофенака и ибупрофена 1/80. Пациенты с РА не получавшие постоянно НПВП или получавшие их эпизодически (менее 2-х раз в неделю) составили 12,5% (10/80). Дополнительно два раза в год, курсами, внутримышечно 5/80 получали диклофенак, 2/80 мелоксикам, 2/80 - кетопрофен.
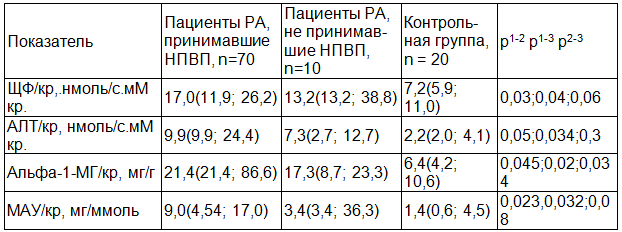
При оценке маркеров субклинического поражения почек в двух группах сравнения (получавших и не получавших НПВП), получены статистически достоверные различия у всех. Отмечено, что более высокие цифры маркеров зарегистрированы в группе получавших НПВП (табл. 1). Необходимо отметить, что показатели обеих групп были достоверно выше по сравнению с контрольной группой по альфа-1-микроглобулину. Это можно трактовать, как признаки почечного поражения при РА.
Таблица 1. Показатели маркеров СПП в зависимости от приема НПВП
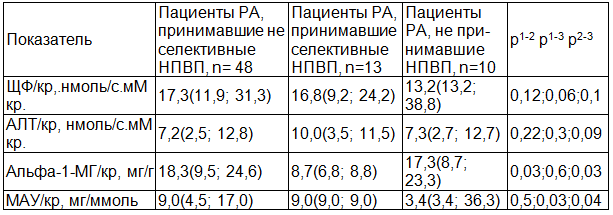
Неселективные блокаторы ЦОГ2 (диклофенак, ацеклофенак, ибупрофен, кетопрофен, пироксикам, анальгин) получали 68,6% (48/70) пациентов. Селективные блокаторы ЦОГ2 (мелоксикам, нимесулид, целекоксиб) принимали 18,6% (13/70). Комбинации препаратов с различной селективностью в отношении ЦОГ2 использовались у 12,9% (9/70). Последнии были исключены из статистического анализа.
При оценке маркеров почечного повреждения в группах получавших селективные блокаторы ЦОГ2 в сравнении с пациентами не принимавшими НПВП были получены следующие результаты: отмечалось достоверное (р=0,03) повышение величины микроальбуминурии у больных принимавших НПВП по сравнению с пациентами не принимавшими НПВП вне зависимости от их селективности. Вероятно, это отражает нефротоксическое действие НПВП на гломерулярный аппарат почек и селективность не играет существенной роли в данном повреждении. Так же отмечается достоверное снижение альфа-1-МГ/кр у пациентов принимавших селективные ЦОГ2 по сравнению с неселективными блокаторами ЦОГ2. Этот результат, вероятно, отражает более «щадящее» действие селективных ЦОГ2 на эпителий канальцев почек (табл. 2).
Таблица 2. Сравнение групп пациентов по маркерам СПП в зависимости от селективности принимаемых НПВП
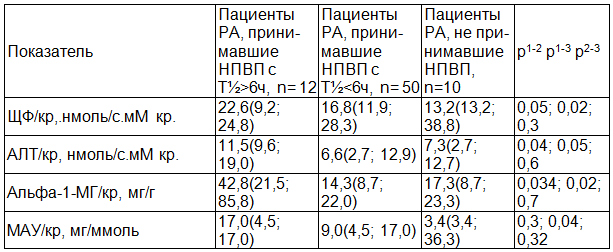
При анализе НПВП с периодом полувыведения более 6 часов (мелоксикам, ацеклофенак, пироксикам, целекоксиб) 17,1% (12/70) и менее 6 часов (индометацин, анальгин, диклофенак, кетопрофен, нимесулид, ибупрофен) 71,4% (50/70) были получены следующие результаты (табл. 3.) Отмечено достоверное повышение маркеров канальцевого повреждения (АЛТ/кр., Альфа-1-МГ/кр.) в группе больных принимавших НПВП с периодом полувыведения более 6 часов по сравнению с приемом НПВП менее 6 часов. При оценке микроальбуминурии так же не получено достоверных различий между группами в зависимости от длительности полувыведения препарата (табл. 3).
Таблица 3. Сравнение групп пациентов по маркерам СПП в зависимости от периода полувыведения принимаемых НПВП
При анализе поражения почек в зависимости от длительности приема была отмечена следующая закономерность (табл. 4).
Таблица 4. Показатели ферментурии в зависимости от длительности приема НПВС
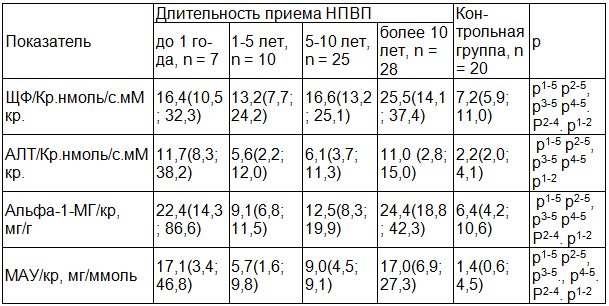
Примечание: значение р указано, если разница между группами достигала уровня статистической достоверности (р<0,05) р1-2 - при сравнении показателей групп до 1 года и 1-5 лет, р1-3 – до1 года и 5-10 лет , р1-4 до 1года и более 10 лет, р1-5 до 1года и группы контроля, р2-3 – групп 1-5 лет и 5-10 лет , р2-4 5-10 лет и более 10 лет, р2-5- 1-5 лет и группы контроля, р3-4 5-10 лет и более 10 лет, р3-5-5-10 лет и группы контроля, р4-5- более 10 лет и группы контроля.
Во первых, необходимо отметить, что уровни всех маркеров СПП в каждом временном интервале достоверно отличались от аналогичных показателей в группе контроля.
Во вторых, в динамике всех маркеров СПП в зависимости от длительности приема НПВП наблюдались два пика активности. Все показатели в группе до 1 года были статистически больше чем в группах 1-5 и 5-10 лет, достигая уровня группы с наибольшей длительностью приема (более 10 лет). Данную закономерность (наличие двух пиков активности маркеров СПП), вероятно, можно объяснить, если учесть, что наибольшая потребность в НПВП приходится именно на первый год, когда базисная терапия еще не начата или не подобрана. Второй пик повышения маркеров СПП наблюдался в группе более 10 лет, что, вероятно, можно связать с кумуляцией нефротоксических эффектов от приема НПВП. В остальном необходимо отметить отчетливую тенденцию всех маркеров СПП к увеличению в зависимости от длительности приема НПВП с максимумом в группе более 10 лет. При проведении корреляционного анализа положительную взаимосвязь имела только пара ЩФ/кр,.нмоль/с.мМ кр. & длительность приема НПВП, г., rs= 0,23, p=0,034.
Данный статистичекий факт опять же объясняется не линейной зависимостью активности маркеров СПП от времени приема препаратов.
Выводы
- Прием НПВП при РА влияет как на гломерулярные, так и на тубулоинтерстициальные структуры почек.
- Селективные блокаторы ЦОГ2 оказывают более «щадящее» действие на эпителий канальцев, по сравнению с неселективными ЦОГ2.
- НПВП с периодом полувыведения более 6 часов «агрессивнее» воздействуют на эпителий почечных канальцев, по сравнению с НПВП более короткого действия.
- Показана зависимость всех показателей от длительности приема препаратов, которая имела два пика подъема уровней СПП в группах до 1 года и более 10 лет.
Данные факты подтверждают общепринятую точку зрения о нефротоксичности этих препаратов. Учитывая это, определение маркеров СПП может быть использовано в качестве ранних признаков нефротоксичности НПВП.
