Введение. Мышечная дистрофия Дюшенна (МДД) - Х-сцепленное нервно-мышечное заболевание, характеризующееся нарушением выработки белка дистрофина [1], приводящего к прогрессирующей слабости и атрофии мышц с преимущественным поражением тазового пояса и бёдер. [2,3] Одним из первичных звеньев патогенеза при МДД является воспаление мышц [4], в дальнейшем ведущее к их жировой и фиброзной дегенерации. [5].
В настоящий момент существует необходимость в эффективных биомаркёрах, позволяющих оценить тяжесть воспалительных изменений в скелетных мышцах, которые в дальнейшем могут быть использованы в качестве методов оценки эффективности проводимой противовоспалительной терапии.
Одним из таких маркёров может являться магниторезонансная томография (МРТ) с селективным возбуждением сигнала водной Т2. [6,7,8].
Цель работы: определить значения водной Т2 в скелетных мышцах пациентов с мышечной дистрофией Дюшенна, не принимающих глюкокортикостероидную терапию и у здоровых добровольцев.
Материалы и методы: Исследование проводилось на базе Санкт-Петербургского государственного педиатрического медицинского университета. Было обследовано 7 пациентов с генетически подтверждённой мышечной дистрофией Дюшенна, не принимающих глюкокортикостероидную (ГКС) терапию (средний возраст 7,4 ± 0,9 лет). Так же была обследована контрольная группа, которая состояла из 6 здоровых добровольцев мужского пола (средний возраст 11,9 ± 1,7 лет).
Всем испытуемым была проведена МРТ мышц тазового пояса, бёдер и голеней. Перед исследованием, все испытуемые были предупреждены о необходимости избегать повышенных физических нагрузок минимум за 3 дня до проведения МРТ. Исследование проводилось на магниторезонансном томографе Philips Ingenia 1.5T с использованием наружной нательной катушки. Были выполнены Multi-Slice-Multi-Echo (MSME) последовательности со следующими параметрами: Echo Time (TE) = 10-200 ms, Repetition Time (TR) = 3500 ms, flip angle = 90o, refocusing control angle 180o, slices = 7, slice gap = 15 mm, slice thickness = 10 mm. В дальнейшем были рассчитаны значения водной Т2 каждой мышцы на 7 срезах с использованием методики трехэкспоненциального расчёта [9].
Статистический анализ полученных резульатов проводился при помощи программного обеспечения IBM SPSS Statistics v.23. Были рассчитаны средние значения, доверительный интервал и t-критерий Стьюдента при сравнении средних величин (p=0.05).
Результаты. Группа пациентов, не принимающих ГКС терапию характеризовалась повышением интенсивности сигнала водной Т2 во всех скелетных мышцах тазового пояса, средние значения составляли 39,5±1 мс (p=0,05). Интенсивность сигнала в мышцах тазового пояса здоровых добровольцев в среднем составляла 32,6 ± 0,7 мс (p=0,05) (рис. 1).
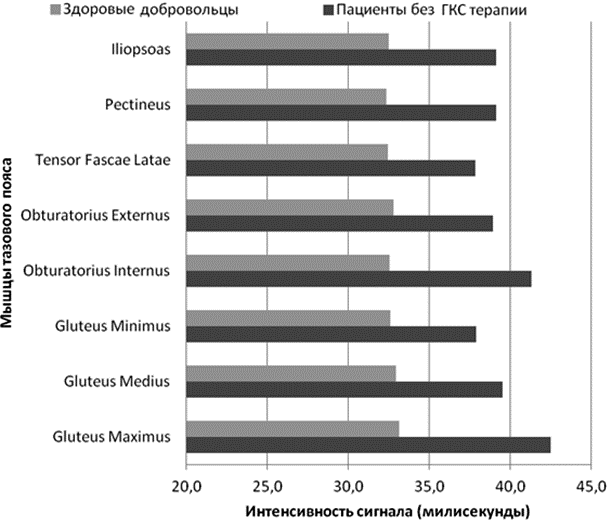
Рис 1. Средние значения водной Т2 (миллисекунды) в скелетных мышцах тазового пояса у пациентов с МДД принимающих, не принимающих ГКС терапию и здоровых добровольцев.
Пациенты, не принимающие ГКС терапию характеризовалась повышением сигнала водной Т2 во всех скелетных мышцах бёдер, средние значения составляли 37,5±1,2 мс (p=0,05). Интенсивность сигнала в мышцах бёдер здоровых добровольцев в среднем составляла 32,8 ± 0,6 мс (p=0,05). (рис. 2)
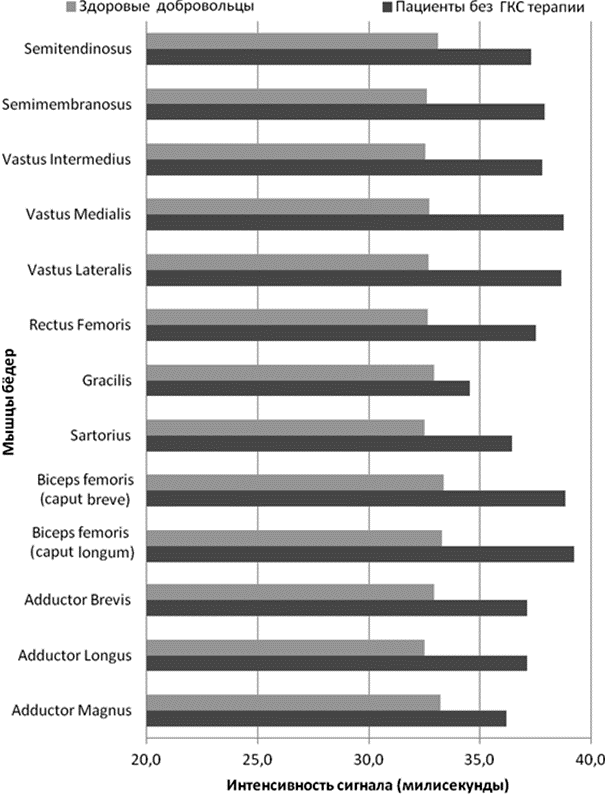
Рис 2. Средние значения водной Т2 (миллисекунды) в скелетных мышцах бёдер у пациентов с МДД, не принимающих ГКС терапию и здоровых добровольцев.
При оценке значений водной Т2 в мышцах голеней группа пациентов, не принимающих ГКС терапию продемонстрировала средние значения 38,3±1 мс (p=0,05). В контрольной группе средние значения водной Т2 составляли 32,5 ±0,6 мс (p=0,05) (рис. 3).
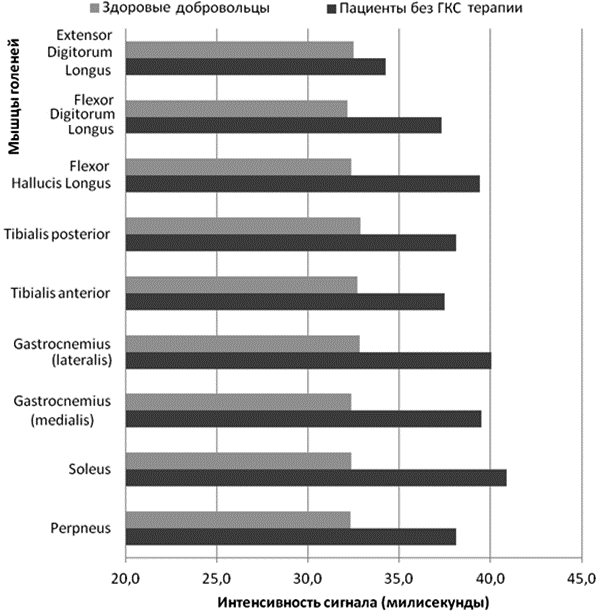
Рис 3. Средние значения водной Т2 (миллисекунды) в скелетных мышцах голеней у пациентов с МДД, не принимающих ГКС терапию и здоровых добровольцев.
Обсуждение. В ходе исследования было выявлено, что группа пациентов с МДД не получавших ГКС терапию, характеризовалась повышенными значениями водной Т2 во всех скелетных мышцах, по сравнению с контрольной группой. Тем не менее, исключение составляли в m. gracilis и m. extensor digitorum longus, в которых была выявлена низкая воспалительная активность, что обусловлено наименьшей вовлечённостью вышеуказанных мышц в патологический процесс при МДД.
Ранее эффективность селективного возбуждения водной Т2 была так же продемонстрирована Mankodi и соавт. при обследовании пациентов с МДД в возрасте 8,9±0,7 лет, получавших ГКС терапию. Проводилось исследование мышц голеней, в ходе чего были выявлены повышенные показатели водной Т2, по сравнению со здоровыми добровольцами (p<0.001). Так же в данном исследовании была продемонстрирована эффективность данной методики при оценке влияния физических нагрузок. [10]
Существуют альтернативные способы оценки воспалительных изменений в скелетных мышцах. Так, Janiczek и соавт. в 2011 г. была предложена методика Iterative Decomposition of water and fat with Echo Asymmetry and Least-squares estimation - Carr-Purcell-Meiboom-Gill (IDEAL-CPMG).. Данная импульсная последовательность основана на определении химического сдвига воды. [11] Однако, в исследовании Mankodi, Bishop и соавт. при обследовании мышц бёдер у пациентов с МДД данная методика позволила выявить повышенную воспалительную активность лишь в m. biceps femoris и m. vastus lateralis (p<0,05). [12] Ещё одним недостатком IDEAL последовательностей является длительное время выполнения исследования [13], что затрудняет применение данной методики у пациентов с МДД, в связи с частым наличием у них поведенческих и когнитивных нарушений [14]
Ещё одним альтернативным методом является 1H-спектроскопия. По литературным данным, была доказана высокая чувствительность данной методики при оценке активности заболевания в скелетных мышцах, а так же при оценке эффективности противовоспалительной терапии при МДД. [15,16,17]. Тем не менее, данный метод имеет своих недостатки. Главным является возможность применения лишь одновоксельной спектроскопии, что позволяет оценивать лишь одну мышцу и значительно ограничивает применение данной методики. МРТ с использованием MSME последовательностей лишено данных недостатков и позволяет оценивать все мышцы одновременно.
Выводы: таким образом, определение значений водной Т2 с помощью трёхэкспоненциальной методики расчёта может служить биомаркёром активности заболевания у пациентов с мышечной дистрофией Дюшенна.
Благодарности. Авторы статьи выражают признательность Институту Миологии (Париж, Франция), сотрудникам отделения экспериментальных визуализационных и клинических исследований Института Миологии и лично профессору Пьеру Карлие (Pierre Carlier) за оказанную методическую помощь в проведении исследования.
