Хирургические инфекции мягких тканей - наиболее частая причина обращения пациентов за хирургической помощью, так в Великобритании она является причиной госпитализации 10% пациентов, в США она является причиной 330000 госпитализаций в год, а в России эта патология наблюдается примерно у 700000 пациентов. Это указывает на то, что диагностика и лечение хирургических инфекций остается одной из актуальных проблем современной хирургии [2-4,6]. Летальность при тяжелых формах хирургических инфекций колеблется в пределах от 28% до 56%, а при сепсисе свыше 90% [2]. Хирургическая инфекция у больных на фоне нейроэндокринных нарушений, в частности сахарного диабета протекает атипично, с достаточно агрессивным течением [1,4].
В настоящее время сахарный диабет рассматривается как аутоиммунное заболевание, характеризующееся нарушением клеточного и гуморального иммунитета. Механизм повреждения связан с иммунологическими нарушениями в организме больного. У трети больных сахарным диабетом выявлена клеточная антипанкреатическая гиперсенсибилизация, нарушение фагоцитарной функции лимфоцитов, снижение число Т-супрессоров и Т-хелперов. Нейтрофильные лейкоциты, фагоцитируя патогены, являются критическим компонентом естественной защиты организма. Нейтропения приводит к тому, что бактериальные и грибковые возбудители, попадая во внутреннюю среду, получают возможность беспрепятственно размножаться, формировать локальный очаг поражений мягких тканей и вызывать быстротекущий сепсис [5,8,10]. В связи с этим в последние годы большое внимание уделялось профилактическому применению препаратов, способных уменьшить продолжительность и выраженность нейтропении. Эти препараты, называемые миелоцитокинами (гранулоцитарный и гранулоцитарно-макрофагальный колоние-стимулирующие факторы (Г-КСФ и ГМ-КСФ), появились в клинической практике в начале 1980-x годов [7,8,11,12]. Настоящая работа посвящена оценке эффективности Г-КСФ (Филграстим) (Нейпоген (Neupogen), производитель F.Hoffmann-La Roche Ltd, Швецария) в комплексной терапии больных острой гнойной хирургической инфекцией мягких тканей на фоне сахарного диабета. В доступной литературе мы не обнаружили сообщений об использовании Г-КСФ (Филграстим) в комплексном лечении гнойной хирургической инфекции мягких тканей на фоне сахарного диабета, поэтому целью нашего исследования стало изучение эффективности применения Г-КСФ (Нейпоген) в комплексной терапии этого патологического состояния.
Материал и методы исследования. В основу работы положен анализ результатов лечения 132 больных с гнойно-некротическими поражениями мягких тканей на фоне сахарного диабета, находившихся на стационарном лечении в Республиканском Центре гнойной хирургии и хирургических осложнений сахарного диабета, за период с 2005 по 2011 г. В зависимости от характера проводимых лечебных мероприятий все пациенты были разделены на 2 группы.
Первая (контрольная) группа, представлена 73 (55,3%) пациентами с гнойно-некротическими заболеваниями мягких тканей, развившимися на фоне сахарного диабета и находившихся на стационарном лечении с 2005 по 2007 г. Находясь на стационарном лечении, данная группа больных получала традиционный комплекс лечебных-диагностических мероприятий.
Во вторую (основную) группу вошли 59 (44,7%) больных, находившихся на стационарном лечении за период в 2007-2011 г. По современным представлениям, синдром «взаимного отягощения», встречающийся у больных, страдающих сахарным диабетом и гнойной хирургической инфекцией, обусловлен в основном нарушениями обменных процессов и иммунной защиты. Из факторов иммунитета (гуморального и клеточного) на наш взгляд перспективным является воздействие и усиление клеточного звено иммунитета, а именно клеток, которые способствует усилению фагоцитоза. Изучение результатов лечения гнойно-воспалительных поражений мягких тканей на фоне сахарного диабета указывает на увеличение веса антибактериально резистентной микрофлоры, и в этих случаях непосредственная борьба клеток больного с инфекцией может быть залогом успеха. Использование препаратов, направленных преимущественно на фагоцитарную систему, является наиболее целесообразным, так как:
1) фагоцитоз играет основную роль в элиминации условно-патогенных бактерий, вызывающих послеоперационные инфекционные осложнения;
2) активация фагоцитарных клеток вызывает естественную активацию всех компонентов иммунной системы, в связи с этим, данной группы больных является то, что в комплекс лечебных мероприятий добавлен гранулирующий колониестимулирующий фактор (Г-КСФ) - Нейпоген по 30 млн ЕД*1 мл/сутки в течение 5-7 дней.
Изучение возрастного аспекта больных в обеих группах показало, что доминировали больные пожилого и старческого возраста, так больных в возрасте от 41-60 лет в контрольной группе было 32 (44%), а в основной 28 (39%). У больных в возрасте 61-80 лет, картина была практически идентичной и составляла - в контрольной 36 (49%), а в основной 28 (47%). Среди обследованных было 65 мужчин (49%) и 67 женщин (51%).
Нозологическая характеристика больных показала, что доминировали больные с карбункулами различной локализации, выявленные у 32 (24,2%) больных, причем соотношение их в обеих группах было практически одинаково. На втором месте по частоте встречаемости были флегмоны нижних конечностей - 23 (17,4%), абсцессы и флегмоны туловища у 22 (24,2%), а также флегмона промежности выявление у 20 (15,1%) больных (табл. 1).
Изучение больных по типу выявленного сахарного диабета показало, что у большинства больных был выявлен сахарный диабет II типа (94,7%), при этом сахарный диабет I типа наблюдался только у 7 из 132, что составляет 5,3% (табл. 2).
Таблица 1. Распределение больных по нозологии
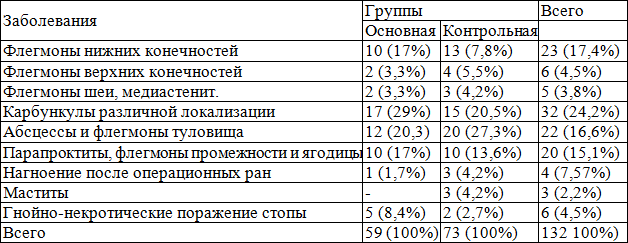
Таблица 2. Распределение больных в зависимости от типа СД
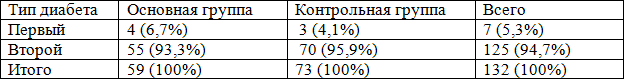
При поступлении, после кратковременной предоперационной подготовки, всем больным проводилось оперативное вмешательство, направленное на вскрытие патологического очага, с проведением адекватной некрэктомии (табл. 3). При этом 59 больным основной группы было выполнено 63 оперативных вмешательств, а в контрольной группе у 73 больных выполнено 87 операции. Это объясняется тем, что в данной группе был высоким удельный вес повторных операций. Анализ проведенных оперативных вмешательств показал на высокий удельный вес вскрытий флегмон с некрэктомией, которая была выполнена у 23 пациентов (36,5%), некрэктомия произведена в 33 (52,3%) случаях, ампутация на уровне стопы в 3 случаях. Ампутации нижних конечностях на уровне бедра и голени произведено у 2 больных (3,2%). В контрольной группе больных в общей сложности выполнено 87 оперативных вмешательств, при этом вскрытие флегмоны с некрэктомией- 44 больных, что составляло 50,6%, а некрэктомии -29 пациентов (33,3%) (табл. 3).
Таблица 3. Характер проведенных оперативных вмешательств
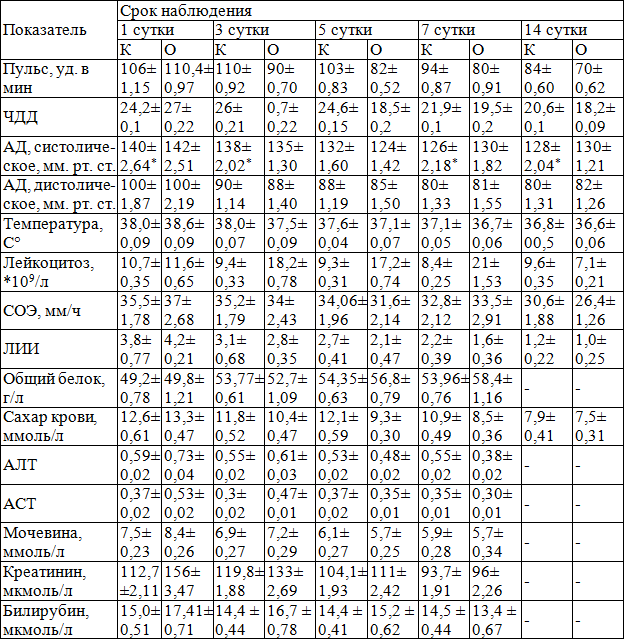
Изучение динамики изменения клинико-биохимических показателей в обеих группах показало, что показатели интоксикации в основной группе на фоне проводимого лечения прогрессивно снижались и уже на 3 сутки лечения были приближены к нормальным значениям кроме лейкоцитов, за счет действия Г-КСФ (нейпоген). Значение лейкоцитарного индекса интоксикации были различными зависимости от выраженности и распространенности раневой инфекции, доходя до 3,8 в контрольной и до 4,2 в основной. При этом, в основной группе больных лейкоцитарный индекс интоксикации постепенно снижался и составлял 1,6±0,36, к 7 суткам наблюдения. Это указывает что на 3-7 день от действия Г-КСФ (нейпоген) костный мозг вырабатывает большой количество зрелых нейтрофилов (табл. 4).
Одним из важных диагностических критериев течения патологического процесса является температурная реакция, которая в 1 сутки была высокой у больных как основной, так и контрольной группы и составляла соответственно 38,6±0,09 и 38,0±0,090С. Данный показатель на фоне проводимого лечения равномерно снижался в обеих группах, однако в контрольной группе к 3 суткам лечения он сохранялся, был на высоких цифрах и составлял 38,0±0,07, что говорит о сохранении воспалительных явлений в области патологического процесса. Лишь на 7 сутки отмечается нормализация температурной реакции, которая сохранялась и остальные соки наблюдения (табл. 4).
Лейкоцитоз крови, при поступлении, в обеих группах был высоким. Так, в основной группе составлял 11,6±0,65*109/л., в контрольной 10,7±0,35*109/л. В динамике на фоне применения Г-КСФ (нейпоген) отмечается нарастание лейкоцитоза, причем в основной группы, данный показатель был выше за счет увеличения зрелых форм, составляя от 18,2±0,78*109/л на 3 сутки лечения, с увеличением данного показателя к 7 суткам до 21±0,78*109/л., при этом к 7 суткам в контрольной группе он сохраняется на уровне 8,4±0,25 *109/л. (табл. 5).
К 14 суткам лечения он был в пределах нормы в обеих группах. По остальным критериям особой разницы не выявлялось.
Таблица 4. Динамика изменений клинико-биохимических показателей у больных основной и контрольной группы (М±m)
Примечание: здесь и далее *р<0,05
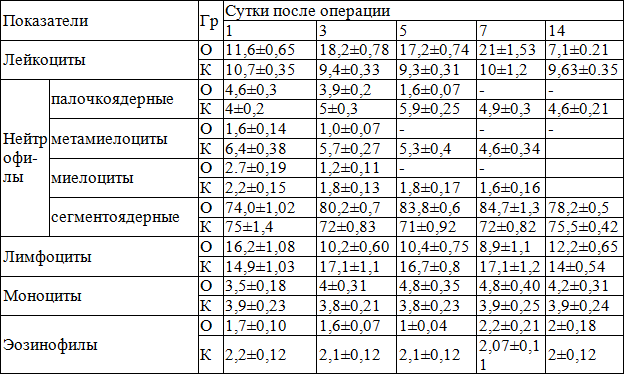
Развернутое изучение периферической крови позволило выявить что, незрелые нейтрофилы в контрольной группы к 1-7 суткам лечения сохраняется на уровне высоких цифрах, составляя от 6,4±0,38% на 1 сутки лечения и доходившая до 4,6±0,34% к 7 суткам лечения, причем в основной группы данный показатель к идентичным срокам составлял 1,6±0,14% и 1,0 ±0,07%, соответственно (табл. 5). В основной группе палочкоядерные нейтрофилы достоверно снижаются, составляя в 1 сутки 4,6±0,3%, с постепенным снижением, до 1,6±0,07%. Такая же картина наблюдалась и с сегментоядерными нейтрофилами. Так в 1 сутки они составляли 74,0±1,02%, с нарастанием в последующие сроки и доходящим до 83,8±0,6% к 5 суткам лечения.
Несколько иначе картина у больных контрольной группы, так содержание палочкоядерных нейтрофилов в 1 сутки лечения составляло 4±0,2%, с постепенным увеличением к 5 суткам до 5,09±0,25%. Сегментоядерные нейтрофилы были в данные сроки на уровне от 75±1,4%, до 71±0,92% соответственно (табл. 5).
Таблица 5. Динамика относительного содержания лейкоцитов у больных исследуемых групп
Сравнительный анализ микробной обсемененности как аэробов, так и анаэробов показало, что их содержание в исследуемых группах было одинаковым. Так, если концентрация аэробов составляла 5,9±0,24lg KOE/ml в контрольной, то в основной она была 6,1±0,43 lg KOE/ ml. При этом, в основной группе на фоне проводимого лечения, их снижение отмечалось уже на 3 сутки и составляло 3,2 ±0,36 lg KOE/ ml.
К 5 суткам лечения уровень аэробов в основной группе составлял 2,1±0,23 lg KOE/ ml, что является показателем концентрации ниже критического уровня, в контрольной он был на уровне 3,4 ±0,21 lg KOE/ ml (рис. 1).
Одним из эффективных критериев динамики течения раневого процесса является наличие системной воспалительной реакции. Нами проведен сравнительный анализ на основе унифицированного подхода с применением критериев, разработанных Чикагской согласительной конференцией, который наглядно показывает результат проводимого лечения в исследуемых группах.
При поступлении тяжесть состояния больных в обеих группах была практически одинаковой, т.е. в контрольной группе 30 (41%) больных было с гнойным очагом на фоне ССВР, а в основной 21 (35,5%), при этом больных с сепсисом в контрольной группе было 19 (26%), а в основной он был выявлен у 15 больных, что составляло (25,4%). Больных с тяжелым сепсисом было практически одинаково 11 (15%) и 9 (15,2%) соответственно, полиорганная недостаточность отмечалась лишь у 2 (3,38%) больных основной группы. Так, на фоне проводимого лечения к 3 суткам отмечалось равномерное снижение тяжести состояния больных, за счет уменьшения доли больных с тяжелых сепсисом и сепсисом и доминированием больных с ССВР. К данному сроку, за счет применения Г-КСФ (Нейпоген) в основной группе доля больных с ССВР составляла 47,3%, а в контрольной 40,2%, а полиорганная недостаточность не регистрирована. К 7 суткам наблюдения у пациентов основной группы явления тяжелого сепсиса отсутствовали, и лишь в 10% случаев регистрировался сепсис, при этом в ране к данному сроку имелась рана с гнойным налетом.
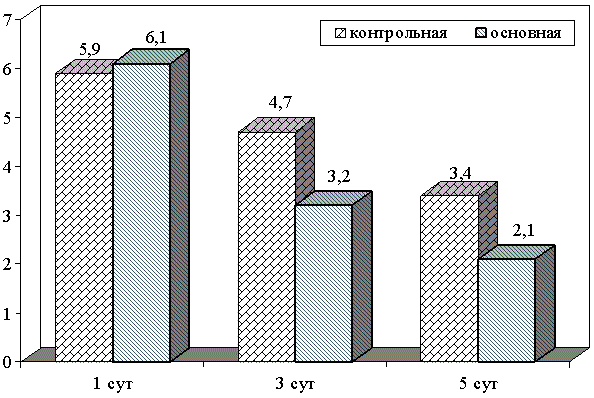
Рис. 1. Динамика изменения микробной обсемененности
В контрольной группе в 1 (1,8%) случаях сохранялись явления септического шока, у 34 (63%) больных имелся ССВР и в 19 (35,2) случаях сепсис, на фоне сохраняющегося вялотекущего гнойного процесса (рис. 2).
Результаты лечения обеих групп показали, что отличные результаты отмечены у 4 больных (6,7%) основной группы и 3 больных (4,1%) в контрольной, хорошие результаты преобладали у больных основной группы, которые отмечены у 50 больных (84,7%), тогда как данный показатель в контрольной группе составлял (74%), т.е. отмечен у пациентов. По удовлетворительным результатам лечения, когда в ране сохранялся гнойный процесс и производились повторные операции, было выявлено, что в контрольной группе он отмечен у 8 пациентов (11%), тогда как в основное группе данный показатель был выявлен у 2 больных (3,38%).
У 3 (5%) больных основной группы наблюдался летальный исход, причем в контрольной группе данный показатель был выше, составляя 9,6% (7 пациентов). Гладкое течение отмечено у 91,5% больных основной группы и 78% больных контрольной группы.

Рис. 2. Динамика изменений септических признаков у больных контрольной и основной группы
Таблица 6. Анализ полученных результатов лечения больных
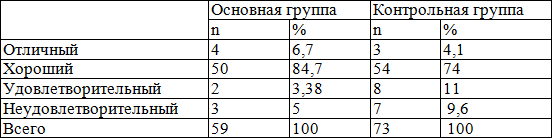
Осложненное течение, когда произведены повторные операции и наблюдались летальные исходы были отмечены у 8,5% больных в основной и у 22% больных контрольной группы.
Таким образом, подводя итоги клинического исследования по применению Г-КСФ (Нейпоген) при широком спектре гнойно-воспалительных поражений мягких тканей на фоне сахарного диабета, можно констатировать его высокую терапевтических эффективность, позволяющая обеспечивать улучшения качества жизни тяжелого контингента больных с хирургическими инфекциями мягких тканей.
Назначение Г-КСФ обязательно в случае комбинации нейтропении с тяжелой бактериальной и грибковой обсемененностью, а также при сепсисе, причем основанием для его применения является наличие документированной инфекции.
