Введение. Эндотелиальная дисфункция на сегодняшний день признается как одна из важных причин прогрессирования облитерирующего атеросклероза артерий нижних конечностей (ОААНК). Поэтому всё чаще в литературе появляются сведения, касающиеся поиска возможных причин развития эндотелиальной дисфункции (ЭД) у больных ОААНК [1, 3, 4]. Одним из направлений поиска является анализ генетического статуса пациентов с атеросклерозом.
Геном, роль которого в развитии эндотелиальной дисфункции признана большинством авторов, является ген эндотелиальной NO-синтазы (eNOS). NO-синтаза 3 типа участвует в синтезе оксида азота (II) (NO) эндотелием. Эффекты NO хорошо известны. В ряде работ подтверждено наличие связи полиморфизма гена NO-синтазы 3 типа с течением и прогрессированием атеросклероза [3, 5, 7].
Как известно, гипергомоцистеинемия приводит к угнетению синтеза окиси азота, вазоконстрикции, формированию липидных бляшек [10, 12]. Рядом авторов показано влияние некоторых вариантов гена, кодирующего фермент метилентетрагидрофолатредуктазу (MTHFR) на развитие эндотелиальной дисфункции и частоту коронарных событий [12].
В публикациях большое внимание уделяется влиянию гена рецептора (тип 1) ангиотензина-2 (AGTR1) [2, 6, 8]. Путем воздействия на этот тип рецепторов реализуется сосудосуживающие действие ангиотензина 2, экспрессия факторов роста и пролиферации гладкомышечных клеток сосудов. Согласно литературным данным, полиморфизм гена AGTR1 A1166C является маркером повышенного риска развития заболевания сосудов [9, 11, 12].
Рядом авторов выявлено, что семейство янус-киназ (JAK) вовлекаются в процессы роста клеток гладкой мускулатуры сосудов, поэтому полиморфизм генов JAK потенциально имеет значение в развитии и прогрессировании атеросклероза [11, 12].
Цель исследования: оценить влияние мутаций по ряду генов на эффективность эндотелиотропной терапии (ЭТ).
Материалы и методы: в рамках гранта Президента РФ № МД-2536.2011.7. проведено обследование пациентов с облитерирующим атеросклерозом артерий нижних конечностей, находившихся на лечении в клинике сосудистой хирургии ГБОУ ВПО РязГМУ Минздравсоцразвития России по определению генотипа по: термолабильному варианту А222F (677С->Т) МТHFR, NOS 3, AGTR1, JAK 2. В исследование включены пациенты, у которых наблюдалась устойчивость к эндотелиотропной терапии, гиперплазия интимы в зоне реконструкции. Генотип больных изучали методом полимеразной цепной реакции с аллель-специфичными праймерами «SNР-экспресс» на базе центральной научно-исследовательской лаборатории ГБОУ ВПО РязГМУ Минздравсоцразвития России.
Материалом для исследования являлась кровь пациентов, забор которой проводили через 1 месяц от начала ЭТ. Показанием для определения генетического статуса пациента являлось неэффективность эндотелиотропной терапии. Критерием эффективности проводимой терапии являлись: концентрация метаболитов оксида азота, тредмил тест, лодыжечно-плечевой индекс (ЛПИ), отсутствие гиперплазии интимы зоны анастомозов после реконструктивных операций.
Результаты и обсуждение. В исследовании 6 пациентов консервативной группы и 6 пациентов операционной группы имели мутации по eNOS.
Установлено, что у пациентов, которые имели мутации по гену NO-синтазы, концентрация метаболитов NO была меньше на 20-25%, чем у нормозигот. У данных пациентов наблюдалось не только сниженная базальная секреция оксида азота (3,45 мкМ - 4,01 мкМ), но и отсутствовала выраженная ответная реакция на стимуляцию секреции NO в виде применения эндотелиотропных препаратов, таких как L–аргинин, небивалол, периндоприл.
У пациентов с мутациями гена кодирующего NO-синтазу отмечалось мультифокальное атеросклеротическое поражение сосудов, склонность к прогрессированию, рестеноз зоны реконструкции после оперативного лечения. Результаты лечения пациентов с мутацией eNOS намного уступают результатам пациентов нормозиготным по указанному гену.
Ген, кодирующий фермент метилентетрагидрофолатредуктазу, влияет на метаболизме фолиевой кислоты, а гипергомоцистеинемия является предиктором развития и прогрессирования атеросклероза [9, 12].
В наших исследованиях мы не наблюдали статистически достоверной связи между наличием мутаций по MTHFR выраженностью течение атеросклероза. Однако у ряда пациентов с гетерозиготностью и мутациями по метилентетрагидрофолатредуктазе отмечалась склонность к прогрессированию атеросклероза, рестенозу зон анастомозов после реконструктивных операций.
Результаты диагностики полиморфизма генов по JAK II выявил, что мутаций по данному гену не встречалось ни в одном случае, у большинства пациентов наблюдалась нормозиготность по данному гену. Гетерозиготность по JAK II может привести к нарушению процесса роста и пролиферации клеток гладкой мускулатуры сосудов [8], что может привести к развитию гиперплазии интимы и рестенозу зоны реконструкции.
Анализ результатов показал, что полиморфизм по AGTR1 не является определяющим в развитии атеросклероза. Однако гетерозиготность по AGTR1 может создать благоприятные условия для прогрессирования атеросклероза, развития гиперплазии интимы за счёт вазоконстрикторного действия ангиотензина 2, пролиферации гладкомышечных клеток сосудов. Особенно это может быть выраженно при сочетании полиморфизма по AGTR1 и JAKII.
Течение ОААНК во время различных методов эндотелиотропной коррекции на фоне мутаций изучаемых генов требуют детального клинического разбора. Приводим клинические наблюдения.
Клинический пример №1. Больной Х., 1946 г.р., поступил в отделение сосудистой хирургии с диагнозом ОААНК, подвздошно-бедренная окклюзия слева, III стадия заболевания. Обследован. ЛПИ 1,0/0,4. При аортоартериографии выявлена окклюзия подвздошных артерий слева (рис. 1).
Больному выполнена операция – аорто-бедренное шунтирование слева протезом «Экофлон» диаметром 8 мм.
После операции пульс на артериях нижних конечностей периферический, кровообращение компенсировано, безболезненно проходимое расстояние более 200м. ЛПИ на обеих нижних конечностях 1,0. Метаболиты NO 4,51 мкМ (N=20-80 мкМ).
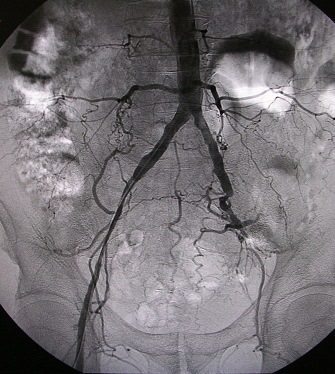
Рис.1.Окклюзия наружной подвздошной артерии слева
Выписан в удовлетворительном состоянии с рекомендациями по приёму L-аргинина 500 мг 2 раза в день в течение 30 дней.
Контрольный визит через 1 месяц: ЛПИ 1,0/1,0, тредмил 205 м., NO 4,35 мкМ, пациенту выполнено плановое УЗДС зоны анастомоза, на котором выявлено утолщение стенок артерии в зоне анастомоза, без гемодинамически значимого стеноза (рис.2).

Рис. 2. Ультразвуковая ангиосканограмма. Зона дистального анастомоза через 1 месяц после операции
Контрольный визит через 3 месяца: ЛПИ 1,0/0,9, тредмил 180 м., NO 4,15 мкМ, пациенту выполнено плановое УЗДС зоны анастомоза, на котором выявлено утолщение стенок артерии в зоне анастомоза, стеноз увеличился по сравнению с предыдущим визитом и соответствует 30-40%.
Контрольный визит через 6 месяцев: ЛПИ 1,0/0,81, тредмил 150 м (боли в левой нижней конечности), NO 4,09 мкМ, пульс периферический ослабленный. Выполнено ультразвуковое исследование дистального анастомоза, на котором выявлена гиперплазия зоны дистального анастомоза (рис. 3).
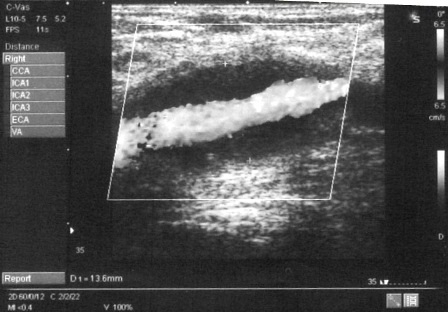
Рис. 3. Ультразвуковая ангиосканограмма. Зона дистального анастомоза через 6 месяца после операции
Через 8 месяцев после операции пациент госпитализирован в отделение с клинической картиной острого тромбоза протеза слева, ишемией напряжения. ЛПИ=1,0/0,2. При периферической ангиографии слева выявлено тромбоз аорто-бедренного протеза слева, с удовлетворительным заполнением бедренных артерий и артерий периферического русла (рис.4).
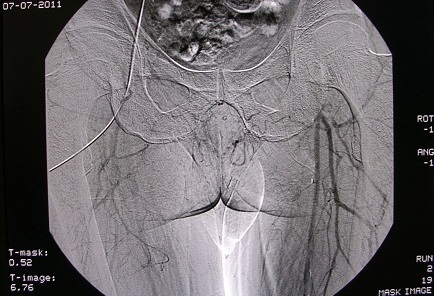
Рис. 4. Тромбоз аорто-бедренного шунта слева, с удовлетворительным заполнением дистального русла
В экстренном порядке выполнена тромбэктомия из протеза с реконструкцией дистального анастомоза. Интраоперационно выявлена гиперплазия интимы дистального анастомоза, окклюзирующая его просвет, что послужило причиной тромбоза протеза (рис.5). Наличие гиперплазированной интимы подтверждено при гистологическом исследовании полученного материала.
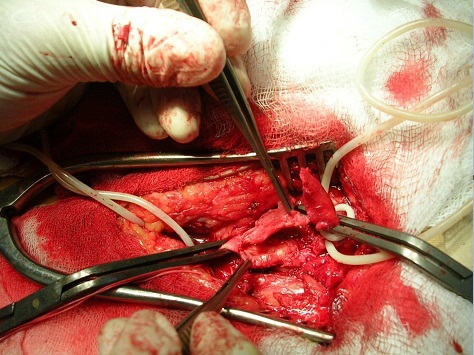
Рис. 5. На пинцете гиперплазированная интима окклюзирующая просвет дистального анастомоза аорто-бедренного протеза слева
После операции кровообращение в конечностях компенсировано, пульс периферический, ЛПИ 1,0/1,0. Проведено определению генотипа по: термолабильному варианту А222F(677С->Т) МТHFR, NOS 3, AGTR1, JAK II. Получены следующие результаты:А222F(677С->Т) – нормозигот, МТHFR – гетерозигот, NOS 3 – мутация, AGTR1– нормозигот, JAK 2– нормозигот.
Мутация гена eNOS и гетерозиготность по MTHFR привели к подавлению базальной секреции NO эндотелием у пациента, что способствовало гиперплазии интимы дистального анастомоза и стало причиной тромбоза протеза. Ответной реакции на эндотелиотропную терапию в виде повышения секреции NO не зарегистрировано в течение всего времени наблюдения.
Выписан из ОСХ РОККД с компенсацией кровообращения, периферическим пульсом с обеих сторон. После проведения второго курса L-аргинина базальная секреция NO не изменилась.
Клинический пример №2. Больной М., 64 лет поступил в клинику сосудистой хирургии с жалобами на появление болевых ощущений в икроножных мышцах обеих нижних конечностей при ходьбе на расстояние не более 120 метров. Диагноз: облитерирующий атеросклероз артерий нижних конечностей. Бедренно-подколенная окклюзия справа, дистальная слева, II б стадия заболевания. При осмотре – отсутствие пульсации на подколенной артерии, берцовых артериях справа, слева – отсутствие пульса на берцовых артериях. Категорический отказ пациента от оперативного вмешательства позволил начать консервативную терапию и в качестве эндотелиотропной терапии назначить L-аргинин. Исходные показатели основных параметров и их изменения на фоне терапии отражены в табл. 1.
Таблица 1. Изменения основных параметров на фоне лечения L-аргинином больного М.
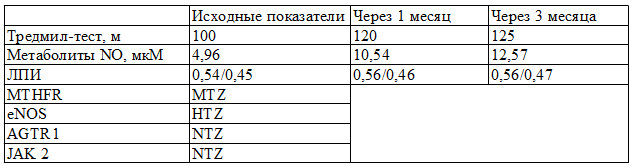
Исходный уровень основных показателей больного М. не отличается от средних показателей пациентов с ОААНК, однако, динамика их изменения не такая выраженная. Генетический статус пациента характеризуется наличием мутации по гену МТHFR, по eNOS - НТZ, что возможно и объясняет сниженную ответную реакцию на приём препарата.
Клинический пример №3. Больной С., 67 лет поступил в клинику сосудистой хирургии с жалобами на боли в икроножных мышцах обеих нижних конечностей при ходьбе на расстояние не более 100 метров. Диагноз: облитерирующий атеросклероз артерий нижних конечностей. Бедренно-подколенная окклюзия с обеих сторон, II б стадия заболевания. Сопутствующая патология: ИБС. Стенокардия напряжения II ФК. Гипертоническая болезнь II стадия, 3степень, риск III. ХСН I, ФК II. С учетом соматической патологии пациенту средством эндотелиотропной терапии назначен небиволол.
Исходные показатели основных параметров и их изменения на фоне терапии отражены в табл. 2.
Таблица 2. Изменения основных параметров на фоне лечения небивололом больного С
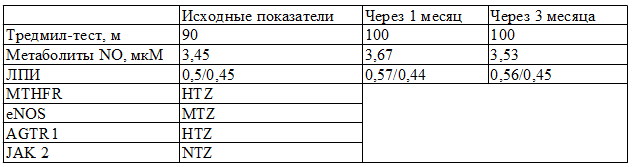
Мутация гена eNOS привела к подавлению базальной секреции NO эндотелием у пациента - 3,45 мкМ. Ответной реакции на эндотелиотропную терапию в виде повышения секреции NO не зарегистрировано в течение всего времени наблюдения. По остальным параметрам исследования сохраняется подобная динамика.
Из представленных клинических наблюдений, очевидно, что данные методы эндотелиотропной терапии, направленные на повышение секреции NO, неэффективны у пациентов с мутацией eNOS. Результаты лечения пациентов с мутацией eNOS намного уступают результатам пациентов – нормозигот. Основным критерием эффективности консервативной терапии у данной категории больных ОААНК является увеличение расстояния, пройденного до появления болевого синдрома, что существенно повышает качество жизни этих пациентов.
Выводы
1. Полиморфизм по ряду генов (eNOS, MTHFR) оказывает существенное влияние на прогрессировании атеросклероза, развитии гиперплазии интимы и рестеноза зоны реконструкции.
2. При наличии мутаций по eNOS существенно снижается эффективность эндотелиотропной терапии.
3. Полиморфизм по MTHFR может привести к неблагоприятному течению атеросклероза.
