Хирургические инфекции мягких тканей являются ведущей патологией в структуре первичной обращаемости хирургических больных в амбулаторно-поликлиническом звене. Лечение гнойно-воспалительных заболеваний в настоящее время остается одной из наиболее часто встречающейся проблем в хирургии. Интерес и постоянное внимание к этой проблеме объясняются тяжелым течением раневого процесса, сохранением тенденции к возрастанию длительно текущих и рецидивирующих форм [2,5,6,8,12]. Актуальность проблемы обусловливается еще и тем, что количество больных с острыми гнойными заболеваниями мягких тканей не уменьшается, а имеет тенденцию к росту, составляя до 35-40% от всего количества хирургических больных. Обширные гнойные раны как вариант проявления хирургической инфекции приводят не только к серьезным нарушениям гомеостаза и функций внутренних органов, но и к генерализации воспалительного процесса, которые являются основной причиной развития летальных исходов у больных хирургического профиля, которая варьирует в пределах от 16 до 80%, в зависимости от развития генерализованных форм и наличия фоновых заболеваний [4,7,14].
Хирургическая инфекция у больных на фоне нейроэндокринных нарушений, в частности сахарного диабета протекает атипично, с достаточно агрессивным течением. Те стандарты свойственные острым инфекциям мягких тканей без сахарного диабета, могут противоречиво влиять на судьбу больных с сопутствующим сахарным диабетом [7-9,11].
Сахарный диабет является самым распространенным эндокринным заболеванием в мире, от которого страдают 4-5% населения планеты и по прогнозам экспертов ВОЗ, число больных сахарным диабетом на нашей планете к 2025 г. может достигнуть 250 миллионов [1,3,7,10,13]. Изучение показателей распространенности сахарного диабета по регионам Узбекистана по данным НПЦЭ показало, что на 100000 населения Республики у 986 отмечается развитие сахарного диабета. Разумеется, истинное распространение заболевания в несколько раз выше, чем число зарегистрированных больных сахарным диабетом [1,3]. Гнойно-некротические заболевания при сахарном диабете сопровождаются выраженной эндогенной интоксикацией и атипичным течением. В связи с этим лечение хирургических инфекций, возникающих или протекающих на фоне сахарного диабета, является сложной и кропотливой задачей. Когда такое сочетание образуют «порочный круг»: инфекция отрицательно влияет на все обменные процессы, а это ухудшает течение процесса в местном инфекционном очаге, приводя к развитию генерализованных форм [7,9,14,15], т.е, проблема гнойной хирургической инфекции на фоне сахарного диабета до настоящего времени остается весьма актуальной, что диктует необходимость постоянного поиска новых методов ее лечения и профилактики. Одним из важных лечебных направлений является коррекция иммунодефицитных состояний, закономерно сопровождающих гнойную инфекцию и отягощающих ее течение.
Настоящая работа посвящена оценке эффективности Г-КСФ (Филграстима) в комплексной терапии больных острой гнойной хирургической инфекцией мягких тканей на фоне сахарного диабета. Известно, что Г-КСФ заметно увеличивает число нейтрофилов в периферической крови уже в пределах первых 24 ч после введения [14-16].
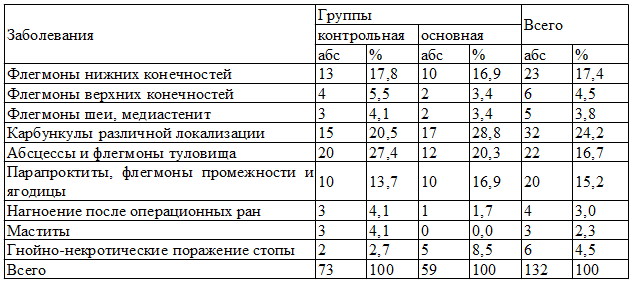
Материалы и методы. В исследование были включены 132 пациентов с острой хирургической инфекцией мягких тканей на фоне сахарного диабета. Больные находились на стационарном лечении в Республиканском Центре гнойной хирургии и хирургических осложнений сахарного диабета, за период с 2005 по 2011 г. В их число входили 32 (24,2 %) пациентов с карбункулами различных локализации, 23 (17,4 %) - с флегмонами нижних конечностей, 22 (16,7 %) - с абсцессами и флегмоны туловище, 20 (15,2 %) с парапроктитами, флегмонами промежности и ягодицы. Удельный вес таких заболеваний как мастит, нагноения послеоперационных ран, флегмоны шеи и гнойно-некротические поражения стоп, встречались реже.
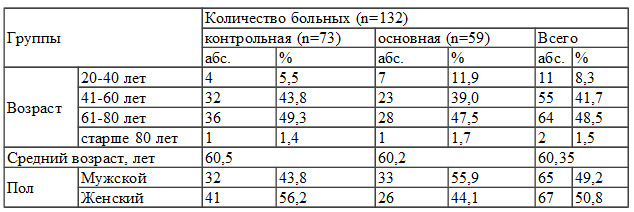
Больные были разделены на 2 группы - основную и контрольную, состав которых был, сопоставим по полу и возрасту больных, нозологическим формам и тяжести заболевания (табл. 1, 2).
Таблица 1. Распределение пациентов в группах по возрасту и полу
Изучение больных согласно типа выявленного сахарного диабета показало, что у большинства больных был сахарный диабет II типа (94,7%), при этом сахарный диабет I типа наблюдался только у 7 из 132, что составляет 5,3%. Больные основной группы (59 человек) получали колониестимулирующий фактор - Г-КСФ подкожно в дозе 5 мг/кг массы тела больного или 30 млн. ЕД (300мкг) в комплексе с традиционным хирургическим и медикаментозным лечением гнойных процессов. Пациенты контрольной группы (73 человек) получали такое же лечение, но без применения Г-КСФ.
Таблица 2. Распределение больных по нозологии
Критериями оценки эффективности лечения служили общие и местные проявления раневого процесса. В динамике оценивали температуру тела, изменения лейкоформулы крови, а местно - гиперемию, отечность, инфильтрацию окружающих рану мягких тканей, количество и характер раневого отделяемого. Определяли качественный и количественный состав раневой бактериальной инфекции. Проводили планиметрию раневых поверхностей, вычисляли индекс «ускорения» очищения и заживления ран - процентное соотношение соответствующих сроков местных изменений в исследуемой и контрольной группах больных.
При поступлении, после кратковременной предоперационной подготовки, всем больным проводилось оперативное вмешательство, направленное на вскрытие патологического очага, с проведением адекватной некрэктомии. При этом 59 больным основной группы было выполнено 63 оперативных вмешательств, а в контрольной группе у 73 больных выполнено 87 операции. Это объясняется тем, что в данной группе был высоким удельный вес повторных операций. Анализ проведенных оперативных вмешательств показал на высокий удельный вес вскрытий флегмон с некрэктомией, которая была выполнена у 23 пациентов (36,5%), некрэктомия произведена в 33 (52,3%) случаях, ампутация на уровне стопы в 3 случаях. Ампутации нижних конечностях на уровне бедра и голени произведено у 2 больных (3,2%). В контрольной группе больных в общей сложности выполнено 87 оперативных вмешательств, при этом вскрытие флегмоны с некрэктомией - 44 больных, что составляло 50,6%, а некрэктомии -29 пациентов (33,3%).
Результаты исследований. Изучение динамики изменения клинико-биохимических показателей в обеих группах показало, что показатели интоксикации в основной группе на фоне проводимого лечения прогрессивно снижались и уже на 3 сутки лечения были приближены к нормальным значениям кроме лейкоцитов, за счет действия Г-КСФ. Так, при одинаково высоких показателях ЛИИ в обеих группах, на 3 сутки в основной группе этот показатель был выше, чем в 1 сутки за счет увеличения зрелых форм нейтрофилов, тогда как в контрольной он сохранялся высоким, составляя 3,1±0,68 за счет сдвига лейкоцитарной формулы «влево». К 14 суткам лечения, в основной группе он был в пределах (через 7-9 сут. после применения Г-КСФ) 1,1±0,21, а в контрольной 1,2±0,7.
Одним из важных диагностических критериев течения патологического процесса является температурная реакция, которая в 1 сутки была высокой у больных как основной, так и контрольной группы и составляла соответственно 38,6±0,09 и 38,0±0,09. Данный показатель на фоне проводимого лечения равномерно снижался в обеих группах, однако в контрольной группе к 3 суткам лечения он сохранялся, был на высоких цифрах и составлял 38,0±0,07, что говорит о сохранении воспалительных явлений в области патологического процесса. Лишь на 7 сутки отмечается нормализация температурной реакции, которая наблюдалось и в 14 сутки (табл. 3, 4).
Лейкоцитоз крови при поступлении в обеих группах был высоким. Так в основной он составлял 11,6?0,65•109/л, а в контрольной 9,7±0,35•109/л. Увеличение лейкоцитоза происходила к 1-7 суткам лечения, причем в основной группе, к этому сроку она была на уровне высоких величин, за счет зрелых форм, составляя от 18,2±0,78•109/л до 21±0,78•109/л., тогда к 7 суткам в контрольной группы она сохранялась на уровне 8,4±0,25•109/л. К 14 суткам лечения он был в пределах нормы в обеих группах. По остальным критериям особой разницы не выявлялось. Значения лейкоцитарного индекса интоксикации были различными в зависимости от выраженности и распространенности раневой инфекции от 3,5 до 4,2 при глубоких гнойных поражениях мягких тканей. Увеличение лейкоцитарного индекса интоксикации, т.е. до 4,2, в основной группе больных происходила в среднем к 7 суткам, в контрольной группе в этот показатель ЛИИ была 3,8. При этом в основной группе больных лейкоцитарный индекс интоксикации постепенно уменьшилось от 4,2±0,21 до 1,2±0,22 в течение 10 суток от начала лечения. Это показывает, что в 3-10 день от действия Г-КСФ костный мозг вырабатывает большой количество зрелых нейтрофилов.
Сравнительный анализ микробной обсемененности как аэробов, так и анаэробов показало, что их содержание в исследуемых группах было одинаковым (рис. 1). Так, если концентрация аэробов составляла 5,9 lg KOE в контрольной, то в основной она была 6,1 lg KOE. При этом, на фоне проводимого лечения, их снижение отмечалось уже на 3 сутки составляя 3,2 lg KOE. К 5 суткам лечения уровень аэробов был 2,1 lg KOE, что является показателем концентрации ниже критического уровня, тогда как в контрольной он составлял 3,4 lg KOE (рис. 1).
Изучение изменений анаэробной микрофлоры показало, что их доля в основной группе была выше в 1 сутки лечения, составляя 5,5 lg KOE, тогда как в контрольной этот показатель был на уровне 5,4 lg KOE. На фоне лечения к 3 суткам основной группы их содержание составляя 2,9 lg KOE, тогда как в контрольной он составлял 4,4 lg KOE (рис. 2).
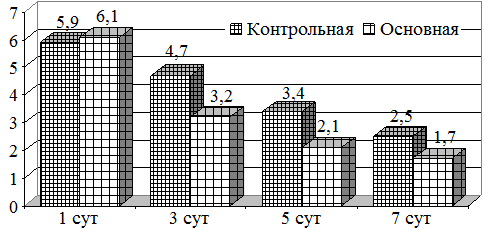
Рис. 1. Динамика изменений микробной обсемененности (аэробов)
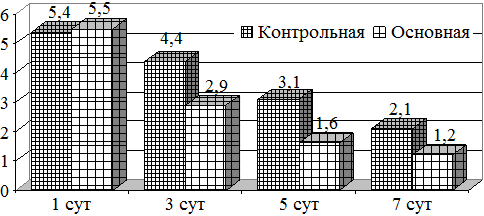
Рис. 2. Динамика изменений микробной обсемененности (анаэробов)
Существенное снижение отмечалось к 7 суткам лечения, так если в контрольной группе к этому сроку она составляла 2,1 lg KOE, то в основной она была 1,2 lg KOE.
Таблица 3. Динамика изменения площади раневой поверхности больных контрольной и основной группы.
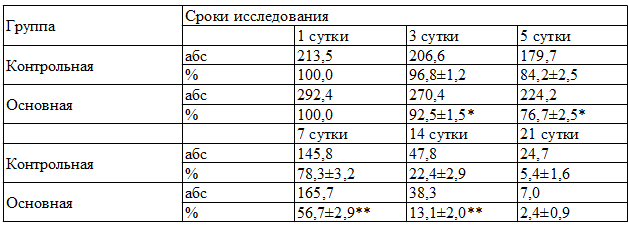
Примечание: * - различия относительно данных контрольной группы значимы (* - P<0,05; ** - P<0,01)
Данные планиметрических исследований показали, что на фоне проводимой терапии, раневые дефекты уменьшались на 3 сутки лечения, в среднем, до 92,5±1,5% в основной и до 96,8±1,2% в контрольной группе (Р<0,05 по сравнению с данными контрольной группы). На 7 сутки раневая поверхность уменьшалась до 56,7±2,9% у пациентов основной группы и до 78,3±3,2% у больных контрольной (Р<0,01 по сравнению с данными контрольной группы)(табл. 3). На 14 сутки после операции раневые поверхности у пациентов контрольной группы в среднем уменьшились 3,5 раза, составив при этом 22,4±2,9%, у пациентов основной группы раневая поверхность уменьшились 4,3 раза, соответствовала 13,1±2,0% (Р<0,01 по сравнению с контрольной группой). На 21 сутки у пациентов, которым не проводилась кожная пластика или наложение вторичных швов площадь раневой поверхности соответствовала 2,4±0,9% в основной и 5,4±1,6% в контрольной группах (табл. 4) (Р>0,05 по сравнению с контролем).
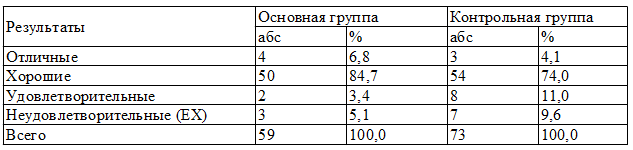
Таблица 4. Результаты лечения больных
При выписке больные контрольной группы находились под диспансерным наблюдением с условиями выполнения рекомендуемых назначений и контрольным обследованием через каждые 3 дня. Сроки амбулаторного лечения составили 26,8±0,3 дня. В основной группе данный показатель был меньше, так среднее пребывание в стационаре составляла 9,3±0,7 дней. Продолжительность амбулаторного лечения составила 18,7±0,6 дня (рис 3.).
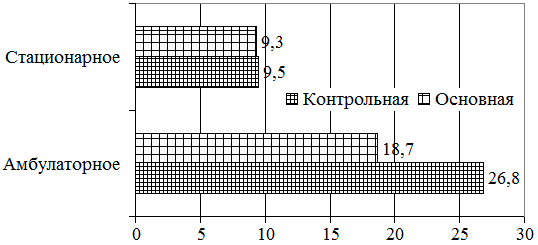
Рис.3.Средняя продолжительность лечения
Результаты лечения обеих групп показали, что отличные результаты отмечены у 4 (6,7%) больных основной группы и 3 (4,1%) больных в контрольной, хорошие результаты преобладали у больных основной группы, которые отмечены у 50 (84,7%) больных, в сравнении с контрольной, где данный показатель отмечен у 54 (74,0%) больных.
По удовлетворительным результатам лечения, когда в ране сохранялся гнойный процесс, произведена повторная операция, в контрольной группе она была выявлена у 8 пациентов (11%), тогда как в основной данный показатель был выявлен у больных (3,38%). Летальные исходыв основной группы наблюдались у 3 больных (5%), а у контрольной группы 7 - больных (9,6%) (табл. 4).
Результаты лечения показали, что гладкое течение отмечено у 91,5% больных основной группы, и 78,1% больных контрольной группы. Осложненное течение, когда произведена повторная операция и есть летальные исходы, отмечено у 8,5% больных основной и 20,5% больных контрольной группы (рис 4).
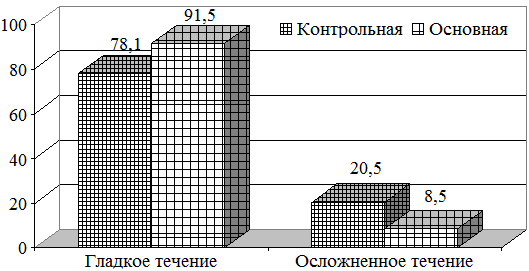
Рис. 4. Результаты лечения больных
Таким образом, подводя итоги клинического исследования по применению Г-КСФ при широком спектре гнойно-воспалительных поражений мягких тканей на фоне сахарного диабета, можно констатировать его высокую терапевтических эффективность, позволяющую обеспечивать улучшение качества жизни тяжелого контингента больных с хирургическими инфекциями мягких тканей. Назначение Г-КСФ обязательно в случае комбинации нейтропении с тяжелой бактериальной и грибковой обсемененностью, а также при сепсисе, причем основанием для его применения является наличие документированной инфекции.
