В последние годы все большее распространение приобретают хирургические вмешательства по поводу двух или более заболеваний не только в хирургии, но и в колопроктологии.
Выполнение сочетанных хирургических вмешательств на дистальном отделе прямой кишки становится общепризнанным методом лечения.
Послеоперационный болевой синдром, как фактор, определяющий физическое и психоэмоциональное состояние больного, а соответственно сроки его выздоровления, изучен недостаточно.
Послеоперационная боль – это боль, которая всегда присутствует, но отличается по интенсивности и продолжительности. Для измерения и оценки боли возможно использование зрительной аналоговой шкалы, различных личностных опросников, больным находящимся в сознании, несмотря на субъективность получаемых результатов [1].
Вопросы изучения послеоперационной боли, ее качественная оценка и измерение остаются до настоящего времени открытыми и дискутабельными. К сожалению объективных критериев оценки болевых ощущений не много и они требуют достаточно сложной и дорогостоящей инструментальной и лабораторной технологии. Например, определение уровня стрессовых гормонов в крови, или электроэнцефалографическая оценка боли. Нет точных физиологических или клинических признаков для измерения боли. Инструмент для измерения должен оценивать как само наличие боли, так и ее изменения с течением времени [2].
Некоторые авторы сообщают, что субъективные оценки могут коррелировать с результатами анатомо-функциональных и нейрохимических исследований механизмов боли [3]. В процессе оценки послеоперационной боли много противоречий, например отличия по половому признаку и этническому [4,5]. Однако сведения по этому вопросу на сегодняшний день не достаточны и, наверное, могут не использоваться при исследовании небольших и относительно схожих групп больных.
Для оценки интенсивности послеоперационной боли чаще всего используются визуально-аналоговая шкала (ВАШ) - Visual Analog Scale, (VAS) и цифровая рейтинговая шкала (ЦРШ) - Numerical Rating Scale, (NRS).
В колопроктологической практике также применялся метод картированного опроса пациентов, для определения мобильности, энергичности, эмоциональных реакций, а также выраженности и длительности боли больного [6]. Однако акцент данных исследований приходился именно на изучение качественных и функциональных моментов в анатомически измененной кишке и промежности. Это послужило поводом для изучения именно болевого компонента в послеоперационном периоде у больных, оперированных на дистальном отделе прямой кишки по поводу доброкачественных заболеваний.
Цель исследования: провести сравнительный анализ интенсивности и продолжительности болевого синдрома после операций по поводу доброкачественных заболеваний прямой кишки в зависимости от объема вмешательства и определить эффективность методов оценки интенсивности послеоперационного болевого синдрома.
Материалы и методы. В клинике Ярославской областной больницы за период с 2005 по 2011 г. оперировано 938 пациентов по поводу патологии дистального отдела прямой кишки, таких как хронический геморрой, свищ прямой кишки и хроническая анальная трещина. Мужчин было 525 (55,98%), женщин 413 (44,02%). Возраст пациентов составил от 21 до 76 лет (в среднем 49,3±1,1 лет). Больных с диагнозом хронический геморрой было 447 (47,65%), со свищем прямой кишки 251 (26,76%), с хронической анальной трещиной 125 (13,33%), пациентов с сочетанной патологией 115 (12,26%). Сочетание хронического геморроя со свищем прямой кишки выявлено в 2 (1,73%) случаях, с хронической анальной трещиной в 4 (3,47%), с выпадающим анальным сосочком в 22 (19,13%), с перианальными бахромками у 1 (0,86%) пациента. Сочетание свища прямой кишки с хроническим геморроем у 40 (34,78%) больных, с хроническим геморроем и перианальными кондиломами у 1 (0,86%), с хроническим геморроем и выпадающим анальным сосочком у 1 (0,86%), с выпадающим анальным сосочком у 1 (0,86%) пациента. Сочетание анальной трещины с хроническим геморроем у 39 (33,91%) больных, с выпадающим анальным сосочком у 2 (1,73%), с перианальными бахромками у 1 (0,86%), с перианальными кондиломами в 1 (0,86%) случае.
Исследование болевого синдрома проведено у больных (n=65), которые были оперированы по поводу доброкачественных заболеваний дистального отдела прямой кишки, таких как хронический геморрой, свищ прямой кишки и хроническая анальная трещина. Основную группу (n=26) составили пациенты, у которых имелась сочетанная патология. Группа сравнения (n=39) – больные, оперированные по поводу одного заболевания (табл. 1).
Таблица 1. Распределение пациентов по группам и полу
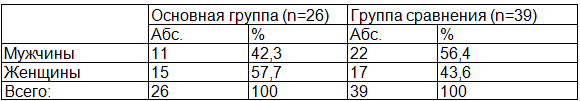
Средний возраст пациентов основной группы составил 48,9±2,1 лет, а группы сравнения 46,1±2,02 лет. Возрастных различий в группах не отмечено (р>0,05).
Пациенты с хроническими болевыми синдромами различной локализации, не связанными с оперативным вмешательством, в группах исследования не учитывались. Все операции выполнены под спинальной, либо внутривенной анастезией с последующим обезболиванием в послеоперационном периоде промедолом.
Интенсивность болевого синдрома определяли по ВАШ и ЦРШ на 1, 3, 5, 7 и 10 сутки после операций в двух группах больных. Учитывая то, что боль является субъективным ощущением, зависящим от ее индивидуального порога, заполнение шкал проводили сами больные самостоятельно.
ВАШ – это отрезок длинной 10 сантиметров, концы которого соответствуют крайним степеням интенсивности боли, «нет боли» - на одном конце, «нестерпимая боль» на другом. [5]. Линия может быть как горизонтальной, так и вертикальной [9]. Пациенту предлагают сделать на этой линии отметку, соответствующую интенсивности испытываемых им в данный момент болевых ощущений. Расстояние между концом линии («нет боли») и сделанной больным отметкой измеряют в сантиметрах.
Помощь в оценке боли при использовании ВАШ могут оказать пояснения, вписанные вдоль линии (например, «слабые, умеренные, тяжелые» или визуальные изображения - смайлики).
Применение визуально-аналоговой шкалы имеет следующие преимущества:
1) метод позволяет определить действительную интенсивность болей (проведенные исследования выявили хорошую корреляцию между данными ВАШ и другими методами измерения силы болей) [10];
2) большинство пациентов, даже дети (в возрасте 5 лет и старше) легко усваивают и правильно используют ВАШ [11];
3) использование ВАШ позволяет изучить распределение рейтинга [12];
4) результаты исследований воспроизводимы во времени [9];
5) более адекватная оценка эффекта лечения по сравнению со словесной характеристикой боли [13].
Однако ВАШ имеет и определенные недостатки по сравнению с другими методиками. Во-первых, пациенты могут весьма произвольно ставить отметки на шкале. Часто подобные отметки не отражают действительности и не соответствуют устным оценкам болей, даваемым самими больными. Во-вторых, расстояние до сделанной отметки должно быть измерено, что требует времени и точности, возможны также ошибки при измерении. В-третьих, ВАШ трудно объяснить пожилым пациентам, не улавливающим связи между линией и положением своей отметки на ней [14]. Наконец, фотокопирование иногда приводит к искажению линии, что отражается на измерении. Поэтому ВАШ не считают оптимальным методом измерения интенсивности боли у взрослых и у пожилых больных, но рекомендуют как успешный у детей [15].
ЦРШ – это цифровая рейтинговая шкала от 0 до 10 (100). Пациентам предлагали оценить свои болевые ощущения цифрами от 0 (нет боли) до величины максимальной ее интенсивности - 10 (100) [7,8]. Эта методика позволяла оценивать динамику болевых ощущений, была проста в употреблении и более демонстративна, чем другие способы измерения боли [16]. Пациенты легко обучались применению этой схемы, особенно когда цифровые обозначения связывались с определенной интенсивностью болей. Шкала быстро усваивалась, была наглядной и удобной в заполнении. Из разных в цифровом масштабе значений шкалы наиболее распространенной стала шкала из 11 пунктов (от 0 до 10). Можно рекомендовать также более детальную шкалу с большим числом цифр, позволяющую подробнее характеризовать вариабильность болевых ощущений.
Некоторые клиницисты предлагали своим пациентам оценивать боли ежечасно все время лечения. Подобная периодическая оценка обеспечивает информацию о динамике боли, что не удается получить при однократном определении ее интенсивности. Сопоставляя предыдущие и последующие показатели болевых ощущений, можно судить об эффективности проводимого лечения. Однако частые измерения требуют сотрудничества со стороны пациента, что иногда становится серьезной проблемой. Более того, настороженность больного в отношении восприятия боли, сопряженная с ее мониторингом, может привести к усилению раздражительности, ощущению недостатка внимания, чувству заброшенности, беспомощности [17]. Это особенно нежелательно, если боли постоянные или даже усиливающиеся. Следовательно, частые измерения боли могут привести к неточности в ее оценке и к преувеличению болевых ощущений.
Несмотря на указанные недостатки, цифровая система оценки боли часто довольно успешно используется в клинических условиях. Возможно, она является наиболее доступным методом при обслуживании большого числа пациентов, страдающих от болей в послеоперационном периоде.
Оценку боли делали по принципу максимальной интенсивности и не учитывали ощущения после обезболивающей инъекции. После этого по результатам отметок пациента строилась кривая интенсивности боли. Анализ болевых ощущений проводился в 1-й, 3-й, 5-й, 7-й и 10-й день после оперативного вмешательства.
Статистический анализ проводили на персональном компьютере с использованием программы "Statistica Microsoft Windows" версия 6.0, StatSoft Inc. Для сравнения выборок применялся U-критерий Манна-Уитни. Уровень статистической значимости принят равным 0,05.
Результаты. В первые сутки после операции болевой синдром в группе сравнения составил 4,3±0,4 и был выше, чем в основной группе 3,6±0,3 (р<0,05). Несмотря на то, что статистически достоверных различий во вторые и в третьи сутки получено не было (р>0,05), интенсивность боли в группе сравнения была выше. Полученные результаты можно объяснить анатомо-физиологическими особенностями оперируемой области. По нашему мнению, наличие дополнительной раневой поверхности в зоне операционного вмешательства в первые трое суток не приводит к повышению интенсивности боли в основной группе (табл. 2).
Таблица 2. Суммарный суточный болевой статус по дням в сантиметрах (ВАШ)
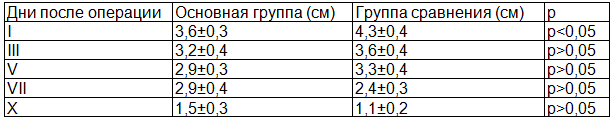
Несмотря на отсутствие достоверной значимости (р>0,05), при сравнении интенсивности болевого синдрома в пределах основной группы отмечено, что болевой синдром в пятые сутки составил 2,9±0,3, а в седьмые 2,9±0,4 соответственно (рис. 1).
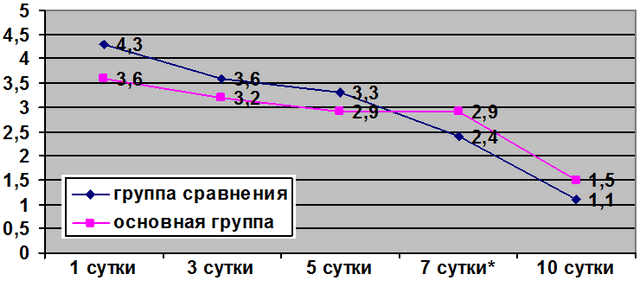
Рис. 1. Кривая интенсивности болевого синдрома по ВАШ: * р<0,05.
В свою очередь в пределах группы сравнения с пятых по седьмые сутки интенсивность боли снизилась с 3,3±0,4 до 2,4±0,3 (р<0,05). К десятым суткам у больных основной группы боль была более интенсивной и продолжительной в виду наличия дополнительной операционной травмы. В основной группе 1,5±0,3, а в группе сравнения 1,1±0,2 (р>0,05).
Для сравнения достоверности оценки интенсивности послеоперационного болевого синдрома, в исследовании нами была использована цифровая рейтинговая шкала (табл. 3).
Таблица 3. Суммарный суточный болевой статус по дням (ЦРШ)
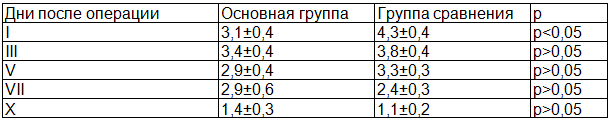
По данным табл. 3, в первые сутки после операции болевой синдром в группе сравнения составил 4,3±0,4 и был достоверно выше, чем в основной группе - 3,1±0,4 (р<0,05). На вторые и третьи сутки интенсивность болевого синдрома в группе сравнения была выше, чем в основной группе, но статистически достоверных различий не выявлено (p>0,05). С пятых по седьмые сутки при отсутствии достоверной значимости (p>0,05) отмечено сохранение интенсивности боли в пределах основной группы, 2,9±0,4 и 2,9±0,6 соответственно (рис. 2).
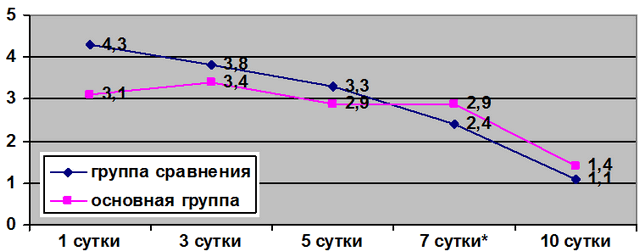
Рис. 2. Кривая интенсивности болевого синдрома по ЦРШ: * р<0,05.
Внутри группы сравнения с пятых по седьмые сутки интенсивность болевого синдрома достоверно снизилась с 3,3±0,3 до 2,4±0,3 (р<0,05). К десятым суткам боль у пациентов основной группы составила 1,4±0,3 и была более интенсивной и продолжительной, чем в группе сравнения (1,1±0,2) в виду сочетанного характера оперативного вмешательства (р>0,05).
Таким образом, изменения динамики болевого синдрома по визуально-аналоговой шкале схожи с таковыми по цифровой рейтинговой шкале. Отмечается достоверное более высокое значение интенсивности боли в первые сутки в группе сравнения, чем в основной группе (p<0,05). Однако на третьи, пятые и седьмые сутки выявлена тенденция к сохранению интенсивности боли в основной группе (p>0,05). В группе сравнения с седьмых суток интенсивность боли достоверно снизилась (p<0,05). К 10 суткам различия в интенсивности болевого синдрома не были столь выраженными между группами, но у больных с сочетанными операциями боль была более интенсивной и продолжительной (p>0,05).
Выводы
- Сочетанные операции по поводу доброкачественных заболеваний дистального отдела прямой кишки в первые пять суток сопровождаются сходным по выраженности болевым синдромом в сравнении с больными, оперированными по поводу одного заболевания.
- Сохранение интенсивности и продолжительности боли в группе больных с сочетанными вмешательствами диктует необходимость оптимизации методов обезболивания в послеоперационном периоде.
- При сравнении изменений интенсивности болевого синдрома по визуально-аналоговой шкале боли и цифровой рейтинговой шкале получены сходные результаты, что позволяет их использование в повседневной практике.
- Мониторинг изменений болевого статуса у конкретного пациента, учитывая его субъективное восприятие боли и характерологические особенности, позволяет проводить адекватную послеоперационную анальгетическую терапию, рационально комбинировать соотношение наркотических и ненаркотических анальгетиков, в том числе и НПВС, что ведет к более быстрой мобилизации репаративных процессов и сокращению сроков выздоровления.
