Актуальность. Послеоперационный перитонит по-прежнему является одной из актуальных проблем абдоминальной хирургии. Частота перитонита после абдоминальных хирургических вмешательств достигает 3,1– 43,1% [1]. Продолжительная гипертермия, лейкоцитоз, боли в животе, аэроколия в зоне анастомоза свидетельствует о неблагополучном течение послеоперационного периода [3, 8, 10]. По данным отечественных и зарубежных авторов наиболее частые послеоперационные осложнения приводящие, к развитию послеоперационного перитонита – несостоятельность анастомозов [1-6, 9]. Типичной локализацией послеоперационных абсцессов в порядке убывающей частоты является поддиафрагмальное пространство, сумка малого сальника, гепаторенальное пространство, дугласово пространство, латеральные каналы, реже забрюшинное пространство и межкишечные абсцессы.
УЗИ имеет бесспорное преимущество в выявлении послеоперационных осложнений. Поскольку этот метод не несет лучевой нагрузки и может использоваться многократно, для динамического наблюдения пациента. Поводом к проведению серии повторных прицельных лучевых исследований обычно служит осложненное течение послеоперационного периода – гипертермия, локальная боль в животе, воспалительные изменения в периферической крови [2, 7]. Однако в некоторых случаях, при применении после оперативных вмешательств сильных анальгетиков и антибиотиков, ярких клинических и лабораторных проявлений, указывающих на наличие осложнения, может и не быть. Именно поэтому после операции необходимо обследование пациента с помощью лучевых методов, а в частности УЗИ. Кроме того, при визуализации патологического образования возможна его прицельная пункция, дренирование и верификация, что существенно повышает диагностическую ценность метода. Если ранние послеоперационные осложнения, зачастую, требуют экстренной релапаротомии, то наибольший интерес вызывают поздние осложнения, представленные отграниченным перитонитом в виде абсцессов и затеков [2].
Цель исследования: определить основные УЗ признаки отграниченного послеоперационного перитонита.
Материалы и методы. Ретроспективный анализ историй болезни позволил выделить исследуемую группу, которую составили 48 пациентов – 26 мужчин (54%) и 22 женщины (46%) с верифицированным диагнозом послеоперационный отграниченный перитонит. Из них у 9 человек (19%) была гастрэктомия, у 2 (4%) – пилородуоденальная резекция, у 11 (23%) гемиколэктомия, у 15 (31%) резекция толстой кишки, 11 пациентам (23%) выполнялись паллиативные операции в виде наложения колостомы. Пациенты находились на стационарном лечение в хирургических отделениях Городской клинической больницы №50, у всех было прогрессирующее развитие синдрома воспалительной реакции, в виде гипертермии и лейкоцитоза со сдвигом влево в периферической крови. Возраст пациентов составил от 33-86 лет (60±3).
Исследования выполнялись на ультразвуковых сканерах B&K Medikal Howk (Дания, 2002), Toshiba – Aplio (Япония, 2009) и сканере Philips AU-22 (Philips, США, 2007) с использованием конвексных датчиков для абдоминальных исследований 2,5–5 МГц и линейных датчиков 5–8 МГц.
Верификация диагноза несостоятельности анастомозов, осложненных отграниченным перитонитом проводилась при помощи дренирования абсцессов у 28 пациентов (58%). У 16 (34%) при релапаротомии и у 4 пациентов (8%) при аутопсии.
Результаты и их обсуждение. Пациенты имели осложненное течение послеоперационного периода, в сроки 2-7 суток (в среднем на 4 сутки ±1 сутки) от момента операции, фиксировался подъем температуры до 38,5 0С, в анализах крови лейкоцитоз достигал 22х109 г/л. Всем было назначено УЗИ с прицельным осмотром зоны операции. У пациентов были выявлены следующие УЗ признаки: утолщенные гипоэхогенные стенки полого органа в зоне анастомоза, наличие перифокального инфильтрата, скопление отграниченной жидкости вокруг зоны анастомоза, наличие реактивного гидроторакса, скопление свободной жидкости в брюшной полости.
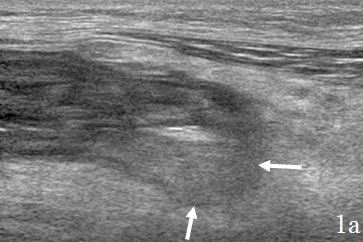
Гастрэктомия (n=9) утолщение стенок культи желудка в зоне анастомоза выявлялось у всех оперированных пациентов и визуализировалось в виде неоднородного гипоэхогенного образования неправильной формы, с неровным, нечетким наружным контуром. Толщина стенки достигала 2,3 см, протяженность 5.9 см. Перифокальный инфильтрат визуализировался в виде однородного образования с нечетким наружным контуром, толщиной 2,1 см. Между измененной стенкой и перифокальным инфильтратом отмечалось скопление однородной жидкости в виде полос (рис. 1).
 |
 |
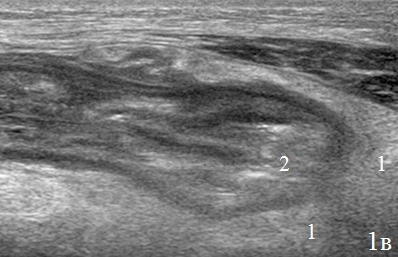 |
Рис. 1. Эхограммы брюшной полости после гастрэктомии, а – гипоэхогенные стенки культи желудка (указано стрелками); б – полоска однородной жидкости (1) за пределами измененной стенки (2); в – наличие перифокального инфильтрата (1), окружающий культю желудка (2).
У одного пациента, при УЗИ, в перифокальном инфильтрате было обнаружено округлое, гипоэхогенное образование, соответствующее измененному лимфатическому узлу, что свидетельствовало о недостаточном объеме оперативного вмешательства (рис. 2).
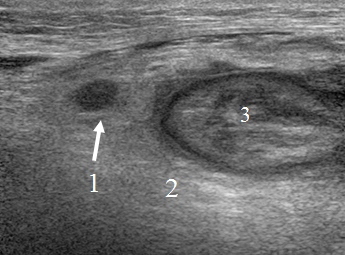
Рис. 2. Эхограмма брюшной полости на которой определяется: измененный лимфатический узел (1), перифокальный инфильтрат (2) окружающий культю желудка (3).
Пилородуоденальная резекция (n=2) – изменения стенки желудка в зоне анастомоза – выявлялось у всех пациентов и визуализировалось в виде неоднородного гипоэхогенного образования неправильной формы, с неровным наружным контуром. Толщина стенки достигала 3,0 см, протяженность 3,2 см.
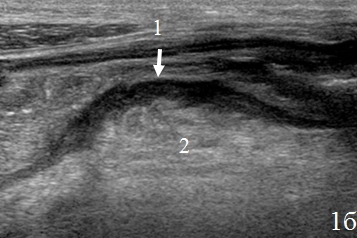
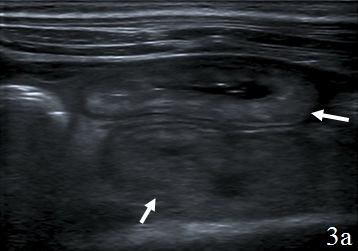
Вокруг зоны анастомоза определялось гипоэхогенное образование, с нечетким наружным контуром – перифокальный инфильтрат, который отграничивал скопление неоднородной жидкости в зоне анастомоза (рис. 3а-в).
 |
 |
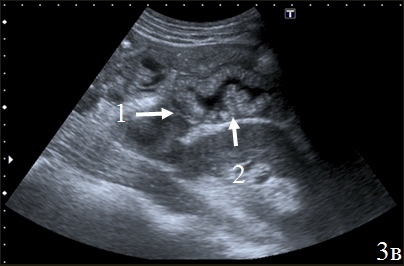 |
Рис. 3. Эхограммы брюшной полости, на которых изображены: а – утолщенные гипоэхогенные стенки кишки (указано стрелками); б – наличие перифокального инфильтрата (1) отграничивающий скопление неоднородной жидкости (синие стрелки); в – скопление неоднородной жидкости (1) за пределами измененной кишки (2).
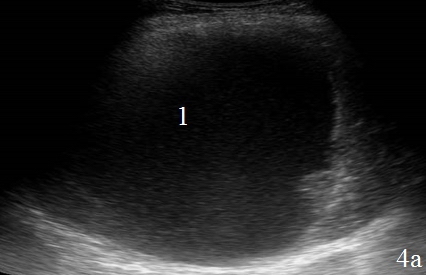
Один пациент поступил с запущенной прикрытой перфорацией двенадцатиперстной кишки, был оперирован, однако в виду того, что он оперирован в условиях уже имеющегося перитонита, послеоперационный период протекал неблагополучно, сформировались абсцессы, которые были потом задренированы. Скопление жидкости было локализовано вокруг зоны анастомоза, в левом и правом поддиафрагмальном пространстве, а также в плевральной полости. Жидкость была отграничена перифокальным инфильтратом. Во всех случаях она была неоднородной, с эхогенными включениями. Объем скоплений жидкости в зоне анастомоза не превышал 100 см3, в поддиафрагмальных пространствах скопления жидкости были более значительными, их объем составлял 200 – 500 см3 (рис. 4 а-б).
 |
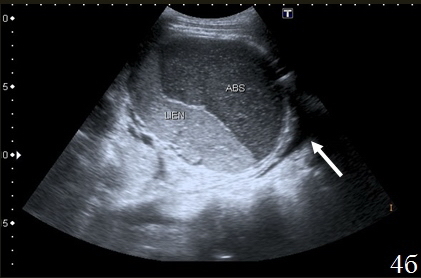 |
Рис. 4. Эхограммы брюшной полости на которых определяется: а – скопление неоднородной жидкости правом поддиафрагмальном пространстве (1); б – скопление неоднородной жидкости в левом поддиафрагмальном пространстве (abs), селезенка (lien), реактивный гидроторакс (указано стрелкой).
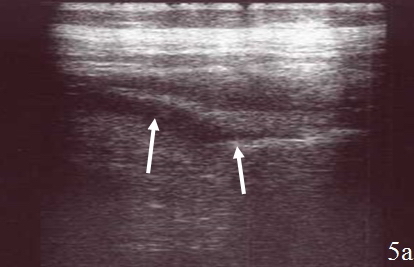
Резекция толстой кишки (n=15) и гемиколэктомия (n=11) – изменения кишки в зоне анастомоза – выявлялись у всех оперированных пациентов и визуализировались в виде неоднородного, гипоэхогенного образования неправильной формы. Толщина инфильтрированных стенок кишки находилась в пределах от 1,0 до 3,0 см. Протяженность пораженного участка кишки достигала 6,0 см (рис. 5а-б).
 |
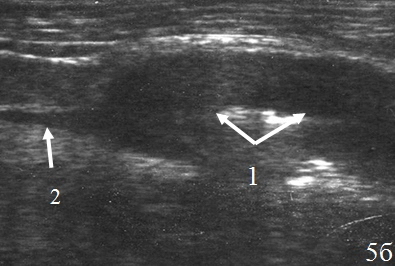 |
Рис. 5. Эхограммы брюшной полости на которых визуализируются: а – утолщенные, гипоэхогенные стенки (указано стрелками); б – утолщенные стенки в зоне анастомоза (1), полоса однородной жидкости за пределами стенки (2).
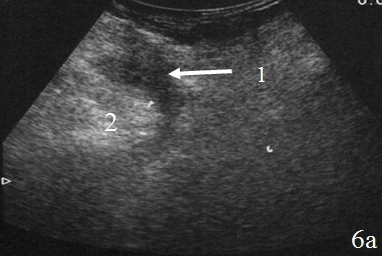
У 12 (46%) человек скопление жидкости было локализовано вокруг зоны кишечного анастомоза и отграничено перифокальным инфильтратом, у 8 (31%) жидкость определялась вокруг зоны анастомоза и не выходила за пределы одного этажа брюшной полости, у 6 (23%) – жидкость определялась в двух этажах брюшной полости. Во всех случаях жидкость была неоднородной, с эхогенными включениями (рис. 6 а-б).
 |
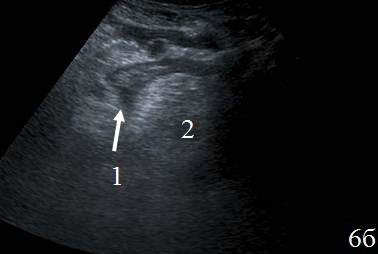 |
Рис. 6. Эхограммы брюшной полости на которых изображены: а, б – наличие неоднородной жидкости (1) в составе перифокального инфильтрата (2).
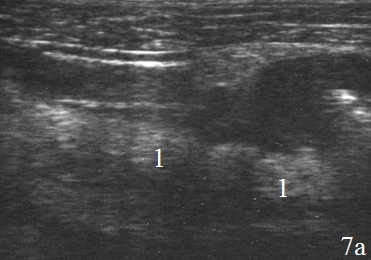
Инфильтративные изменения периколической клетчатки у всех пациентов (n=26) были значительно выражены вокруг зоны анастомоза. Инфильтрат визуализировался в виде образование средней эхогенности с нечетким наружным контуром, толщина его варьировала от 1,8 до 5,4 см (в среднем 2,5±1,3) (рис. 7а-б).
 |
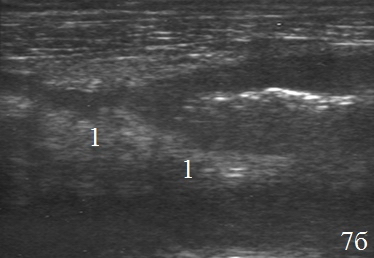 |
Рис. 7. Эхограммы брюшной полости на которых визуализируются: а, б – наличие перифокального инфильтрата (1).
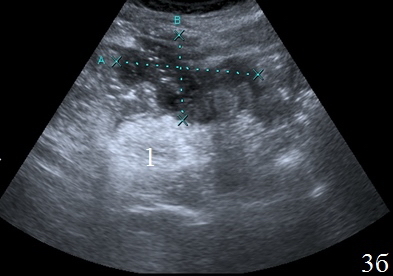
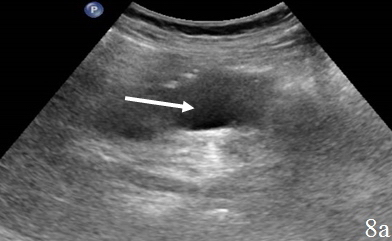
Паллиативные операции (наложение колостомы) (n=11) – изменения стенки кишки в зоне анастомоза – выявлялось у всех пациентов и визуализировалось в виде неоднородного, гипоэхогенного образования неправильной формы, с нечетким наружным контуром. Толщина стенки достигала 2,5 см, протяженность 3,0 см. Вокруг зоны анастомоза определялось гипоэхогенное образование, с нечетким наружным контуром – перифокальный инфильтрат, который отграничивал скопление неоднородной жидкости в зоне анастомоза (рис. 8а-в).
 |
 |
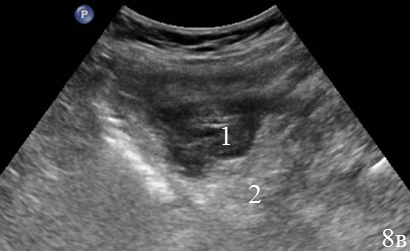 |
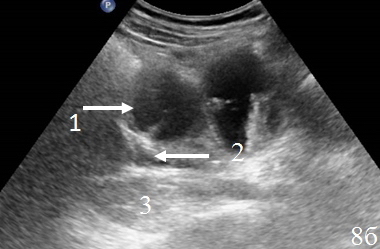
Рис. 8. Эхограммы брюшной полости, на которых определяется: а – утолщенные, гипоэхогенные стенки кишки в зоне анастомоза; б – парез приводящей петли (1), вокруг визуализируется неоднородная жидкость (2), отграниченная перифокальным инфильтратом (3); в – измененную стенку кишки (1) окружает перифокальный инфильтрат (2).
Верификация диагноза производилась при дренировании жидкостных полостей под контролем УЗИ у 21 пациента и релапаротомии у 16 пациентов. В связи с выраженным положительным эффектом от консервативной терапии динамическое наблюдение осуществлялось за 7 оперированными.
Выводы
1. УЗИ с учетом клико – лабораторных данных позволяет достоверно определить наличие отграниченного послеоперационного перитонита после вмешательств на органах ЖКТ.
2. Анализ данных проведенного исследования позволил выделить основные клинико-лучевые симптомы отграниченного послеоперационного перитонита: изменение стенки полого органа в зоне анастомоза; наличие перифокального инфильтрата; локальное скопление неоднородной жидкости в зоне анастомоза и в свободной брюшной полости.
3.УЗИ является методом выбора, поскольку позволяет достоверно выявить абсцессы и затеки, возможна их прицельная пункция и динамический контроль за пациентом.
