Введение. Послеоперационный перитонит по-прежнему остаётся ключевой проблемой экстренной хирургии ввиду трудности диагностики и увеличивающейся в разы летальности [7, 11]. И если в случаях первичных операций по поводу распространенного перитонита и тяжёлого абдоминального сепсиса, а также повреждения органов или вмешательств по поводу нарушения мезентериального кровообращения тактика программированной релапаротомии является устоявшейся [6,10], то принятие решения о релапаротомии в лечении больного, исходно не подразумевавшего повторной операции всегда является тяжёлым решением [3]. При этом существуют категории больных, у которых отмечается наиболее высокая частота поздней диагностики послеоперационного перитонита. В первую очередь это больные с тяжелым течением послеоперационного периода, в том числе больные пожилого и старческого возраста, больные с сочетанной травмой, у которых инвазивные диагностические мероприятия, а тем более диагностическая лапаротомия, сопряжены с крайне высоким операционно-анестезиологическим риском [5,9]. Поэтому в ряде работ делается акцент на биохимические диагностические тесты в дифференциальной диагностике пареза и перитонита [1,4], идет поиск новых диагностических критериев, что значительно затрудняется ввиду «определенных» успехов проводимой параллельно интенсивной терапии и относительно, компенсированного гомеостаза [2]. Ведущим патогенетическим механизмом, определяющим тяжесть состояния больного, оперированного по поводу ургентного состояния органов брюшной полости, в настоящее время рассматривается синдром кишечной недостаточности (СКН) [8]. В основе патогенеза данного состояния лежит нарушение моторной и барьерной функции тонкой кишки с усилением бактериальной транслокации и запуске механизмов абдоминального сепсиса. В оценке степени синдрома кишечной недостаточности особое внимание уделяется уровню эндотоксина. Ряд работ освещают динамику данного показателя при перитоните и кишечной непроходимости [8]. Однако требуют более детального исследования особенности течения ранних стадий энтеральной недостаточности при послеоперационном перитоните и кишечной непроходимости, что даст возможность оптимизировать лечебно-диагностическую тактику у данной категории больных.
Цель исследования: изучить динамику плазменного уровня кишечного эндотоксина в при осложненном и неосложненном течении послеоперационного периода.
Материалы и методы. В основу исследования лег анализ течения послеоперационного периода у 89 больных в возрасте 31-78 лет (средний возраст 44±15,4 года), перенесших ургентные оперативные вмешательства на органах брюшной полости, составивших две группы наблюдения. 1-я группа - 64 больных, которым выполнялись различные экстренные хирургические вмешательства на органах брюшной полости, потребовавшие выполнения релапаротомии. 2-ю группу составили 25 больных, также перенесших первичные экстренные хирургические вмешательства, течение послеоперационного периода которых протекало благоприятно.
В данной группе оценивали структуру хирургических вмешательств, причины повторных вмешательств.
Критериями включения в исследование явились:
- Ургентное заболевание брюшной полости, требовавшее экстренного хирургического вмешательства, при этом больные по описанию протокола операции имели нулевую или 1-ю стадию СКН и не выставлялись показания к назоинтестинальной интубации.
- При выставлении показаний к назоинтестинальной интубации (НИИ) она не проводилась либо по техническим, либо организационным причинам.
Критериями исключения являлось наличие СКН 2-3 стадии; проведенная НИИ; релапаратомия по поводу внутрибрюшного кровотечения; все случаи исходных показаний к программным санациям брюшной полости (распространённый перитонит); травма органов живота, требовавшая использования тактики damage control.
В 1-й группе оценивали структуру хирургических вмешательств, причины повторных вмешательств, а также плазменный уровень кишечного эндотоксина (липополисахарида А, LPS) при постановке показаний к релапаротомии. Во второй группе оценивали клиническое течение послеоперационного периода в сопоставлении с уровнем LPS.Структура нозологии первичных хирургических вмешательств в 1- й группе представлена в табл. 1.
Таблица 1. Структура нозологии первичных вмешательств
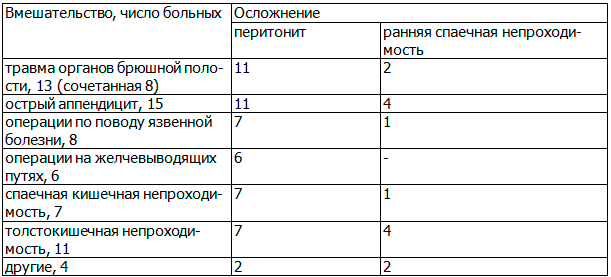
Из представленных данных видно, что ведущей патологией по частоте послеоперационных осложнений является острый аппендицит, что на наш взгляд связано с самой частотой заболевания. Кроме того, отмечается высокая частота послеоперационных осложнений у больных с травмой живота.
Структура первичных вмешательств во второй группе представлена в табл. 2.
Таблица 2. Структура первичных вмешательств во второй группе

Из представленных в табл. 2 данных о характере экстренной патологии второй группы больных отчетливо видно, что данная категория полностью отвечает критериям включения, кроме того ввиду относительно малой травматичности операции риск развития осложнений минимален, что дает возможность оценить минимальные проявления СКН в послеоперационном периоде.
Определение уровня липополисахаридов проводили с помощью LAL-теста (хромогенный тест) набора реактивов (HIT302) HycultBiotech, Голландия.
Статистическую обработку результатов проводили вариационно-статистическим методом с использованием пакета прикладных программ для Micrоsoft Office Excеl 2013, а также приложение Биостат на PC/AT и «iCore 7» в среде Windows 7.
Для определения значимости различий между исследуемыми признаками использовали параметрические и непараметрические методы статистики (t-критерий Стьюдента - для количественных признаков; из непараметрических методик использовался критерий U-критерия Манна-Уитни. Различия считались статистически значимыми при p <0,05.
Результаты исследования. Причиной релапаротомии в 78% (51 случаев) явился перитонит, в 22% (13 случаев) ранняя спаечная непроходимость. Далее остановимся на оценке причин послеоперационного перитонита, представленных в табл. 3.
Таблица 3. Структура причин послеоперационного перитонита

Из данных видно, что одним наиболее частой причиной в данной группе является перфорация острых язв тонкой кишки, несостоятельность межкишечных анастомозов, нарушения мезентериального кровообращения, кроме того, зачастую, источник перитонита установить не представлялось возможным. Сроки релапаротомии разнообразны и зависели в первую очередь от характера осложнения от 1 до 7 и более с момента первичной операции. При этом показания у больных с осложнённым течение послеоперационного периода у больных перенесших вмешательства на желудке и желчевыводящих путях выставлялись в течение 1 суток с момента ухудшения состояния, а наихудшие результаты отмечены в группе больных с сочетанной травмой, где релапаротомия производилась на 3-6 сутки начала неблагоприятного течения послеоперационного периода.
Таблица 4. Динамика уровня эндотоксина в группах
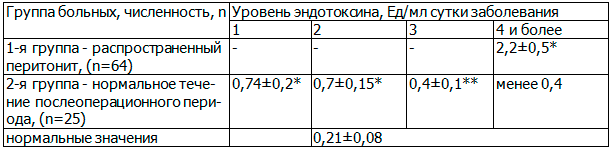
Примечания: * - p<0,05 - различия достоверно выше соответствующих показателей нормальных; ** - p<0,05 - различия достоверны с показателями предыдущих суток.
Из представленных данных мы видим, что малотравматичные операции, на фоне пареза в раннем послеоперационном периоде тоже сопровождаются развитие у больных СКН с, практически, четырехкратным возрастанием плазменного уровня эндотоксина. При этом по мере восстановления перистальтики к третьим суткам отмечается достоверное снижение уровня LPS. Кроме того, мы видим, что неблагоприятное течение послеоперационного периода, связанное с развитием послеоперационного перитонита, диагностированного в, относительно, поздние сроки с момента первичной операции, характеризуется десятикратным нарастанием уровня эндотоксина. При благоприятном течении мы не наблюдали значений уровня эндотоксина выше 1 ЕД/мл на фоне пика послеоперационного пареза, что значительно меньше уровня LPS при перитоните.
Обсуждение. Наихудшие результаты отмечены в группе больных с сочетанной травмой, где релапаротомия производилась на 4-6 сутки начала неблагоприятного течения послеоперационного периода при этом окончательное решение о необходимости релапаротомии принималось после визуализации состояния брюшной полости при инструментальном обследовании. При развитии послеоперационного перитонита у больного с сочетанной травмой в 100% случаев отмечалась несвоевременная диагностика данного осложнения, ведущая к неблагоприятному исходу. Ультразвуковое исследование (при технической возможности его выполнения у конкретного больного) и наличии дренажей без отделяемого по ним чаще интерпретировалось хирургами в пользу отсутствия осложнения. Тяжесть состояния объяснялась сочетанной травмой или сопутствующей соматической патологией, внутрибрюшные осложнения недооценивались.
В данной ситуации многократное нарастание уровня эндотоксина может стать дополнительным диагностическим критерием, позволяющим своевременно заподозрить неблагоприятное течение послеоперационного периода.
Таким образом, послеоперационный перитонит и ранняя спаечная кишечная непроходимость остаются наиболее частыми причинами, обуславливающими неблагоприятный исход заболевания и характеризуются достоверным нарастанием уровня плазменного эндотоксина. У больных с неблагоприятным течением послеоперационного периода после операций по поводу повреждения органов брюшной полости определение динамики уровня данного показателя может стать решающим фактором в постановке показаний к инвазивным диагностическим методам, что требует продолжения исследований в данной области.
