Разработка и доклиническое исследование новых, эффективных, безопасных фармацевтических субстанций, потенциальных лекарственных препаратов (ЛП) является одной из актуальных проблем, как современной фармакологии, так и медицины в целом. С целью уменьшения молекулярной массы альгиновой кислоты, снижения степени ее полимеризации и придания молекуле линейного вида была разработана методика энзиматической деструкции вещества. Оригинальная субстанция была стандартизирована по количественным показателям, полученным в ходе проведения ядерно-магнитной резонансной спектроскопии и эксклюзионной высокоэффективной жидкостной хроматографии.
Выполненные модификации позволили улучшить физико-химические, фармакокинетические и фармакодинамические свойства модифицированного полисахарида по сравнению с нативным веществом. Полученное оригинальное вещество (энзиматически деструктурированная натриевая соль альгиновой кислоты) является водорастворимым. Следует отметить, что раствор не имеет ни вкуса, ни запаха, при нанесении на кожный покров не оказывает раздражающего действия, прозрачен и бесцветен, не пачкает одежду. При длительном хранении (6 месяцев) не выпадает в осадок.
Цель работы - определение профиля безопасности (острой токсичности), установление его эффективной дозы и изучение влияния оригинальной фармацевтической субстанции на основе деструктурированной натриевой соли альгиновой кислоты на течение раневого процесса в эксперименте.
Методика исследования. Работа выполнена на базе кафедр фармакологии, оперативной хирургии и топографической анатомии ГБОУ ВПО «Северный государственный медицинский университет» (г. Архангельск) Минздрава России (СГМУ) с соблюдением современных требований к проведению исследований на лабораторных животных [3,5,6,9,10] и одобрены локальным Этическим комитетом ГБОУ ВПО «СГМУ» (Протокол № 01/1-13 от 27.02.2013 г.).
Острую токсичность соединений определяли по следующей методике [6]: тестируемые соединения вводили однократно, интрагастрально белым нелинейным мышам массой 23±2 г в дозах 50 мг/кг, 500 мг/кг, 5000 мг/кг. Наблюдение за животными проводилось в течение 14 дней. Оценку острой токсичности проводили по ГОСТ 12.1.007-76 [2].
Определение репаративной активности оригинального соединения на основе альгиновой кислоты проводилось на экспериментальных животных белых беспородных крысах-самцах весом 200±20 г в количестве 210 особей. Экспериментальное исследование выполнено на модели раневого процесса - плоскостной асептической раны, полученной по методике Д.В. Королева [4].
У лабораторных животных, в условиях эфирного наркоза, на предварительно депилированной коже спины, после обработки операционного поля йодопироном и 70% спиртом, стерильным скальпелем формировалась плоскостная округлая рана диаметром 1 см.
Стандартизация полученной кожно-фасциальной раны была соблюдена путем применения трафарета из тонкого оргстекла (2 мм), в котором было сделано отверстие диаметром 1 см. Для формирования одинаковых по глубине ран использовался ограничитель. Животные выводились из эксперимента на 3-и, 7-е и 14-е сутки путем передозировки медицинского эфира.
Крыс разделили на 7 групп: 1-я - контрольная, модель - экспериментальные раны лабораторных животных ничем не обрабатывались; 2-я - на раневую поверхность наносилось индифферентное в фармакологическом смысле вещество - стерильный физиологический раствор (NaCl 0,9%); 3-я - на модель раневого процесса наносили раствор неизмененного альгината натрия 2 мг/мл; 4-я - рану орошали раствором модифицированного (низкомолекулярного) альгината 1 мг/мл; 5-я - на раневой дефект наносили раствор модифицированного (низкомолекулярного) альгината 2 мг/мл; 6-я - область раневого процесса орошали раствором модифицированного (низкомолекулярного) альгината 6 мг/мл; 7-я - контроль, референтный препарат - на раны наносили препарат сравнения «Куриозин» (гиалуронат цинка 2 мг/мл) (Гедеон Рихтер, Германия).
Динамика изменений в области экспериментальной раны оценивалась макроскопическим (визуальным), планиметрическим и гистологическим методами. Затем материал фиксировали в растворе нейтрального формалина, заливали в парафин и готовили срезы толщиной 4 мкм. Гистологические препараты окрашивали гематоксилин-эозином. После чего осуществляли патогистологическое исследование [7] и проводили количественную морфометрическую оценку по методике акад. Г.Г. Автандилова [1].
Статистическую обработку полученных данных проводили с использованием программного обеспечения STATA 12.1. Тип распределения данных определяли по критерию Шапиро-Уилка. Поскольку распределение данных статистически значимо отличалось от нормального, то для их описания использовались медиана (Ме). Достоверность различий между группами оценивали с помощью непараметрического критерия Манна-Уитни. Статистически значимыми считали значения р<0,05.
Результаты исследования. В ходе изучения острой токсичности тестируемой субстанции было установлено, что интрагастральное введение исследуемых веществ ни в одной из групп не вызывало гибели лабораторных животных, кроме того, в ходе наблюдения за ними каких-либо изменений как в популяции, так и в поведении отдельных особей не наблюдалось. На основании этого изучаемая деструктурированная альгиновая кислота была отнесена, в соответствии с ГОСТ [2], к IV классу опасности - веществам малоопасным.
Визуально выявленная положительная динамика процессов ранозаживления у групп лабораторных животных, получавших тестируемую субстанцию на основе деструктурированного альгината натрия, была подтверждена количественно методом планиметрии (рис. 1).
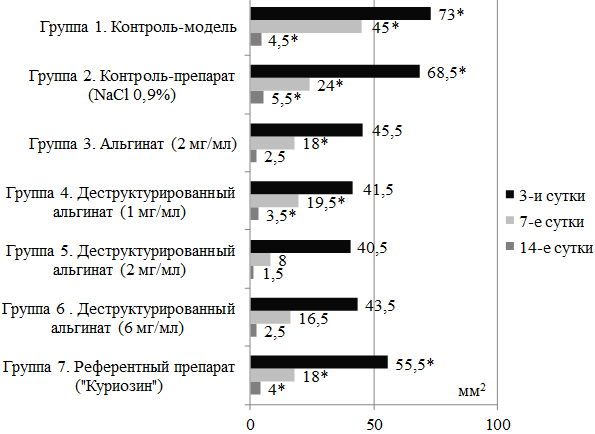
Рис. 1. Результаты планиметрического исследования (площадь раневого дефекта, мм2): здесь и далее * - статистически значимые различия при сравнении групп лабораторных животных с группой 5 - деструктурированный альгинат в концентрации 2 мг/мл (р<0,05).
В ходе изучения влияния концентрации действующего вещества на репаративные процессы (рис. 2) были установлены статистически значимые отличия в количествах клеток соединительной ткани (фибробластов и фиброцитов) на 3-и, 7-е и 14-е сутки эксперимента (группы 4, 5 и 6, р<0,001). Известно, что клетки соединительной ткани играют ключевую роль в репаративных реакциях раневого процесса, поскольку благодаря им, разрушенные структуры замещаются соединительной (в том числе рубцовой) тканью [8].
Статистически значимых отличий при сравнении количества нейтрофилов в группах 4, 5 и 6 выявлено не было, за исключением близкого к статистически значимому отличию на 14-е сутки эксперимента между группами, получавшими изучаемую субстанцию в концентрациях 1 и 2 мг/мл (группы 4 и 5, р=0,06). С учетом изложенного, эффективной дозой исследуемой деструктурированной альгиновой кислоты является 2 мг/мл.
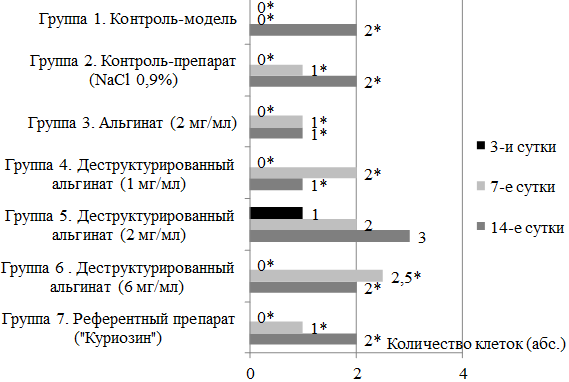
Рис. 2. Количество клеток соединительной ткани (фибробластов и фиброцитов) по данным окулярной планиметрии (количество клеток в малом квадрате окулярной сетки акад. Г.Г. Автандилова при увеличении ×1000).
В ходе проведения окулярной планиметрии было выявлено, что клетки соединительной у группы животных, получавших деструктурированный альгинат, появляются уже на 3-и сутки эксперимента (рис. 2) и их количество нарастает к концу эксперимента (14-е сутки), результаты статистически значимы (р<0,05).
В тоже время положительное влияние на процессы репаративной регенерации в области раневого процесса оказывает антиэкссудативная активность тестируемого соединения: на рисунке 3 показано количество нейтрофилов, которое минимально у групп животных, получавших деструктурированный альгинат, в отличие от других (контрольных) групп.
Несмотря на то, что статистически значимых отличий в количестве нейтрофилов между группами, получавшими деструктурированный альгинат, выявлено не было, при сравнении с контрольными группами были отмечены статистически значимые отличия (рис. 3).
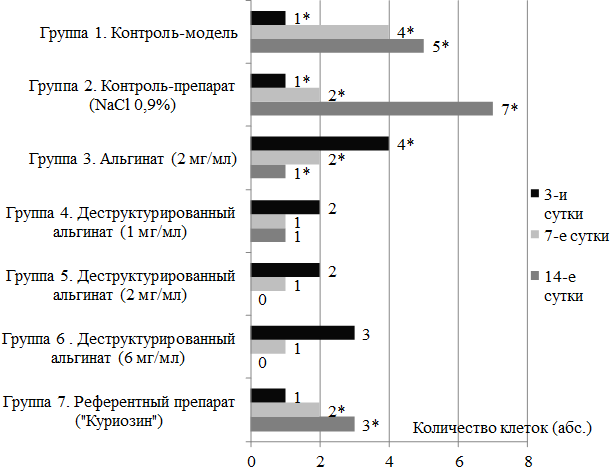
Рис. 3. Количество нейтрофилов по данным окулярной планиметрии (количество клеток в малом квадрате окулярной сетки акад. Г.Г. Автандилова при увеличении ×1000).
В основе описанного эффекта деструктурированной альгиновой кислоты, лежат несколько причин. Одну из них следует искать, вероятно, в снижении степени полимеризации и изменении молекулярной массы биотехнологически модифицированного соединения. Что, очевидно, повлияло на степень контакта с раневым дефектом кожного покрова, и, как следствие, повысило репаративную активность. Последняя обусловлена присутствием в химической структуре альгинатов L-гулуроновой кислоты. В свою очередь, традиционные средства, применяемые для ускорения процессов репаративной регенерации при раневом процессе и, в том числе, изученный нами Куриозин, имеет в своей структуре D-глюкуроновую кислоту, являющуюся пространственным изомером гулуроновой кислоты.
D-глюкуроновая кислота - одна из составных частей химической структуры гликозаминогликанов, участвующих в регуляции многих процессов жизнедеятельности клеток, включая пролиферативную активность, чем и объясняется репаративная активность Куриозина.
В ходе эксперимента было установлено, что примененный референтный препарат (Куриозин) несколько уступает по фармакологической активности тестируемому образцу оригинальной фармацевтической субстанции на основе деструктурированной альгиновой кислоты. Полученные данные, с определенной долей вероятности, могут быть объяснены большей доступностью биологически активных структурных элементов деструктурированной альгиновой кислоты, что является следствием меньшей степени полимеризации и низкой молекулярной массы субстанции по сравнению с производными гиалуроновой кислоты.
Следует отметить, что еще одним важным преимуществом деструктурированной альгиновой кислоты в качестве перспективного оригинального отечественного препарата для ускорения процессов репаративной регенерации является низкая стоимость этого природного вещества и возможность его широкомасштабного промышленного производства.
Выводы. Совокупность полученных данных позволяет заключить, что изученное нами вещество на основе деструктурированной альгиновой кислоты является не токсичным, обладает антиэкссудативной и репаративной активностью, превышающей таковые у препарата сравнения (Куриозин). Эффективная доза энзиматически деструктурированного альгината составила 2 мг/мл.
