Введение. Переломы дистального метаэпифиза лучевой кости являются наиболее частыми повреждениями верхней конечности у взрослых (15 - 33%) [2,4]. Наиболее тяжелые внутрисуставные нестабильные повреждения диагностируются в 50–55% случаев [1,3]. Данные переломы нередко сопровождаются различными осложнениями, специфика которых предопределяется морфологией повреждения, используемыми методами лечения и нарушениями лечебно-реабилитационного режима [5,17]. Сохраняется высокий риск возникновения вторичного смещения отломков (16,5 – 58,3%) [6]. В результате нестабильных переломов неправильное сращение достигает 89% и сопровождается угловой и ротационной деформацией, укорочением лучевой кости и импакцией локтевой кости в запястье, что приводит к развитию и прогрессированию стойких нарушений функции лучезапястного сустава, дегенеративных процессов [13]. Актуальность проблемы возрастает в связи с длительными сроками реабилитации при общепринятых методах восстановительного лечения, достигающих более одного года [8]. В связи с этим ведутся исследования по совершенствованию тактики лечения путем разработки дифференцированных подходов к выбору метода лечения, с учетом особенностей отдельных видов переломов, приобретенного опыта и общего состояния пациента [7,12]. Хирургическое лечение обрело популярность в настоящее время в основном благодаря двум аспектам: восстановлению анатомии, а также раннему функциональному послеоперационному лечению [20]. В зависимости от тяжести модели перелома и ассоциирующихся повреждений, диапазон выбора метода лечения велик - от сугубо консервативной позиции A. Colles (1814) до современного, фактически безальтернативного предпочтения хирургической тактике [21]. Опорные пластины, стягивающие винты, спицы Киршнера, аппараты наружной фиксации различной модификации, цементная фиксация – всё находит свое применение в лечении различных конфигураций данных переломов.
В большинстве случаев лечения внутрисуставных повреждений дистального отдела костей предплечья требуется использование губчатой аутопластики для восстановления суставных поверхностей, поскольку при «поднятии» и репозиции вдавленных фрагментов образуется метаэпифизарный дефект [18]. Всё большее предпочтение травматологи отдают накостному остеосинтезу пластинами с угловой стабильностью в комбинации с костной пластикой. Данный метод осуществляет прямую визуализацию и редукцию, стабильную внутреннюю фиксацию и раннюю мобилизацию во время периода биологического заживления кости [14]. Однако вопрос возмещения костного дефекта метаэпифизарной зоны до настоящего времени не решен. Использование кортико-спонгиозного аутотрансплантата из гребня подвздошной кости, хотя и признано «золотым стандартом», однако имеет такие недостатки как боль в донорской зоне, риск повреждения кожного нерва в области забора трансплантата, увеличение продолжительности операции, риск развития инфекционных осложнений в ране и необходимость углубления наркоза, что особенно нежелательно при лечении пациентов пожилого возраста [9,20,21]. В качестве альтернативных источников для заполнения дефекта лучевой кости применяют: биологическую кость «Bio-Oss Geistlich», синтетическую кость «chronOS», гидроксиапатита карбонат, костный цемент, содержащий фосфат кальция, костный цемент «Norian SRS» и другие виды материалов [9]. Однако перестройка этих трансплантатов все же происходит медленнее, чем перестройка аутокости, что затрудняет своевременное восстановление функции поврежденной конечности. Применение аппарата наружной фиксации для формирования костного регенерата не всегда позволяет в полной мере восстановить анатомию лучевой кости [19]. Нами был разработан новый способ комбинированного лечения внутрисуставных повреждений дистального отдела лучевой кости с использованием аутопластики дефекта метаэпифизарной зоны губчатым трансплантатом, перемещенным из шиловидного отростка лучевой кости (патент РФ на изобретение № 2453288 от 09.03.2011) [11].
Цель исследования: оценка нового способа хирургического лечения больных с внутрисуставными переломами дистального отдела лучевой кости с дефектом метаэпифизарной зоны.
Материалы и методы. За период с 2009 по 2011 г. ФГБУ «СарНИИТО» Минздрава России были прооперированы 20 пациентов с внутрисуставными переломами дистального метаэпифиза лучевой кости (12 женщин и 8 – мужчин) в возрасте от 20 до 70 лет (в среднем 34,6) с использованием разработанного нами способа. В 11 случаях пациенты получили травму в результате падения при ходьбе, в 9 случаях имела место высокоэнергетическая травма (дорожно-транспортная, падение с высоты). Всем пациентам было проведено двухэтапное оперативное лечение с использованием костной пластики дефекта и накостного шинирования. По классификации Fernandez переломы относились к типу 3 (компрессионные внутрисуставные) – у 6 (30%) пациентов, к типу 4 (переломовывихи) - у 2 (10%), к типу 5 (внутрисуставные с отрывом костных фрагментов) – у 7 (35%), к типу 6 (неправильно сросшиеся переломы и ложные суставы) – у 5 (25%), репозиция которых сопровождалась образованием костного дефекта в метаэпифизарной зоне, требующего его замещения. Сроки от момента травмы до операции составили в среднем 3,5 недели (от 0,5 до 12,6 недель). У всех больных были нарушения конгруэнтности суставных поверхностей лучезапястного сустава, укорочение лучевой кости, резкое ограничение функции лучезапястного сустава. Средние значения рентгенометрических и функциональных показателей кистевых суставов до оперативного лечения составляли: ЛЛУ (лучелоктевой угол) - 15,6±4,4˚; ЛИ (ладонная инклинация) - 15,5±6,9˚; ЛЛИ (лучелоктевой индекс) - 4,8±2,3˚. В среднем ООД (общий объем движений) в кистевых суставах составлял 52,6±10,5% от показателей здоровой конечности. Остеосинтез выполняли с помощью пластин с угловой стабильностью DVR производства DeРuy и пластин с угловой стабильностью производства ChM. Лечение внутрисуставных переломов заключалось в комбинированном хирургическом пособии с использованием ауто-аллопластики костного дефекта. Показаниями к операции являлись признаки нестабильности перелома, выраженная деформация лучезапястного сустава и нарушение функции предплечья и кисти.
Техника операции. После предоперационной подготовки больного укладывали на ортопедическом столе на спине, поврежденную конечность – на дополнительном столике в положении руки на тыльной поверхности, в область лучезапястного сустава подкладывали валик. Первым этапом производили восстановление длины лучевой кости путем наложения на предплечье и кисть монолатерального стержневого аппарата внешней фиксации и проведения одномоментной дистракции периферических отломков под рентгенологическим контролем, используя принцип лигаментотаксиса (рис. 1а). Функцией аппарата наружной фиксации, прежде всего, являлись нейтрализация сил компрессии и сведение к минимуму мышечно-сухожильной тяги, которая приводит к укорочению лучевой кости. Однако осевая тракция не оказывает влияние на волярный угол. Известно, что ладонная лучезапястная связка короче и толще, чем тыльная, которая по площади более протяженная, имеет z-образную форму и редко натягивается, поэтому в условиях тракции по оси, возникает тенденция к увеличению тыльного запрокидывания. В связи с этим наложение дистракционного аппарата являлось 1-м этапом операции для восстановления нормальной длины лучевой кости. Затем проводили хирургический ладонный доступ с возможностью обеспечения переднего обнажения дистального отдела лучевой кости. Осуществляли репозицию внутрисуставных отломков путем их выпрессовывания из метаэпифизарной зоны лучевой кости и прижатия к суставной поверхности проксимального ряда костей запястья (рис. 1б). Образовавшийся во время репозиции костный дефект заполняли аутотрансплантатом. Забор трансплантата производили из проведенного ранее разреза. Для этого производили остеотомию кортикальной пластины шиловидного отростка лучевой кости с её волярной поверхности размерами порядка 1 см2. Кортикальную пластину откидывали кнаружи. С помощью ложки Фолькмана осуществляли забор трансплантата в виде губчатого вещества лучевой кости и производили перемещение его в зону костного дефекта. С помощью элеватора проводили запрессовку трансплантата в зону костного дефекта с обеспечением возможности восстановления и укрепления суставной поверхности лучевой кости и ее медиальной колонны, создавая дополнительную фиксацию – подпору для мелких отломков.
Образовавшийся дефект шиловидного отростка лучевой кости после забора трансплантата заполняли биодеградирующим костно-замещающим препаратом с высокими упруго-прочностными свойствами и закрывали остеотомированной кортикальной пластиной волярной поверхности шиловидного отростка с возможностью создания дополнительной опоры латеральной колонне, являющейся основной костной опорой кисти и местом прикрепления большинства связок. После этого производили фиксацию отломков с помощью пластины с угловой стабильностью (рис.1г). Завершали установку пластины путем введения двух винтов через отверстия пластины, костно-замещающий препарат и трансплантат. Первый винт вводили в проксимальное отверстие пластины с возможностью формирования щели между средней частью пластины и лучевой костью, что обеспечивало эффект разгрузки проксимального фрагмента лучевой кости после введения винтов. Второй винт вводили таким образом, чтобы пластина была плотно прижата к диафизу лучевой кости, что обеспечивало эффект разгрузки дистального фрагмента лучевой кости. Подшивали квадратный пронатор с обеспечением укрытия пластины и защиты мягкотканых структур. Рану послойно ушивали наглухо. В заключение операции осуществляли демонтаж аппарата внешней фиксации. Особенностями ведения послеоперационного периода являлась ранняя функциональная нагрузка на суставы конечности. Внешнюю иммобилизацию (тыльная гипсовая лонгета) оперированной конечности проводили в течение 1 суток после операции с целью купирования болевого синдрома. В дальнейшем дополнительной иммобилизации не требовалось. Разработку движений в межфаланговых суставах пальцев и лучезапястном суставе начинали в 1-2 сутки после операции. Послеоперационный период у всех больных протекал без осложнений.
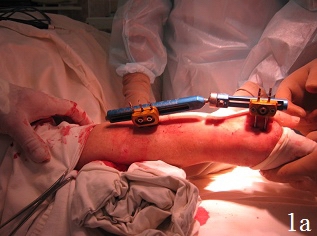
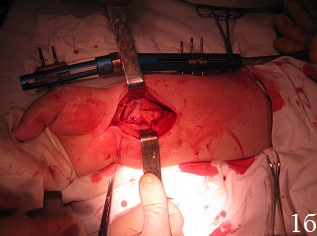
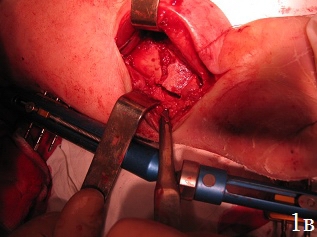
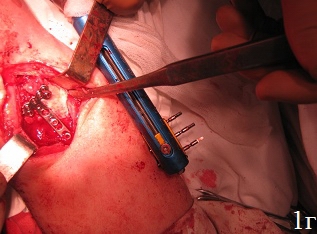
Рис. 1. Этапы операции: а - восстановление длины лучевой кости путем наложения дистракционного аппарата внешней фиксации, б - открытая репозиция, забор трансплантата, в - запрессовка трансплантата в зону дефекта, г - пластика костного дефекта донорской зоны костно-замещающим материалом, остеосинтез пластиной с угловой стабильностью
Результаты и обсуждение. Результаты лечения оценивали через 3, 6, 12 месяцев по объективным и субъективным критериям (методика, разработанная О.М. Семенкиным и С.Н. Измалковым [10]; функциональная способность кисти – опросник НФПКЛ (неспособность функции предплечья, кисти, лучезапястного сустава), основой для которого послужил адаптированный опросник DASH; оценка качества жизни – опросник SF-36 (health status survey). Максимальные сроки наблюдения составили 2 года.
Сращение костных отломков лучевой кости происходило в среднем через 2,6±0,3 месяца после операции. Через год средние величины рентгенометрических показателей приближались к нормальным и составляли: ЛЛУ (лучелоктевой угол) =25,6±4,8˚; ЛИ (ладонная инклинация) =8,5±6,9˚; ЛЛИ (лучелоктевой индекс) =0,8±1,3˚. В среднем ООД (общий объем движений) в кистевых суставах составлял 87,6±3,5%. Ни в одном из представленных клинических случаев не было зафиксировано перелома лучевой кости в области забора трансплантата, его миграции и вторичного смешения отломков. Из 20 больных у 19 получен хороший результат, у 1 – удовлетворительный. В одном случае развилась невропатия срединного нерва, которая потребовала его невролиза.
Клинический случай 1. Б-й С., 37 лет. Диагноз: Неправильно сросшийся внутрисуставной перелом дистального метаэпифиза левой лучевой кости, лучевая косорукость. Ложный сустав шиловидного отростка левой лучевой кости, вывих головки левой локтевой кости (рис. 2 а). Поступил спустя 3 месяца поле травмы с жалобами на деформацию левого предплечья с выраженным нарушением функции. Больному выполнен остеосинтез по разработанному способу (рис. 2 б,в). Послеоперационный период протекал без осложнений. Со 2-го дня после хирургического вмешательства больному проводили лечебную гимнастику для суставов кисти и пальцев. На 10-й день после хирургического вмешательства больной был выписан. К работе приступил через 6 недель после хирургического вмешательства. На контрольном осмотре через год после хирургического вмешательства: рентгенометрические показатели: общий объем движений в кистевом суставе составил 89,6% от здоровой кисти, безболезненный. На рентгенограммах дистального отдела предплечья было отмечено: полное восстановление конгруэнтности суставных поверхностей лучезапястного сустава, полная консолидация отломков лучевой кости, без потери репозиции.
Клинический случай 2. Б-й Ф., 46 лет, Диагноз: Ложный сустав дистального метаэпифиза левой лучевой кости, вывих головки локтевой кости, лучевая косорукость (рис. 3 а,б). Больному выполнен остеосинтез по разработанному способу (рис. 3 в,г). Пациенту проводилось местное лечение: перевязки послеоперационной раны растворами антисептика; с целью профилактики инфекционных осложнений в течение 5 дней проводилась антибактериальная терапия. Гипсовая иммобилизация в первые сутки после операции. Разработку движений в межфаланговых суставах пальцев и лучезапястном суставе начинали на 1-2 сутки после операции. К работе приступил через 8 недель после хирургического вмешательства. На контрольном осмотре через год после хирургического вмешательства: рентгенометрические показатели: общий объем движений в кистевом суставе составил 87,6% от здоровой кисти, безболезненный. На рентгенограммах дистального отдела предплечья было отмечено: восстановление конгруэнтности суставных поверхностей лучезапястного сустава, полная консолидация отломков лучевой кости, без потери репозиции.
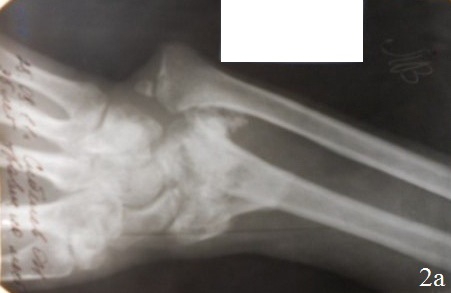
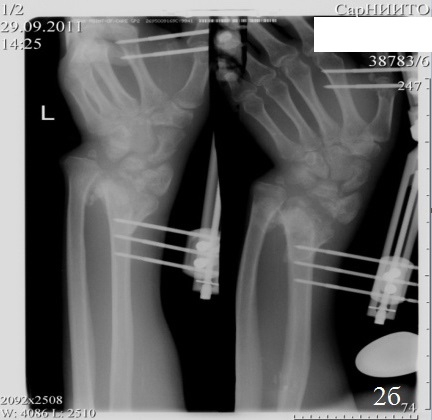
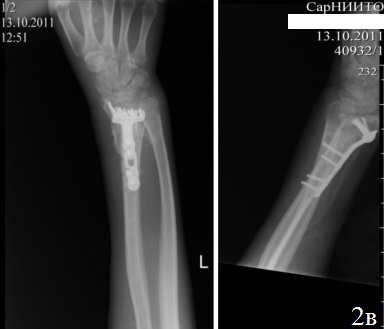
Рис. 2. Рентгенограммы кистевого сустава больного С., 37 лет: а - до операции, б – во время первого этапа операции, в - после остеосинтеза
По данным J. Patel [16], из 1670 случаев взятия аутотрансплантата из дистального метаэпифиза лучевой кости осложнения составили 4%, в том числе, переломы лучевой кости – 2,3%. Экспериментальные исследования L. Horne [15] показали, что после забора менее 25% объема спонгиозного вещества из дистального метафиза лучевой кости не выявлено значимого различия в прочности лучевой кости при ее осевой компрессии по сравнению с неизмененной контралатеральной конечностью (p = 0,273). В наших наблюдениях донорская зона забора трансплантата была возмещена костно-замещающим препаратом с высокими упруго-прочностными свойствами, что обеспечивало создание дополнительной опоры латеральной колонне, являющейся основной костной опорой кисти. Не было зафиксировано ни одного случая перелома лучевой кости в донорской зоне, вторичного смещения отломков и нарушения стабильности системы «фиксатор-кость».
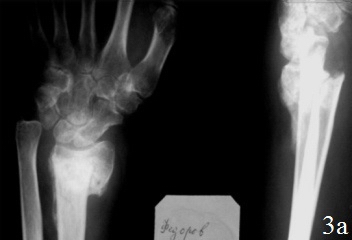
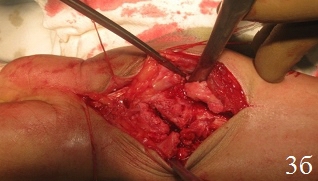
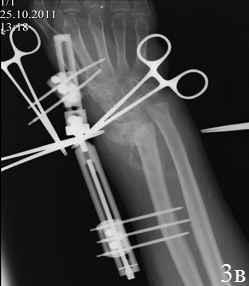
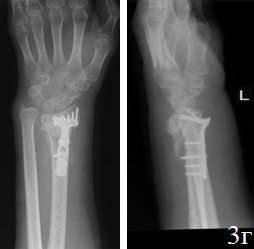
Рис. 3. Рентгенограммы кистевого сустава б-го Ф.: а - после 3,5 месяцев консервативного лечения, б - во время ревизии перелома (наличие склерозированных замыкательных пластинок отломков), в – первый этап операции, г - после остеосинтеза по разработанной методике
Заключение. Результаты исследования свидетельствуют о высокой эффективности разработанного способа лечения внутрисуставных переломов дистального отдела лучевой кости и позволяют его рекомендовать к применению в клинической практике.
