Введение. Проблема восстановления костной ткани является актуальной задачей в современной хирургической стоматологии и челюстно-лицевой хирургии, о чем свидетельствуют непрекращающиеся поиски новых и совершенствование известных остеопластических материалов для восстановления дефектов костной ткани.
Определенные дефекты костной ткани, ее возрастная утрата или патологические состояния не могут быть устранены путем ее физиологической регенерации или благодаря хирургическому вмешательству. В таких случаях для восстановления ткани, как правило, применяются биоматериалы или их синтетические аналоги, способные механически выполнять функции кости.
Наиболее перспективным направлением повышения остеоиндуктивности костных имплантатов и усиления регенерации костной ткани является создание биокомпозитных материалов, содержащих основные компоненты ткани (трикальцийфосфат, гидроксиапатит, костные белки).
В 1965 г. Urist сделал основополагающее открытие, доказав, что деминерализованный костный матрикс способен вызывать образование новой кости вследствие биохимической активизации костных белков [1]. Описанные Urist как «особые остеоиндуктивные белки» [1], позже определенные как «костные морфогенетические белки», или «bone morphogenetic protein» (BMP), в течение 40 лет были предметом активного изучения фундаментальной науки [2], экспериментов на животных и клинических апробаций.
Согласно результатам современных исследователей костные морфогенетические белки являются самыми важными факторами регенерации кости и хряща. Опыты на животных и широкое клиническое применение продемонстрировали эффективность BMP в качестве активного стимулятора остеогенеза, по своему регенераторному потенциалу равного или превосходящего аутологичный костный материал [3].
Современные биомедицинские технологии предусматривают использование данных остеиндукторов в виде рекомбинантных белков (rhBMP), фиксированных на носителях, которые могут быть синтетические, биологические, минеральные или биокомпозитные полимеры [4,5]. Несмотря на все преимущества аутологичной кости в качестве костного трансплантата (наличие клеточных элементов костного мозга, факторов роста и локального кровоснабжения), по единодушному мнению ведущих зарубежных хирургов, рекомбинантные костные морфогенетические белки (rhBMP-2), фиксированные на биологическом носителе, являются реальной альтернативой аутологичному костному материалу [6].
Основываясь на вышеизложенном, и учитывая проблему доступности использования зарубежных аналогов, мы поставили перед собой задачи:
1. Изучить целесообразность использования свода черепа крысы, как модель критического дефекта костной ткани.
2. Установить сроки образования новой костной ткани в зоне дефекта под действием морфогенетического белка кости и оценить ее гистоморфологический состав.
3. Оценить влияние морфогенетического белка кости в составе остеопластического материала на минеральную плотность новообразованной костной ткани, а так же на ткань, окружающую дефект.
Для решения этих задач нами был запланирован и впервые проведен эксперимент на крысах с формированием критического дефекта диаметром 8мм в своде черепа и заполнения его деминерализованным костным матриксом, насыщенным отечественным морфогенетическим белком кости с последующими гистоморфометрическим, гистоморфологическим, рентгенологическим исследованиями новообразованной костной ткани и анализом полученных результатов для разработки практических рекомендаций к его применению.
Материалы и методы. В исследовании использовали биокомпозиционный материал на основе деминерализованного костного матрикса в виде крошки в чистом виде и соединенный с рекомбинантным морфогенетическим белком кости (rhBMP-2). Синтез и соединение рекомбинантного морфогенетического белка с деминерализованным костным матриксом проводились на базе Института теоретической и экспериментальной биофизики Российской академии наук (ИТЭБ РАН) по методике, описанной зарубежными авторами. Концентрация белка в имплантате составляла 0,6-0,8 мг/см3. В эксперименте использовано 18 половозрелых самцов белых крыс массой тела 400-500 г. Во всех случаях выполнялась операция по одной и той же методике.
Техника операции. Все операции выполнялись под общим наркозом Золетил 100 0,2 мл. В центре свода черепа при помощи трепана выполнялся сквозной костный дефект диаметром 8 мм. Образованный дефект заполнялся различными костнопластическими материалами, заготовленными заранее (ортотопичесчкая имплантация). Рана ушивалась узловыми швами наглухо. Животные содержались в клетках по 5 особей. Из эксперимента их выводили путем передозировки наркоза (соблюдались требования «Европейской Конвенции о защите позвоночных животных, используемых в экспериментах или в иных научных целях» от 18.03.1986 г.).
Животные были разделены на 3 группы, I-я контрольная, II-я и III-я экспериментальные (по 6 крыс в каждой). У животных II-ой группы (группы сравнения) дефект заполняли чистым деминерализованным костным матриксом, а у III-ей (основной) группы дефект заполняли деминерализованным костным матриксом, содержащим rhBMP-2. В контрольной группе дефект заживал под сгустком. Из эксперимента животные выводились в следующие сроки: 1, 2, 3 месяца, по 2 крысы из каждой группы.
После выведения всех животных из эксперимента визуально оценивали выраженность воспалительной реакции мягких тканей в области вмешательства и проводили рентгеновское исследование черепа крысы. Следующим этапом выполняли сегментарную остеотомию свода черепа, после чего сегмент свода черепа фиксировали в формалине и помещали в пробирку для морфологического исследования, которое проводили в течение первых 10 дней после выведения животных из эксперимента.
Гистологическая проводка. Гистологическое исследование образцов ткани проводили непосредственно после биопсии. Материал помещали в 10% раствор формалина на фосфатном буфере на 72 часа, после чего в течение 24 часов образцы ткани промывали в проточной воде. После стандартной гистологической проводки образцы тканей заливали в парафин.
Серийные резы получали на микротоме Microm (7 мкм). Для изучения срезов тканей следующие методы:
обзорные окраски - гематоксилином и эозином по Майеру;
для выявления специфических процессов образования костной ткани и резорбции ее препараты окрашивали по Массон-Голднер (BioOptica, Italy).
Документирование. Фотодокументирование проводилось на микроскопе Leica DM2500 с фотокамерой Leica DTC295. В качестве метода рандомизации использовалась следующая схема, если не было необходимости в прицельном изучении объекта, то с помощью генератора случайных чисел Random определялись 5-7 номеров, которые подвергались изучению и документированию.
Морфометрия. Для определения основных процессов образования, резорбции, созревания костной ткани в костных регенератах мы использовали гистоморфометрическую платформу, рекомендованную Международной ассоциацией исследователей костной ткани [7].
При морфометрическом исследовании определяли объемную долю (%) костной ткани BV/TV, фиброзной ткани FbV/TV, материала MatV/TV, и ретикулофиброзной ткани RetV/TV.
Результаты. Контрольная группа. 30 дней. При гистологическом исследовании костных регенератов в контрольной группе обращало на себя внимание, что фронт регенерации костной ткани с обоих полюсов распространялся к центру по твердой мозговой оболочке (рис.1). На поверхности костных балок имелись активные пролиферирующие остеобласты, обеспечивающие оппозиционный рост регенерата. Центральная область дефекта в основном была представлена ретикуло-фиброзной и грубоволокнистой соединительной тканью. Морфометрическое исследование выявило следующее распределение основных структурных компонентов в регенерате: BV% -32,27%, RevV% - 69,35%, FbV% - 0,00, MatV% - 0,00.

Рис.1. Гистотопограмма теменной кости крысы через 30 дней после нанесения повреждения. Окраска по Массон-Голнер. Х32
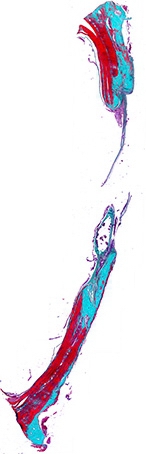
Рис. 2. Гистотопограмма поперечного среза теменной кости крысы через 60 дней после нанесения повреждения. Окраска по Массон-Голдер. Х32
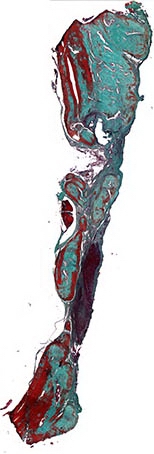
Рис. 3. Костный регенерат в контрольной группе. Области костного дефекта островки зрелой компактной кости в окружении соединительной ткани. Окраска по Массон-Голднеру. Х32
60 дней. При исследовании образцов через 60 дней после операции в контрольной группе обращало на себя внимание, что костный регенерат распространяется с материнского ложа вплоть до центра дефекта, однако заполнение его полностью не происходит, а он в свою очередь имеет ячеистую структуру (рис. 2). Новообразованная костная ткань принимают упорядоченную форму. На поверхности костных балок активные остеобласты. При морфометрическом исследовании определены следующие показатели структурной организации костного регенерата: BV% - 62,44%, RevV% - 27,56%, FbV% - 0,00, MatV% - 0,00.
90 дней. При гистологическом исследовании образцов из данной группы обнаружено, что сформированные в центре регенерата костные балки имеют зрелый характер, однако ячеистая структура регенерата сохранена (рис. 3). На поверхности костных балок активные остеобласты, что свидетельствует о продолжении процессов регенерации. При морфометрическом исследовании определены следующие показатели структурной организации костного регенерата: BV% - 76,18%, RevV% - 19,87%, FbV% - 0,00, MatV% - 0,00.
Группа сравнения. 30 дней. Через 30 суток после имплантации остеопластического материла без рекомбинантного костного морфогенетического белка (rBMP2) при гистологическом исследовании образцов выявлено, что с краев материнской кости фронт костной регенерации распространяется к центру не симметрично, больше с одного из полюсов (рис 4а). На поверхности костных балок присутствуют остеобласты. В центральной части регенерата обнаруживаются частицы костного остеопластического материала, которые подвергаются резорбции гигантскими клетками инородных тел. В грубоволокнистом и ретикулярно-фиброзном матриксе обнаруживается умеренная инфильтрация лимфоцитами и плазмоцитами (рис. 4б), что свидетельствует о процессах продуктивного воспаления.
При морфометрическом исследовании определены следующие показатели структурной организации костного регенерата: BV% - 21,26%, RevV% - 11,71%, FbV% - 22,90%, MatV% - 29,35%.

Рис. 4а. Костный регенерат теменных костей крыс через 30 дней после имплантации остеопластического материала. Гранулы материала расположены внутри костного дефекта и окружены соединительной тканью. Окраска по Массон-Голднер. Х32
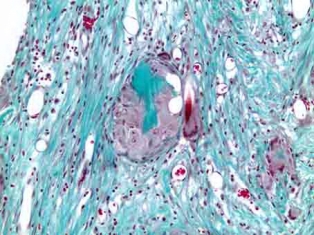
Рис. 4б. Резорбция гигантскими клетками инородных тел гранул остеопластическго материала, располагающегося в незрелой соединительной ткани. Окраска по Массон-Голднер. Х200
60 дней. При гистологическом исследовании образцов из данной группы обращало на себя внимание, что аппозиционный рост костного регенерата не имеет значительного продолжения (рис. 5а). Костный матрикс новообразованной кости представлен созревающей пластинчатой костной ткань с неактивными остеобластами на поверхности (рис. 5б). В центре регенерата расположены гранулы остеопластического материала в окружении соединительной ткани, в которой отмечается инфильтрация плазмо- и лимфоцитами. На поверхности гранул материала располагаются очагово гигантские клетки инородных тел, резорбирующие материал.
При морфометрическом исследовании определены следующие показатели структурной организации костного регенерата: BV% - 16,0%, RevV% - 0,00%, FbV% - 47,0%, MatV% - 37,5%.
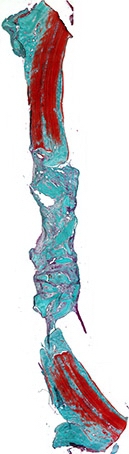
Рис. 5а. Костный регенерат через 60 дней после имплантации остеопластического материала. Гранулы материала заполняют центральную часть дефекта в окружении соединительной ткани. Окраска по Массон-Голднер. Х32
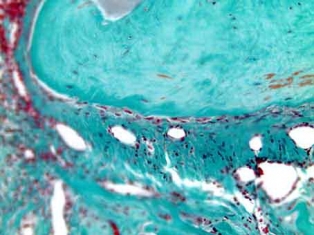
Рис. 5б. Остеогенез со стороны материнской кости. Образование ретикулофиброзной костной ткани. Окраска по Массон-Голднеру. Х200
90 дней. При исследовании образцов теменных костей крыс через 90 дней после имплантации остеопластического материала обнаруживается, что костный регенерат у краев дефекта имеет зрелый характер. В центре регенерата обнаруживаются гранулы остеопластического материала с признаками резорбции гигантскими клетками. На поверхности отдельных гранул обнаруживаются напластования костного матрикса (рис.6а). В окружающем материале соединительной ткани признаки продуктивного воспаления (гиагантоклеточная, плазмоцитарная и лимфоцитарная инфильтрация) (рис. 6б).
При морфометрическом исследовании определены следующие показатели структурной организации костного регенерата: BV% -30,15%, RevV% - 0,00%, FbV% - 47,76%, MatV% - 30,15%.
Основная группа. 30 дней. В образцах из данной группы обращало на себя внимание, что костный регенерат с материнской кости имел тенденцию к росту в направлении центра. Однако максимальный и более выраженный рост отмечался с одного из полюсов. На поверхности костных балок определялись активные остеобласты образующие остеоид. В средней части костного регенерата обнаруживались частицы костного остеопластического материала, окруженного грубоволокнистой соединительной тканью (рис. 7а) с инфильтрацией ее лимфоцитами и плазмоцитами, гигантскими клетками инородных тел (рис. 7б). Среди полей фиброзной ткани встречались участки жировой ткани и местами кровоизлияния из полнокровных сосудов.
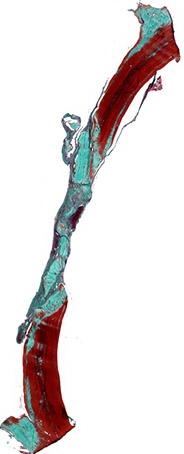
Рис. 6а. Гистотопограмма поперечного среза теменной кости крысы через 90 дней после имплантации остеопластического материала. Остатки материала в костном дефекте. Окраска по Массон-Голнер. Х32
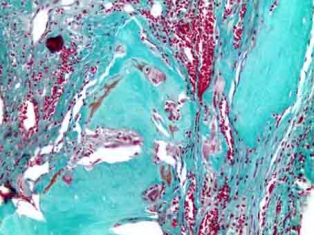
Рис. 6б. Резорбция материала гигантскими клетками инородных тел. Окраска по Массон-Голднеру. Х200
При морфометрическом исследовании определены следующие показатели структурной организации костного регенерата: BV% -25,41%, RevV% - 11,71%, FbV% - 22,90%, MatV% - 29,35%.
60 дней. Гистологическая картина в образцах через 60 дней после имплантации остеоиндуктивного материала, содержащего костный морфогенетический белок характеризовалась замедлением процессов неоостеогенеза (рис.8а), созреванием новообразованной костной ткани и продолжающимся продуктивным воспалением, связанным с реакцией на инородное тело – остеопластический материал (рис.8б). Грубоволокнистая соединительная ткань имеет зрелую структуру.
При морфометрическом исследовании определены следующие показатели структурной организации костного регенерата: BV% -34,35%, RevV% - 0,00%, FbV% - 33,61%, MatV% - 30,27%.
90 дней. При исследовании образцов теменных костей черепов крыс на сроке 90 суток обнаруживается, что костный регенерат у краев дефекта имеет зрелый характер. В центре регенерата обнаруживаются гранулы остеопластического материала с признаками резорбции гигантскими клетками. В одном из образцов с одного из краев обнаруживается образование костной ткани на гранулах (рис. 9а). В окружающем материале соединительной ткани признаки продуктивного воспаления (рис. 9б).

Рис. 7а. Костный регенерат через 30 дней после имплантации остеопластического материала содержащего костный морфогенетический белок. Материал располагается в центральной части регенерата в окружении незрелой соединительной ткани. Окраска по Массон-Голднеру. Х32
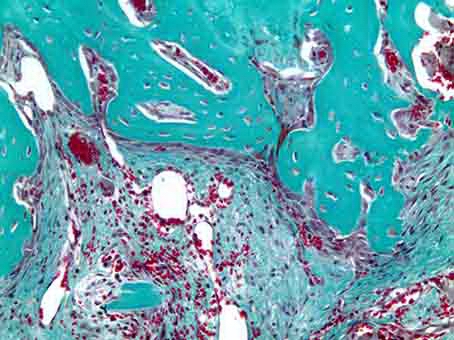
Рис. 7б. Формирование молодой ретикулофиброзной костной ткани со стороны материнской кости через 30 дней после имплантации остеопластического материала, содержащего костный морфогенетический белок. На поверхности костных балок активные остеобласты. Х200
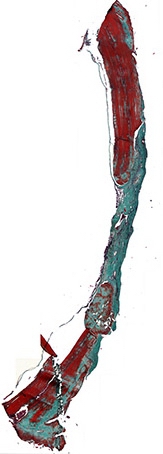
Рис. 8а. Костный регенерат через 60 дней после имплантации остеопластического материала содержащего костный морфогенетический белок. Отмечается аппозиционный рост костной ткани со стороны материнского ложа. Окраска по Массон-Голднер. Х32
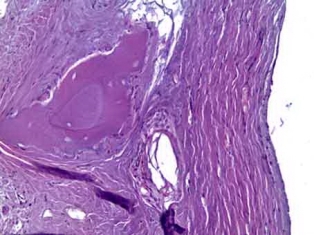
Рис. 8б. Гранулы остеопластического материала с признаками резорбции в грубоволокнистой соединительной ткани. Окраска гематоксилин и эозин. Х200
При морфометрическом исследовании определены следующие показатели структурной организации костного регенерата: BV% -22,20%, RevV% - 2,93%, FbV% - 55,31%, MatV% - 30,15%.
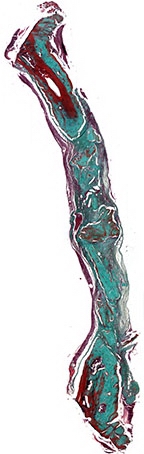
Рис. 9а. Зрелый костный регенерат через 90 дней после имплантации остеопластического материала содержащего костный морфогенетический белок. В центральной части дефекта гранулы материала в окружении соединительной ткани. Окраска по Массон-Голнер. Х32
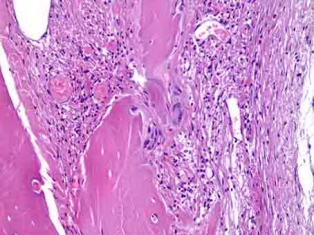
Рис. 9б. Резорбция материала, лежащего в грубоволокнистой соединительной ткани, гигантскими клетками инородных тел. Окраска гемотоксилином и эозином. Х200
Обсуждение. В результате проведенного исследования установленоо:
1. Использованная модель критического дефекта костной ткани является адекватной и отвечает требованию к поставленным целям и задачам.
2. Имплантация материала с BMP-2 показывает разницу с группой сравнения в первые 2 срока наблюдения (1 и 2 мес.) в сторону более высокой эффективности образования костной ткани по сравнению с имплантацией материала, не содержащего BMP-2.
3. Имплантация костного остеопластического материала препятствует регенерации, ограничивая его распространение к центру, за счет существования хронического продуктивного воспаления (реакции на инородное тело).
