Введение. Остеомиелит костей стопы на фоне сахарного диабета чаще возникает в результате проникновения инфекции в их губчатое вещество по коротким венам из соседних, мягкотканных очагов гнойного воспаления [1]. При данном заболевании развивается тяжелый вторичный иммунодефицит [2,3]. Поэтому одним из наиболее перспективных и патогенетически обоснованных направлений в комплексном лечении таких больных становится комбинированная иммунокорригирующая терапия [6,7]. К сожалению, систематизированных сообщений о комбинированном применении иммуномодулирующих препаратов при хроническом остеомиелите костей стопы в доступной литературе найти не удалось [3].
Цель исследования: анализ эффективности лечения больных хроническим остеомиелитом костей стопы с применением стандартной терапии и комбинации иммуномодулирующих препаратов глутоксим и полиоксидоний.
Материал и методы исследования. Обследовано 48 больных хроническим остеомиелитом костей стопы в возрасте от 30 до 59 лет, поступивших в отделения гнойной хирургической инфекции Курской областной клинической больницы в период с 2011 по 2013 г.
В группу контроля вошли 20 клинически здоровых доноров крови, в возрасте от 30 до 59 лет. Пациенты группы сравнения (24 человека) получали стандартное лечение, включавшее антибактериальные, противовоспалительные препараты, физиотерапию, перевязки. Средний возраст больных составил 50,7±7,8 лет. Пациенты основной группы (24 человека) в дополнение к стандартному лечению получали полиоксидоний в дозе 6 мг внутримышечно один раз в сутки ежедневно в количестве 10 инъекций и глутоксим в дозе 30 мг внутримышечно один раз в сутки ежедневно в течение 10 дней. Средний возраст составил 53,3±6,2 года.
Для оценки функционально-метаболической активности нейтрофилов крови изучали следующие показатели: фагоцитарное число (ФЧ) и фагоцитарный показатель (ФП), на основе которых вычислялся индекс активности фагоцитов (ИАФ); завершённость фагоцитоза (ЗФ); тест восстановления нитросинего тетразолия (НСТ) с расчетом индекса стимуляции нейтрофилов (ИСН) [5]. С целью оценки состояния клеточного звена иммунитета изучены фенотипы популяций лимфоцитов (СD3+, СD4+, СD8+, СD16+) с помощью набора реагентов МКА Клоноспектр («Клоноспектр», г. Москва) методом иммунофлуоресценции.
Статистическая обработка полученных данных проводилась с помощью пакетов прикладных программ «Excel» и «Statisticа 10». Для сравнения иммунологических показателей групп использовался непараметрический вариант критерия Ньюмена-Кейлса [4].
Результаты и их обсуждение. Во всех группах остеомиелит развился на фоне сахарного диабета 2 типа и являлся проявлением смешанной формы синдрома диабетической стопы (3 степень по классификации Wagner, 1979) [3]. У пациентов при поступлении отмечена декомпенсация и тяжелое течение сахарного диабета.
Группа сравнения и основные группы были разделены на две подгруппы. В подгруппу А вошли пациенты со свищевой формой остеомиелита (12 пациентов в каждой группе). В подгруппу В вошли больные, у которых течение заболевания осложнилось развитием флегмоны и абсцесса стопы. У 5 больных в каждой подгруппе В диагностирована флегмона стопы, в 7 случаях отмечен абсцесс пальца стопы, т.е. у всех больных отмечены осложнения основного заболевания. Из 48 пациентов 14 больных были оперированы ранее, из них 6 пациентов оперированы неоднократно. Средний бал по APACHE II для пациентов подгрупп А составил 6±1,2 балла, предположительный риск смерти 6,7±1,3%; для подгрупп В - 11±1,2 балла, предположительный риск смерти 12,9±1,6%. По характеру и тяжести течения основной и сопутствующей патологии, полу и возрасту исследуемые группы были сопоставимы.
Показатели клеточного иммунитета у больных остеомиелитом до начала лечения существенно отличались от группы контроля (таблица 1). Развитие исследуемой формы патологии характеризовалось достоверно более низким фагоцитарным показателем и числом, завершённостью фагоцитоза, индексом активности фагоцитов, значением стимулированного НСТ-теста, и индекса стимуляции нейтрофилов. При этом показатели спонтанного НСТ-теста наоборот были достоверно выше значений контроля. Абсолютное количество лимфоцитов не отличалось от показателей контроля, тогда как процентное содержание СD3+-клеток было ниже нормы. На фоне снижения абсолютного и относительного содержания CD4+- и CD16+-клеток у больных остеомиелитом количество СD8+-лимфоцитов было достоверно выше значений здоровых лиц. Это привело к тому, что соотношение CD4+/CD8+-лимфоцитов было в 3,2-3,4 раза меньше показателей контроля. Всё это свидетельствует о напряжённости иммунного ответа, истощении функционального резерва нейтрофилов и о развитии иммунодефицита со стороны клеточного звена иммунитета у пациентов с остеомиелитом.
Таблица 1. Исходные показатели клеточного звена иммунитета у больных и здоровых лиц
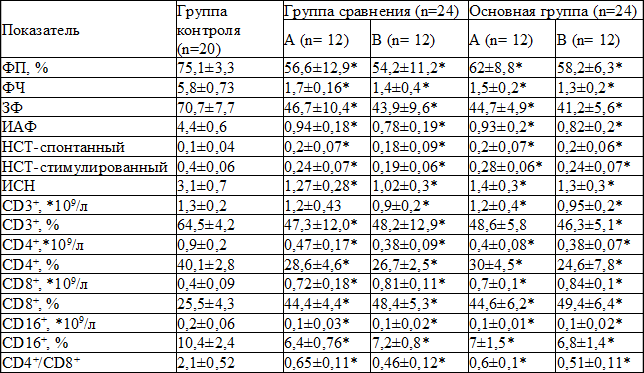
Примечание: *- достоверное отличие показателей больных от группы контроля
В подгруппе А при поступлении и в процессе лечения отсутствие температурной реакции на очаг хронического воспаления отмечено в 8 случаях (66,7%), а в подгруппе В – в 7 случаях (58,3%). В остальных случаях нормализация температуры на фоне лечения происходила в подгруппе А на 9,5±6,4 сутки, а в подгруппе В – на 14,2±5,4 сутки. Обращает внимание отсутствие лейкоцитоза и изменений в лейкоформуле на момент поступления и в ходе лечения у пациентов подгруппы А в 8 случаях (66,7%), а у пациентов подгруппы В в 7 случаях (58,3%). В остальных случаях нормализация лейкоцитоза и лейкоформулы наступила в подгруппе А на 13,5±4,4 сутки лечения, а в подгруппе В – на 12±6,8 сутки.
При бактериологическом исследовании раневого отделяемого получен рост следующих микроорганизмов: S.epidermidis – в 6 случаях (25%), S.aureus – в 5 случаях, S.haemolyticus – в 2 случаях, P.aeruginosa – в 2 случаях, P.mirabilis – в 1 случае, Е.aerogenius – 1 случае. В 7 случаях роста не получено, что может говорить в пользу анаэробных микроорганизмов.
При рентгенологическом исследовании стопы кости плюсны поражались в 18 случаях (75%), фаланги пальцев – в 8 случаях (33,3%). Полость в кости выявлена в 13 случаях (54,2%), наличие секвестра – у 7 пациентов (29,2%), краевая деструкция – у 20 больных (83,3%), периостит – в 15 случаях (62,5%) и патологический перелом – у 1 пациента (4,2%).
При реовазографии нижних конечностей в подгруппе А субкомпенсация кровенаполнения заинтересованной стопы наблюдалась в 66,7% случаев (8 больных), декомпенсация – в 33,3 % случаев (4 больных). В подгруппе В наблюдалась обратная ситуация: декомпенсация кровотока отмечена в 66,7% случаев (8 больных), субкомпенсация в 33,3 % случаев.
В подгруппе А прооперировано 5 больных (41,7%): в 1 случае (8,3%) выполнена частичная хирургическая обработка гнойного очага (ЧХО), в 3 случаях (25%) – некрсеквестрэктомия; в 1 случае (8,3%) - резекция плюсневой кости. В подгруппе В оперированы все пациенты. В 11 случаях (91,7%) выполнена ЧХО гнойного очага, резекция плюсневой кости выполнена у 1 больного (8,3%), некрсеквестрэктомия выполнена у 1 больного (8,3%), ампутация на уровне нижней трети голени выполнена у 1 больного (8,3%).
Закрытие свищей на фоне консервативного лечения происходило на 15,6±3,4 сутки. Заживление послеоперационной раны вторичным натяжением наблюдалось на 17,5±5,4 сутки.
При включении в схему лечения полиоксидония и глутоксима значения фагоцитарного показателя, НСТ-теста, индекса стимуляции нейтрофилов, абсолютное и относительное количество CD3+, CD4+, CD16+ лимфоцитов, процент CD8+ лимфоцитов, индекс СD4+/CD8+ достигли уровня нормы. Остальные показатели были статистически достоверно ближе к норме, чем в группе сравнения.
Таблица 2. Показатели клеточного иммунитета в группах после стандартного лечения и курса лечения с применением глутоксима и полиоксидония по сравнению с нормой
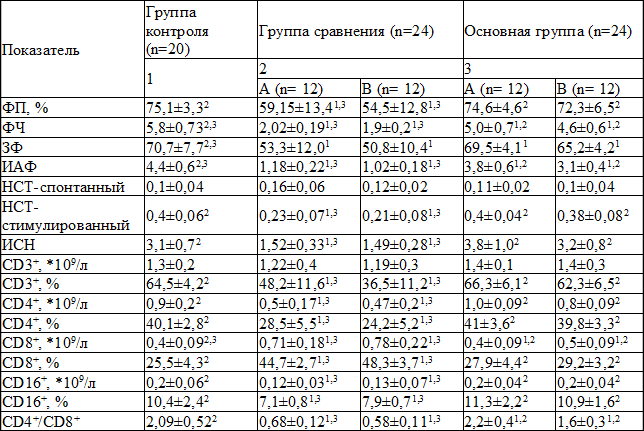
Примечание: надстрочным индексом указан номер группы, с которой имеется статистически достоверное различие
Заключение. У больных хроническим остеомиелитом костей стопы отмечается выраженная иммуносупрессия клеточного звена врожденного иммунитета, сопровождающаяся снижением функционального резерва нейтрофилов и низкой активностью фагоцитов. При включении в схему лечения полиоксидония и глутоксима отмечались достоверно более высокие показатели клеточного звена врожденного иммунитета с нормализацией бактерицидной активности нейтрофилов и популяционного состава нейтрофилов.
