Традиционными для хирургической практики в ортопедии и травматологи, как и в челюстно-лицевой хирургии материалами для фиксации, а в ряде случаев и для замещения обширных костных дефектов, являются металлы, обычно титан и его сплавы. В случае их применения, естественно, в последующем необходимо проведение повторной операции с целью их удаления. К тому же при длительном пребывании в агрессивной тканевой среде на поверхности титана формируется слой окислов, в части случаев обладающих токсичностью.
В связи с этим были предприняты усилия, направленные на разработку материалов нового типа, материалов, которые не обладали недостатками, присущими имплантатам из титана и его сплавов, но не уступали бы им по механическим характеристикам. К таким материалам могут быть отнесены синтетические биорезорбируемые полимеры и кополимеры
Биодеградируемые полимеры могут быть природного происхождения либо синтетические [4].
Синтетические материалы обладают, по сравнению с природными, значительными преимуществами. Они позволяют решить проблему непредсказуемых примесей, исключить опасность возникновения иммунных реакций организма-реципиента, они технологичны, предсказуемы по характеристикам, и, как показал опыт предыдущих десятилетий, могут разрабатываться и совершенствоваться в соответствий с чётко сформулированными медико-техническими требованиями [4].
Оптимальным в порядке медико-технических требований к новым материалам можно было признать нижеследующий комплекс характеристик: высокая биосовместимость, адекватные эпюрам напряженности костной тка-ни прочностные характеристики; синхронность рассасывания/биодегра-дации введенного в кость материала и новообразования костного вещества. Было принято, что этой задаче в значительной степени отвечает по своим характеристикам группа материалов полимерной природы на основе полилактата и полигликолида [4].
Молочная кислота из цепей которой состоит её полимерная форма) обозначена в номенклатуре химических соединений как 2-гидроксипропионовая кислота - СН3СН(ОН)СООН [2].
Соли молочной кислоты - лактаты – это конечные продукты анаэробного распада гликогена или глюкозы; образуются при восстановлении пирувата, катализируемом ферментом лактатдегидрогеназой. При интенсивной работе мышц концентрация лактата резко повышается в мышцах и крови и может достигать 100 мг % . В печени лактат вновь превращается в глюкозу, которая частично окисляется, а частично идёт на синтез гликогена. В этом свете понятен интерес, который был проявлен к этой группе полимеров [1].
Гликолевая кислота из которой образуются полигликолиды представляет собой гидроуксусную кислоту с формулой НОСН2СООН.
Полимеры молочной и гликолевой кислот характеризуются чрезвычайно широким спектром изоформ.
Варианты изоформ обладают различными физико-химическими и механическими свойствами и пространственными межмолекулярными взаимодействиями, особенностями таких характеристик, как растворимость в различных жидких средах, прочность, кристаллизация, скорость полимеризации и биодеградации [3].
В челюстно-лицевой хирургии, согласно полученным данным, особо перспективным представлялось использование указанных полимеров для целей фиксации отломков костей лицевого скелета. В частности, были разработаны фиксаторы из L-полимера молочной кислоты (PLLA). Появились сообщения об эффективном применении фиксирующих пластин и винтов из полимера молочной кислоты при переломах нижней челюсти и скуловых костей [5].
На рынке в качестве изделий медицинского назначения для применения в ортопедии и травмотологии при хирургическом остеосинтезе костей лицевого скелета появились пластины и шурупы из PLLA/PGA Lactosorb одноимённой фирмы [1]. Лактосорб нашел широкое применение в стоматологии и челюстно-лицевой хирургии [3]
Задачи исследования. В связи с вышесказанным в представленной работе ставились нижеследующие задачи:
изучение в динамике эффектов взаимодействия ряда широко используемых в медицинской практике синтетических биорезорбируемых полимерных материалов с прилежащих тканевыми структурами;
сопоставление гистологических проявлений эффекта их воздействия на костную ткань по группам наблюдений;
интерпретация полученных данных на основе результатов собственного исследования и данных литературы о характере и эффектах взаимодействия между синтетическими полимерными материалами указанной группы и тканевым субстратом в области имплантации.
Материал и методы исследования. Опыты ставили на 40 крысах ♂ линии Вистер, массой ≈150 г. В области дистального эпифиза бедренной кости под эфирным наркозом с помощью бора обратный конус №1 воспроизводили сквозные дефекты, которые заполняли одним из испытуемых образцом полимерного материала.
В качестве контрольных наблюдений в эксперимент были включены 8 крыс с аналогичными дефектами бедра, заживающими под кровяным сгустком.
Животных выводили из эксперимента путем передозировки эфирного наркоза в сроки 1, 3, 6 и 10 месяцев. На точку наблюдения было по 2 крысы.
Материал, подлежащий исследованию (бедренная кость), фиксировали в 10% нейтральном формалине 48 часов. Выделенные и освобожденные от мягких тканей костные фрагменты подвергали декальцинации в 25% Трилоне Б. Тканевые образцы проводили через спирты возрастающих концентраций и заключали в парафин. Готовили с помощью ротационного микротома Microm HM 355S толщиной 8μ и окрашивали гематоксилином-эозином. Изучение гистопрепаратов и микрофотосъёмку производили в оптической цифровой системе Axioplan 2 imaging фирмы Carl Zeiss.
Следует отметить, что декальцинированный в Трилоне Б и залитый в парафин материал легко поддавался резке на микротоме, а сам материал образцов в большей своей части растворялся в процессе проводки через заливочные батареи, в связи с чем на срезах на месте образцов испытуемых материалов обычно наблюдались полости со стенками, представленными тканевыми структурами, прилежащими к имплантатам, в некоторых случаях отмечалась визуализация остатков материала в виде полупрозрачных частиц.
Исследовали образцы нижеследующих синтетических полимерных материалов, производных молочной и гликолевой кислот и их сополимеров в различных сочетаниях:
Группа 1. PolyLactide Glycolide Acid (PLGA) - сополимер молочной и гликолевой кислот в процентном соотношении 80/20 соответственно;
Группа 2. Poly-L-Lactide Acid (PLLA) – полимер молочной кислоты;
Группа 3. Poly-96L/4D-Lactide Acid (96/4 PLDLA) – сополимер L-молочной (96%) и D-молочной (4%) кислот;
Группа 4. Poly-70L/30D-Lactide Acid (70/30 PLDLA) – сополимер L-молочной и D-молочной кислот, в процентном соотношении 70/30 соответственно. Материал известен также под названием LactoSorb.
Результаты исследования
Группа 1. Исследовали образцы PolyLactide Glycolide Acid (PLGA) Через месяц 1 месяц от начала опыта в периимплантационной зоне наблюдалась выраженная воспалительная реакция.
Через 3 месяца опыта у имплантата формировался слой рыхлой соединительной ткани. Эта прослойка сохранялась у имплантата местами, на значительном протяжении. И лишь через 6 и 10 месяцев было отмечено превалирование активных процессов остеогенеза с параллельно текущим ремоделированием новообразованной кости (рис. 1).
Следует ещё раз отметить, что сформировавшаяся вокруг остатков имплантационного материала костная ткань местами перемежалась с участками клеточно-волокнистой соединительной ткани, что свидетельствовало об определенном несовершенстве остеогенетических реакций, развивающихся вокруг имплантата.
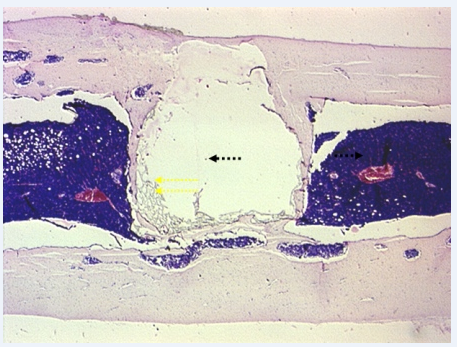
Рис. 1. Группа 1, 6 месяцев опыта. В результате ремоделирования пласт новообразованной костной ткани (одинарные стрелки) у имплантата суживается. За его пределами виден восстановившийся красный костный мозг (сдвоенные стрелки). x25
Группа 2. В этой группе в качестве имплантационного материала выступал Poly-L-Lactide Acid (PLLA) – полимер молочной кислоты.
Через 1 месяц от начала опыта в гистологических препаратах обнаруживалась имплантационная полость с остатками имплантационного материала. Вокруг неё располагались обширные поля новообразованной с наклонностью к компактизации костной ткани, с лакунами заполненными красным костным мозгом. Новообразованная костная ткань обтурировала костномозговой канал.
К 3 месяцам наблюдений, в результате интенсивного развития процесса ремоделирования, новообразованный слой костной ткани у имплантата истончился и принял вид тонкой костной капсулы. Костная ткань у имплантата созревала, её матрикс в зоне контакта с имплантатом уплотнялся и приобретал тонковолокнистый характер (рис. 2).
Однако, отступя от имплантата, можно было видеть участки грубоволокнистого строения кости.
Через 6 месяцев в гистопрепаратах обнаруживалась полость имплантата с остатками имплантационного материала, которая была отграничена от кроветворной ткани, заполнившей костномозговой канал, костной пластиной, матрикс которой содержал лишь небольшое число остеоцитов. Остатки имплантационного материала в полости имели вид скоплений полупрозрачных округлых гранул.
Через 10 месяцев наблюдений костная ткань вокруг имплантата приобретала вид тонкой капсулы. Просвет костно-мозгового канала восстанавливался почти полностью.
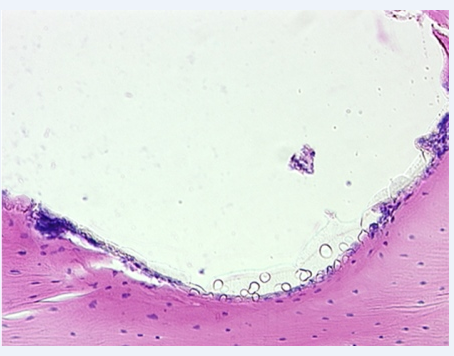
Рис. 2. Группа 2, 3 месяца наблюдений. Костная ткань у имплантата созревает, её матрикс непосредственно в зоне контакта с имплантатом уплотняется и приобретает тонковолокнистый характер. Изнутри костная стенка выстлана соединительнотканными элементами. x200
Группа 3. Использовали Poly-96L/4D-Lactide Acid (96/4 PLDLA) – сополимер L-молочной (96%) и D-молочной (4%) кислот соответственно.
Уже через 1 месяц наблюдений к имплантату прилежала тонкая костная пластина, отделявшая имплантационную полость от красного костного мозга. Вход в имплантационную полость прикрывала новообразованная трабекулярная костная ткань.
Через 3 месяца на уровне костномозгового канала ремоделирование новообразованной вокруг имплантационной полости кости приводило к заметному истончению её пласта. Изнутри костная стенка имплантационной полости была выстлана рыхлой соединительной тканью (рис. 3). На уровне кортикальной пластины костное вещество вокруг полости было оформлено в виде пласта молодой и иррегулярной костной субстанции.
Через 6 месяцев наблюдений продолжалось интенсивное новообразование костной ткани вокруг имплантата, всё ещё частично обтурировавшей костномозговой канал.
Через 10 месяцев опыта в гистопрепаратах наблюдалось утолщение костной стенки имплантационной полости вблизи от участка кортикальной пластины, прикрывшей вход в костный дефект. На уровне костномозгового канала костное вещество образовывало тонкую капсулу вокруг имплантационной полости. Изнутри костная стенка полости имплантата была выстлана тонким слоем рыхлой соединительной ткани, иногда лишь одним рядом мелких округлых и компактных соединительнотканных клеток.
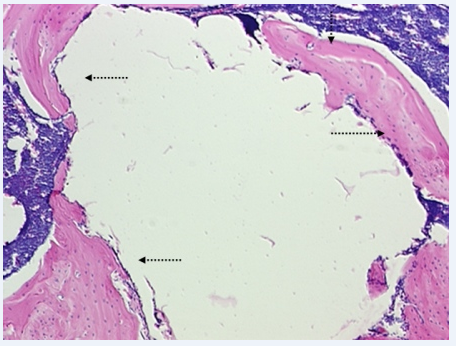
Рис. 3. Группа 3, 3 месяца наблюдений. На уровне костномозгового канала ремоделирование новообразованной вокруг имплантационной полости кости приводит к относительному истончению её пласта. Видна соединительнотканная выстилка имплантационной полости (одинарные стрелки). x50
Группа 4. В этой группе использовали сополимеры Poly-70L/30D-Lactide Acid (70/30 PLDLA) – сополимер L-молочной и D-молочной кислот, в процентном соотношении 70/30 соответственно. Материал известен также под названием LactoSorb.
Через 1 месяц наблюдений имплантационная полость была окружена мощными разрастаниями новообразованной костной ткани. Вход в полость прикрывала тончайшая костная пластика.Костная ткань, располагающаяся и соответствующая кортикальной пластине, была утолщена и характеризовалась наличием многочисленных крупных лакун, содержащих кроветворную ткань.
Костная ткань, прилежащая к имплантационной полости, была относительно молодой, богатой клеточными элементами, её матрикс имел иррегулярное строение, преимущественно с тенденцией к компактизации при сохранении грубоволокнистого характера. В части препаратов под большим увеличением было видно, что выстилка стенки имплантационной полости была представлена фибробластоподобными клеточными элементами с оплетающими их нежными волоконцами.
На уровне костномозгового канала стенка имплантационной полости резко сужалась. Костную стенку имплантационной полости на значительном протяжении выстилали мелкие компактные круглые клетки с плохо различимой цитоплазмой.
Через 6 месяцев наблюдений стенка имплантационной полости была образована тонкой пластиной из зрелого костного вещества, кнаружи от которой были видны крупные костные лакуны, заполненные красным костным мозгом. Ограничивающие их костные трабекулы на некотором расстоянии прерывали протяжённость костномозгового канала. Кое-где в имплантационной полости сохранялись гранулярного вида остатки вещества имплантационного материал.
Через 10 месяцев наблюдений стенка имплантационной полости подвергалась в результате активных процессов ремоделирования значительной редукции, и до такой степени, что она была представлена узкой оксифильной полоской костного вещества. Изнутри она была выстлана частью подвергающимися глубокой дистрофии соединительнотканными клетками (рис.4).
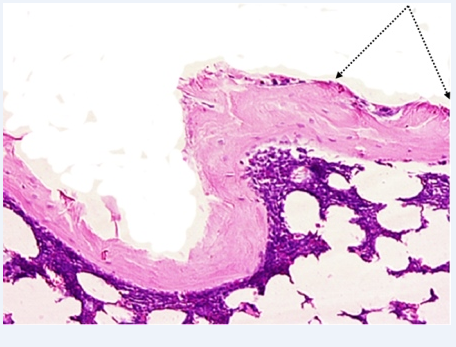
Рис. 4. Группа 4, 10 месяцев наблюдений. Стенка имплантационной полости выстлана частью подвергающимися глубокой дистрофии соединительнотканными клетками (стрелки углом). x200
Заключение. При анализе полученных данных мы исходили из того, что важнейшим критерием, позволяющим объективно оценить интегральные эффекты взаимодействия имплантат – тканевые элементы периимплан-тационной зоны, следует признать характер интеграции (остеоинтеграция или фиброинтеграция).
Анализ результатов экспериментально-морфологического исследования позволил выявить ряд закономерностей, отражающих взаимодействие имплантационных материалов группы синтетических полимеров и сополимеров молочной и полигликолевой кислот.
Процессы протекающие в области контакта имплантат – кость имеют отчетливо фазовый характер:
а. фаза воспалительно-продуктивных реакций;
б. фаза активного новообразования костной ткани преимушественно грубоволокнистого характера, обычно трабекулярного характера, реже с наклонностью к компактизации;
г. фаза ремоделирования или вторичной перестройки.
2. Проведенное исследование выявило определенные различие в темпах и качественных характеристиках структурных проявлений взаимодействия зоне контакта полимерный материал – тканевые структуры.
Как правило, после закономерных посттравматических воспалительных реакций наблюдалось их стихание и непосредственно вокруг имплантатов развивался процесс костеобразования, характер и степень выраженности которого колебались в значительных пределах.
В первой группе [PolyLactide Glycolide Acid (PLGA)] к 3 мес. опыта в области контакта имплантат – прилежащие тканевые структуры наблюдалось образование участков рыхлой соединительной ткани. Одновременно с этим наблюдалось активное построение нового костного вещества. Наличие соединительнотканной компоненты в некоторых из участков зоны контакта/интерфeйса, прослеживающейся, хотя и не столь выражено, и в последующие сроки опыта, свидетельствовало о разнона-правленности процессов, протекающих в этой области, а так же о наличии патогенного эффекта, как одного из следствий локальных взаимодействий.
Вторая группа опыта характеризовалась чрезвычайно активным течением костеобразовательного процесса, о чем свидетельствовало появление в области интерфейса полей костного вещества грубоволокнистого строения, проявляющего тенденцию к компактизации. Однако, и в этой группе в области интерфейса отмечались участки соединительнотканной выстилки.
В группе 3, где материал был представлен Poly-96L/4D-Lactide Acid (96/4 PLDLA) – сополимер L-молочной (96%) и D-молочной (4%) кислот, наблюдалось по сравнению с другими группами опыта, не столь активное образование нового костного вещества. Отмечалось превалирование и персестирование в области интерфейса участков, построенных из рыхлой соединительной ткани.
В группе 4 испытывали сополимеры Poly-70L/30D-Lactide Acid (70/30 PLDLA) – сополимер L-молочной и D-молочной кислот, в процентном соотношении 70/30, соответственно. Материал известен также под названием LactoSorb. В этой группе процессы новообразования кости и её ремоделирования были наиболее оптимальными по интенсивности и темпам.
Однако и в этой группе вплоть до отдаленных сроков (до 10 мес.) в области интерфейса обнаруживались мелкие компактные патологически измененные клетки, свидетельствующие о повреждающих побочных эффектах взаимодействия испытанных полимерных материалов с прилежащими тканевыми структурами.
В заключение, в порядке обсуждения, следует указать на возможные патогенные факторы, обусловливающие описанные выше проявления повреждения тканевых структур. К ним мы отнесли:
а. накопление в области интерфейса кислорадикальных дериватов биодеградации;
б. повышение осмотического давления в результате накопления в этой области продуктов биодеградации;
в. поступление из резорбирующегося материала аддитивов.
г. кроме того, мы считаем, что важную роль в качестве патогенного фактора может играть использование в большинстве синтетических полимерных материалов на основе молочной и гликолевой кислот Д-изо-мерных форм, чуждых по своей биологической природе организму животных и человека.
Скорее всего, эти факторы в условиях настоящего эксперимента действовали комплексно, вызывая в качестве интегрального эффекта описанные выше патологические изменения в прилежащих к испытанным образцам синтетическмх полимерных материалов тканевых структурах.
В литературе мы нашли лишь одно сообщение об экспериментально-мофологическом исследовании, в котором наблюдались аналогичные патогенные эффекты материала на основе полилактата, в [6].
Результаты нашего исследования свидетельствуют об актуальности дальнейших исследований, направленных на разработку новых материалов, которые в процессе биодеградации не вызывали бы патогенных эффектов.
